Тематический материал к теме «Бактериологический метод диагностики»
ПОНЯТИЕ О БАКТЕРИОЛОГИЧЕСКОЙ
ЛАБОРАТОРИИ
Бактериологическая лаборатория − научно-практическое
учреждение, выполняющее бактериологические, иммунологические и
другие микробиологические исследования. Различают медицинские,
ветеринарные и промышленные бактериологические лаборатории.
Медицинские бактериологические лаборатории организуются
при больницах, санитарно-эпидемиологических станциях и т.п. для
проведения исследований в целях уточнения диагнозов и санитарно-
эпидемиологического контроля. При бактериологической лаборато-
рии имеются: средоварня, мойка, препараторская, стерилизационная
и виварий. Устройство и оборудование бактериологических лабора-
торий должны быть приспособлены для выполнения исследований в
стерильных условиях, гарантирующих персонал от возможного зара-
жения. Помещение бактериологической лаборатории должно быть
светлым и просторным. Необходимо исключить возможность сквоз-
няков. Специальное место отводится для окраски препаратов (рис. 38).
Персонал в бактериологической лаборатории
Обязательным оборудованием рабочего места бактериолога яв-
ляются горелка, банка с раствором карболовой кислоты для исполь-
зованных пипеток, закрывающийся сосуд для ваты, штативы для
пробирок и бактериальной петли, эмалированные кюветы, пинцеты,
ножницы, скальпель, предметные и покровные стекла. В бактериоло-
гической лаборатории должны находиться металлические подносы
для чашек Петри, оцинкованные ведра или баки для сброса использо-
ванной посуды. Помимо обычной лабораторной посуды, бактериоло-
гические лаборатории снабжаются специальными видами посуды:
чашки Петри для выращивания бактерий на плотных средах, бакте-
риальные матрацы и др. Необходимы также резиновые груши для
насасывания в пипетки особо опасного материала. Бактериологиче-
ская посуда должна быть чисто вымыта, стерилизована термообра-
боткой и закрыта стерильными ватными пробками. Для стерилизации
посуды не следует применять химических средств, так как их следо-
вые количества могут повлиять на развитие микробов. Важнейшими
для бактериологической лаборатории являются приспособления для
посевов микроорганизмов (бактериальные петли, пастеровские пи-
петки, стеклянные и платиновые шпатели). Для проведения посевов в
асептических условиях бактериологические лаборатории оснащаются
специальными застекленными боксами, оборудованными ультрафио-
летовыми лампами (см. Боксы бактериологические).
Бактериологической лаборатории необходимы: холодильник
для хранения бактериальных культур, сывороток и других биологи-
ческих субстратов; микроскоп с осветителем; центрифуга; термостат
или термостатная комната для выращивания бактерий; аппарат для
встряхивания различных смесей; автоклав, суховоздушный стерили-
затор (печь Пастера) для стерилизации питательных сред, посуды и
электрические стерилизаторы. Подсобные помещения для работы с
лабораторными животными, для мойки и сушки посуды, для розлива
питательных сред и т.п. должны быть соответствующим образом
оборудованы.
79
ТРЕБОВАНИЯ, ПРИМЕНЯЕМЫЕ
Лабораторный стол
Для проведения микробиологического исследования лаборанту
необходимо иметь соответствующим образом оборудованное рабочее
место. Лабораторный стол должен иметь определенную высоту, что-
бы, сидя за ним, легко было микроскопировать. По возможности стол
должен быть покрыт линолеумом, а каждое рабочее место − оцинко-
ванным подносом или зеркальным стеклом. Рабочее место должно
быть снабжено микроскопом, штативами для пробирок и красок, пла-
тиновой петлей и иглой для посевов, чашкой с мостиком для препа-
ратов, промывалкой, песочными часами, предметными и покровными
стеклами, пипетками, набором красок, фильтровальной бумагой,
спиртовой или газовой горелкой и банкой с дезинфицирующим рас-
твором (лизол, карболовая кислота, сулема, хлорамин или лизоформ),
куда опускают для обеззараживания бывшие в употреблении пред-
метные и покровные стекла, пипетки, стеклянные палочки и т.д. По-
суда, в которой выращиваются микробы, обеззараживанию химиче-
скими веществами не подлежит. Следы дезинфицирующих веществ
на такой посуде делают ее в дальнейшем непригодной для роста и
размножения микроорганизмов. После использования посуду скла-
дывают в металлические бачки или ведра с крышкой, пломбируют и
стерилизуют в автоклаве. Мелкий инструментарий (пинцеты, скаль__
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ
БАКТЕРИОЛОГИЧЕСКОГО
ИССЛЕДОВАНИЯ
Преимуществами бактериологического посева являются:
• Высокая специфичность метода (т.е. перекрестных ложных
реакций не наблюдается).
• Возможность исследовать абсолютно любую биологическую
жидкость человека.
• Лечебная цель – определение чувствительности выявленного
микроба к тому или иному лечебному средству (антибиотикограмма),
что позволяет с достаточно высокой точностью проводить лечебные
назначения.
Недостатки бактериологического посева:
• Длительность получения результата.
• Высокие требования к забору материала.
• Определенные требования к квалификации персонала бакте-
риологических лабораторий.
Показания для проведения
ТРЕБОВАНИЯ, ПРИМЕНЯЕМЫЕ
Лабораторный стол


Рабочее место сотрудника бактериологической лаборатории.
Для проведения микробиологического исследования лаборанту
необходимо иметь соответствующим образом оборудованное рабочее
место. Лабораторный стол должен иметь определенную высоту, что-
бы, сидя за ним, легко было микроскопировать. По возможности стол
должен быть покрыт линолеумом, а каждое рабочее место − оцинко-
ванным подносом или зеркальным стеклом. Рабочее место должно
быть снабжено микроскопом, штативами для пробирок и красок, пла-
тиновой петлей и иглой для посевов, чашкой с мостиком для препа-
ратов, промывалкой, песочными часами, предметными и покровными
стеклами, пипетками, набором красок, фильтровальной бумагой,
спиртовой или газовой горелкой и банкой с дезинфицирующим рас-
твором (лизол, карболовая кислота, сулема, хлорамин или лизоформ),
куда опускают для обеззараживания бывшие в употреблении пред-
метные и покровные стекла, пипетки, стеклянные палочки и т.д. По-
суда, в которой выращиваются микробы, обеззараживанию химиче-
скими веществами не подлежит. Следы дезинфицирующих веществ
на такой посуде делают ее в дальнейшем непригодной для роста и
размножения микроорганизмов. После использования посуду скла-
дывают в металлические бачки или ведра с крышкой, пломбируют и
стерилизуют в автоклаве. Мелкий инструментарий (пинцеты, скаль-
80
пели, ножницы) после его использования помещают в стерилизатор и
кипятят в течение 30−60 мин или погружают в 3−5 % мыльно-
карболовый раствор хлорамина на 30−60 мин.
Рабочее место должно содержаться в абсолютной чистоте. Недо-
пустимо, чтобы стол был загрязнен исследуемым заразным материалом
(моча, кал, гной и т.д.). В последнем случае заразный материал со стола
может попасть на другие окружающие предметы, и тогда возможна
внутрилабораторная инфекция. После окончания работы лаборант
должен привести в порядок рабочее место, за которое он отвечает, и с
целью профилактики стекло на рабочем месте протереть кусочком
ваты, смоченным 5 % раствором карболовой кислоты или хлорамина
(рис. 39, 40).
Рис. 39. Техника микроскопирования
бактериологических объектов
Рис. 40. Рабочее место сотрудника бактериологической лаборатории
81
СОВРЕМЕННЫЕ СИСТЕМЫ
БАКТЕРИОЛОГИЧЕСКОГО АНАЛИЗА
Система ВАСТЕС460 − радиометрический метод быстрого
определения роста МБТ (Mycobacterium tuberculosis) путем регистра-
ции уровня меченого СО2, образующегося в процессе утилизации
субстрата с пальмитиновой кислотой, содержащей радиоактивный
С14. Для роста МБТ в данной системе используют флаконы с жидкой
питательной средой, которая представляет собой обогащенную среду
Middlebrook 7H9, содержащую радиоактивный С14. При размноже-
нии МБТ утилизируют С14 и выделяют С1402; в этом случае учет
идет по нарастанию С1402. Применение ВАСТЕС 460 позволило
сократить сроки получения результатов выявления микобактерий до
14 дней, система оказалась пригодной для быстрой идентификации
М. tuberculosis complex и определения лекарственной чувствительно-
сти возбудителя туберкулеза.
Система ВАСТЕС MGIT960 − индикаторные пробирки MGIT (М.
Growth Indicator Tube) с той же средой Middlebrook 7Н9; содержат в
придонной части флюоресцирующий индикатор (трис-4,7-дифенил-1,
10-фенантролин рутениум хлорид пентагидрат), «погашенный» высо-
кими концентрациями 02. В процессе роста МБТ поглощают 02, что
сопровождается усилением свечения индикатора, интенсивность
которого оценивают с помощью трансиллюминатора.
Полностью автоматизированный комплекс позволяет одновре-
менно исследовать лекарственную чувствительность МБТ в 960 ис-
следуемых образцах. Наличие роста МБТ в системе ВАСТЕС реги-
стрируется на 4−5-й день от момента посева. В системе ВАСТЕС, где
используют те же абсолютные концентрации противотуберкулезных
препаратов, учет лекарственной устойчивости идет в течение 6 нед.
В последние годы для быстрого определения лекарственной
устойчивости используют метод микрочипов, основанный на моле-
кулярно-генетическом анализе (ПЦР) выявления точечных мутаций в
гроВ гене, ответственном за устойчивость к рифампицину, и в katG
гене, ответственном за лекарственную устойчивость к изониазиду.
Установлено, что более 95 % устойчивых к рифампицину штам-
мов МБТ содержат точечные мутации (делеции и вставки в гроВ гене,
кодирующих Р-субъединицу РНК-полимеразы) и более 70 % устойчи-
вых к изониазиду штаммов МБТ имеют делеции и вставки в katG
гене, кодирующих каталазу/пероксидазу. Результаты метода микро-
чипов могут быть получены на 3−4-й день исследования
Бактериологическое и паразитологическое исследования проводятся для диагностики и осуществления контроля над распространением инфекции.
Емкости для проб получают накануне в бактериологической (паразитологической) лаборатории.
Подготовка к взятию пробы биологического материала
I. Подготовка к процедуре
1. Уточнить у пациента понимание цели предстоящего исследования и получить его согласие (информированное согласие на процедуру получает врач). В случае неинформированности пациента – уточнить у врача дальнейшую тактику.
2. Объяснить пациенту цель предстоящей подготовки к исследованию и ее последовательность.
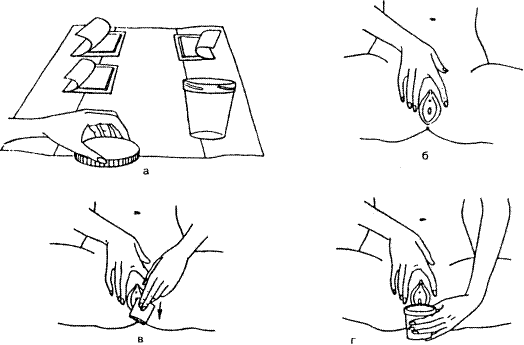
3А. Подготовка женщины (рис. 3):
- Утром накануне процедуры приготовить теплую воду и мыло для подмывания.
- Зайти в туалетную комнату и раздеться ниже пояса.
- Вымыть руки.
- Расстелить бумажное полотенце, положить на него бумажные салфетки и поставить закрытый стерильный сосуд для сбора мочи.
- Тщательно подмыться и насухо вытереться.
- Закрыть вход во влагалище ватным тампоном, во избежание попадания выделений в мочу.
- Выбросить салфетки в унитаз.
Рис. 3.
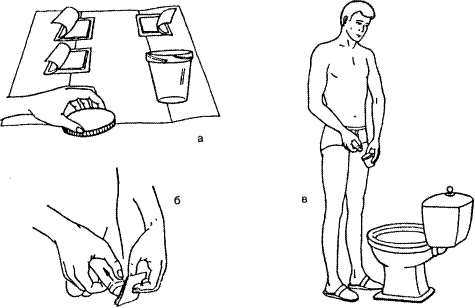
3Б. Подготовка мужчины (рис. 4).
- Приготовить теплую воду и мыло для подмывания.
- Расстелить в туалетной комнате бумажное полотенце, положить на него бумажные салфетки и поставить закрытый стерильный сосуд для сбора мочи.
- Вымыть руки.
- Взять половой член, как при мочеиспускании, освободить головку, отодвинув крайнюю плоть, и вымыть ее водой с мылом.
- Высушить головку полового члена, используя три салфетки; выбрасывать салфетки в унитаз сразу же после однократного промокания.
Рис. 4.
II. Выполнение процедуры
1. Взять емкость для сбора мочи, открыть крышку, не прикасаясь к внутренней поверхности емкости и крышки; положить крышку на бумажное полотенце внутренней поверхностью вверх.
2. Выпустить немного мочи в унитаз и задержать мочеиспускание.
3. Подставить сосуд для мочи, не касаясь им гениталий и ануса (головки полового члена).
4. Собрать в сосуд 3-5 мл мочи и задержать мочеиспускание.
5. Закрыть емкость с мочой крышкой, не касаясь ее внутренней поверхности, и закончить мочеиспускание в унитаз.
6. Вымыть руки. Одеться.
III. Завершение процедуры
1. Отнести в контейнере сосуд с мочой и направление в лабораторию в амбулаторных условиях. В условиях стационара – отдать медсестре.
Примечание: Если невозможно доставить емкость с мочой в лабораторию немедленно, следует поместить ее в специальный (в условиях ЛПУ) холодильник, где хранить при температуре 4°С не более 24 ч.
I. Подготовка к процедуре
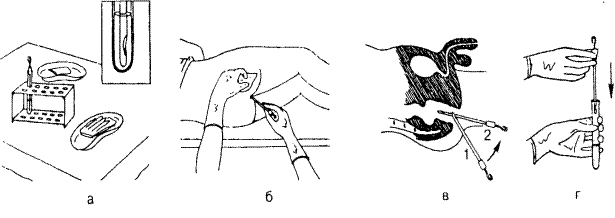
Уточнить у пациента понимание цели и хода предстоящей процедуры и его согласие (информированное согласие на процедуру получает врач).
II. Выполнение процедуры (рис. 5)
1. Надеть перчатки.
2А. В амбулаторных условиях:
- Помочь пациенту лечь на левый бок спиной к вам, попросить его прижать колени к животу.
- Извлечь ректальную петлю из пробирки, удерживая ее только за пробку (пробирка остается в штативе).
- Другой рукой раздвинуть ягодицы и бережно ввести петлю в анальное отверстие.
- Взять материал со стенок прямой кишки легкими круговыми движениями.
- Извлечь петлю из анального отверстия и, не касаясь наружной поверхности пробирки, опустить петлю в пробирку.
2Б. Способ, допустимый в условиях стационара:
- Обеспечить пациента сухим судном.
- После дефекации извлечь ректальную петлю из пробирки, удерживая ее только за пробку.
- Петлей взять из судна 3-5 г фекалий и, не касаясь наружной поверхности пробирки, опустить петлю в пробирку.
или
- Деревянным шпателем взять 3-5 г фекалий и поместить их в стерильную стеклянную емкость.
Рис. 5.
III. Завершение процедуры
1. Снять перчатки, вымыть руки.
2. Заполнить бланк направления в лабораторию. Написать на пробирке номер, соответствующий номеру, указанному в направлении.
3. Доставить пробу и направление в лабораторию (пробирка с петлей в штативе, штатив – в контейнере).
Сбор кала для обнаружения в нем простейших связан с определенными трудностями. Следует помнить, что большинство этих одноклеточных организмов встречается в двух формах: вегетативной – активной, подвижной, жизнедеятельной, легко поддающейся вредным воздействиям (в т.ч. охлаждению) и потому быстро погибающей после выделения из кишечника, и в виде устойчивых к внешним воздействиям цист. При неблагоприятных условиях для их жизнедеятельности (например, уплотнение каловых масс) они превращаются в цисты. В оформленном кале простейшие, как правило, встречаются лишь в форме цист.
Кал для отыскания в нем вегетативных форм должен исследоваться сразу же после его выделения, еще в теплом состоянии. Во-первых, в остывшем кале вегетативные формы простейших быстро гибнут и мертвыми поддаются действию протеолитических ферментов, в результате чего вначале теряют свою структуру, а затем и совсем растворяются.
Во-вторых, при остывании уменьшается, а затем исчезает подвижность простейших – важный вспомогательный фактор при их дифференцировании в лаборатории.
Сохранять кал в термостате не допускается, так как в условиях искусственного подогревания простейшие разрушаются и в последующем не распознаются.
При взятии пробы кала даже при условии своевременного (быстрого, до остывания) исследования нужно учитывать, что в оформленном кале можно обнаружить только цисты, а для обнаружения вегетативных форм следует брать комки слизи, находящейся на поверхности оформленного кала.
Для получения достоверных результатов исследования при обнаружении простейших следует учесть, что:
- жидкие каловые массы исследуют не более чем через 30 мин после дефекации, а оформленные – не более чем через 2 ч после дефекации;
- в фекалиях не должно быть посторонних примесей – воды, мочи и т.д.;
- для сбора кусочков кала пригодны только деревянные палочки (шпатели), так как со стеклянных кусочки слизи, в которых часто находятся паразиты, соскальзывают;
- деревянные палочки сжигают после одноразового использования;
- емкость для пробы должна быть стерильной;
- взятие, хранение и транспортировку пробы проводят с учетом всех необходимых мер инфекционной безопасности.
Пациент должен быть информирован, что выделение простейших с калом происходит непостоянно, поэтому, возможно, однократного исследования недостаточно и его нужно повторять 4-5 раз с интервалом 2-3 дня.
Иногда для обнаружения простейших, особенно амеб, используют материал, полученный при ректороманоскопии. В этих случаях нужно помнить о необходимости правильного обращения с полученным незначительным количеством материала.
Смазывание ректоскопа вазелиновым маслом или глицерином делает последующее исследование затруднительным.
Обучение пациента подготовке и взятию мокроты
I. Подготовка к взятию пробы
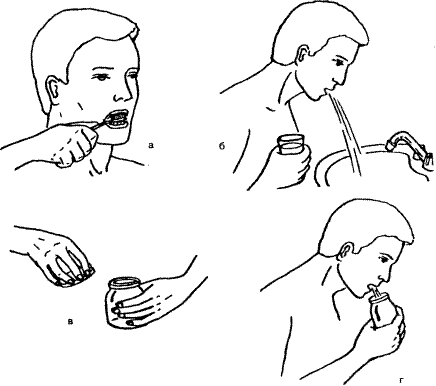
Уточнить у пациента понимание цели предстоящего исследования и его согласие на процедуру.
II. Выполнение процедуры (рис. 6)
1. Обучить пациента подготовке и взятию пробы.
2. Почистить зубы и прополоскать рот кипяченой водой.
3. Взять пробу на исследование при позыве на кашель:
а) снять крышку со стерильной емкости (полученной от медсестры), не касаясь ее внутренней поверхности;
б) поднести ко рту открытую емкость (не прикасаясь к ней губами) и откашлять в нее мокроту;
в) закрыть емкость крышкой и передать ее медсестре.
Рис. 6.
III. Завершение процедуры
1. Убедиться в эффективности обучения: попросить пациента повторить информацию.
2. Доставить емкость с мокротой в контейнере в лабораторию с сопроводительным документом, соблюдая общие меры предосторожности.
Примечание: при невозможности немедленной доставки мокроты в лабораторию, ее можно хранить в специальном холодильнике не более 1-2 ч при температуре 4°С.
I. Подготовка к процедуре
1. Уточнить у пациента понимание цели и хода предстоящего исследования и его согласие на процедуру.
2. Вымыть руки. Надеть маску и перчатки.
II. Выполнение процедуры (рис. 7)
1. Сесть напротив пациента.
2. Извлечь тампон из пробирки, придерживая его за пробку (пробирка остается в штативе).
3. Взять шпатель в другую руку; попросить пациента слегка запрокинуть голову и открыть рот; надавить шпателем на корень языка.
4. Не касаясь тампоном слизистой оболочки полости рта и языка, провести тампоном по дужкам и небным миндалинам (при подозрении на дифтерию - на границе измененной и неизмененной ткани миндалин).
Рис. 7.

Примечание: рекомендуется сначала провести тампоном по правой миндалине, затем – небной дужке, язычку, левой небной дужке, левой миндалине, задней стенке глотки.
При ясно локализованных очагах материал берется двумя тампонами (в две пробирки): из очага и всех участков.
III. Завершение процедуры
1. Извлечь тампон из полости рта, поместить шпатель в специальную емкость с дезинфицирующим раствором, ввести тампон в пробирку, не касаясь ее наружной поверхности.
2. Снять перчатки, маску, вымыть руки.
3. Заполнить бланк направления в лабораторию. Написать на пробирке номер, соответствующий номеру, указанному в направлении. Доставить пробу в лабораторию в контейнере.
I. Подготовка к процедуре
1. Уточнить у пациента понимание цели и хода предстоящего исследования и его согласие на процедуру.
2. Вымыть руки. Надеть маску и перчатки.
II. Выполнение процедуры (рис. 8)
1. Сесть напротив пациента.
2. Извлечь тампон из пробирки, придерживая его за пробку (пробирка остается в штативе).
3. Свободной рукой приподнять кончик носа пациента, другой рукой ввести тампон в левый носовой ход, затем в правый.
Рис. 8.
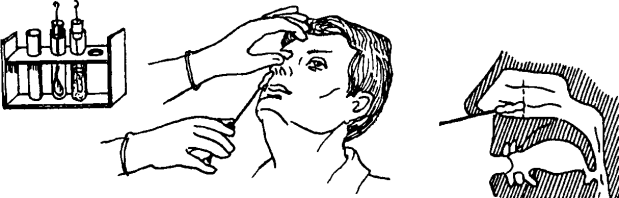
III. Завершение процедуры
1. Извлечь тампон из носа и ввести его в пробирку, не касаясь ее наружной поверхности.
2. Снять перчатки, маску, вымыть и высушить руки.
3. Заполнить бланк направления в лабораторию. Написать на пробирке номер, соответствующий номеру, указанному в направлении. Доставить пробу в лабораторию в контейнере.
I. Подготовка к процедуре
1. Уточнить у пациента понимание цели и хода предстоящего исследования и его согласие на процедуру.
2. Вымыть руки. Надеть маску и перчатки.
II. Выполнение процедуры (рис. 9)
1. Сесть напротив пациента.
2. Извлечь тампон из пробирки, придерживая его за пробку (если тампон не изогнут, извлекая, изогните о внутреннюю стенку пробирки). Пробирка остается в штативе.
3. Взять шпатель в свободную руку. Попросить пациента слегка запрокинуть голову и открыть рот. Надавить шпателем на корень языка.
4. Осторожно, не касаясь тампоном слизистой оболочки полости рта и языка, ввести тампон в носоглотку и провести им по слизистой оболочке.
Рис. 9.
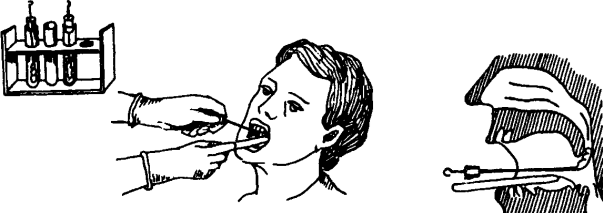
III. Завершение процедуры
1. Извлечь тампон из носоглотки, поместить шпатель в специальную емкость с дезинфицирующим раствором, ввести тампон в пробирку, не касаясь ее наружной поверхности.
2. Снять перчатки, маску, вымыть руки.
3. Заполнить бланк направления в лабораторию. Написать на пробирке номер, соответствующий номеру, указанному в направлении. Доставить пробу в лабораторию в контейнере.
ПОСТТЕСТ
«ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ»
I вариант
Дайте один правильный ответ.
1. Кровь на биохимические анализы берется:
а) утром натощак;
б) после завтрака;
в) в любое время суток;
г) перед обедом.
ЭТАПЫ БАКТЕРИОЛОГИЧЕСКОГО
ИССЛЕДОВАНИЯ
Бактериологическое исследование проводится в несколько
этапов.
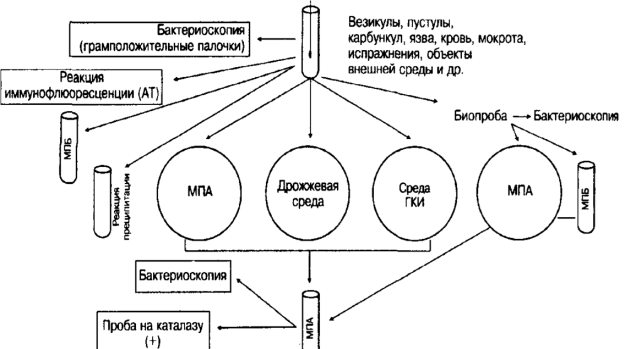
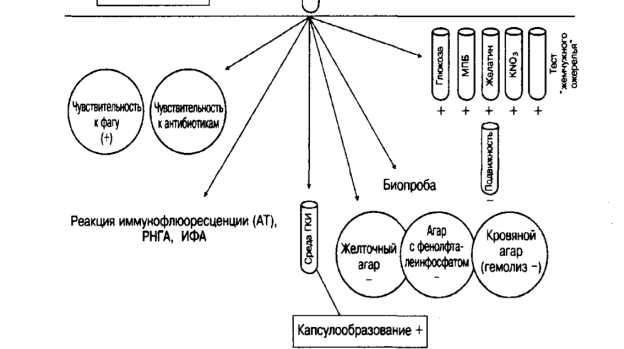
Принципиальная схема бактериологического выделения
возбудителя сибирской язвы
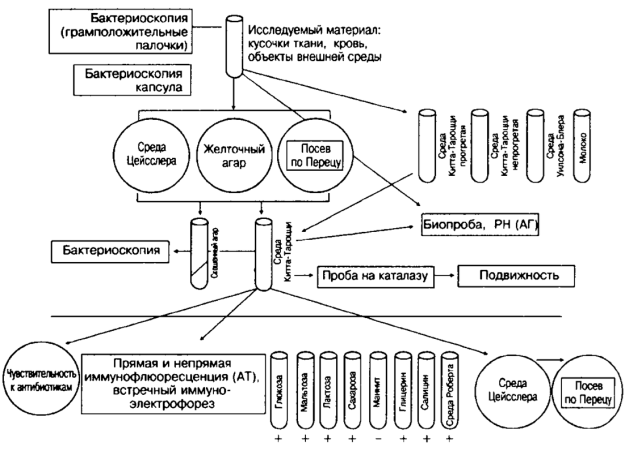
Схема бактериологического исследования
на Clostridium perfringens
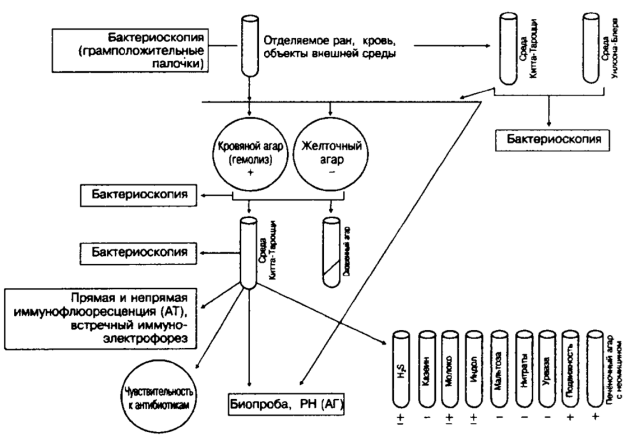
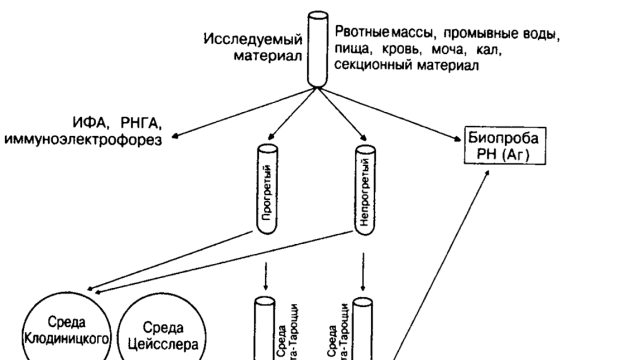
Схема бактериологической идентификации Clostridium tetani
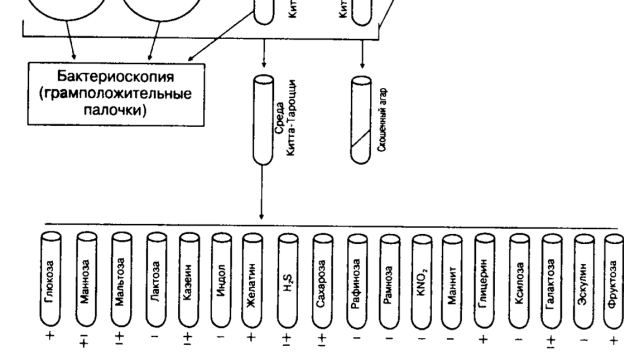
Принципиальная схема бактериологического выделения
Clostridium botulinum
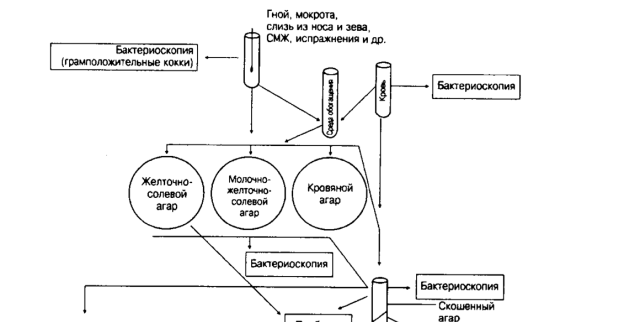
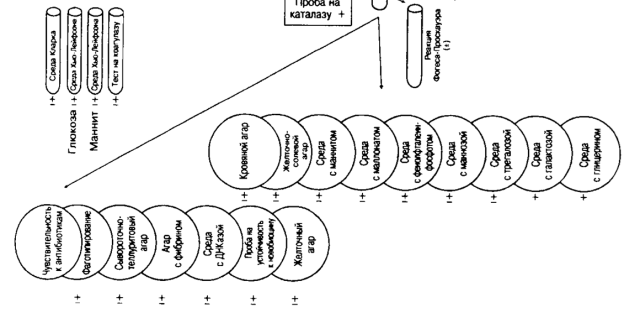
Принципиальная схема выделения стафилококков
На питательные среды
Для некоторых видов материалов осуществляют предваритель
ную подготовку их для посева, а затем инкубацию посевов для всех
видов при условиях, соответствующих свойствам искомых бактерий.
Посев тампоном
При посеве тампоном чашку открывают одной рукой, тампоном
касаются поверхности агара возле края чашки и начинают проводить
посев штрихами от края к краю чашки, втирая осторожно материал в
поверхность среды, не повреждая его, постепенно вращая тампон.
После проведения посева чашку вращают на 90° и повторяют посев
перпендикулярно к предыдущему.
При посеве уколом в столбик питательной среды пробирку
с мясо-пептонним агаром, желатином и т.п. берут в левую руку, пет-
лю с материалом – в правую и делают укол к дну пробирки в среду.
Петлю осторожно вынимают, а пробирку закрывают.
Рис. 12. Метод Дригальского
Метод посева истончающим штрихом сегодня используется
в микробиологических лабораториях чаще всего. Существует
нескольько способов посева штрихом (рис. 13).
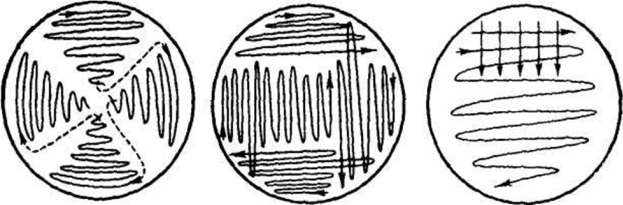
Схемы метода посева истончающим штрихом
Метод штрихов
Для получения изолированных колоний можно использовать
посев тампоном, которым проводили забор исследуемого материала.
Несколько приоткрывают чашку Петри с питательной средой, вносят
туда тампон и осторожными движениями втирают материал в по-
верхность чашки, возвращая постепенно тампон и чашку.
Таким образом, существенное преимущество методов пластин-
чатых разведений Коха, Дригальского и штриховых посевов заклю-
чается в том, что они создают изолированные колонии микроорга-
низмов, которые при инокуляции на другую питательную среду
превращаются в чистую культуру.
Культуры
На данном этапе изучаются биохимические, биологические, се-
рологические и генетические свойства культуры.
С помощью бактериофагов
Бактериофаги имеют выраженное литическое действие на мик-
роорганизмы. Эту особенность используют для определения их вида.
С этой целью в две пробирки с мясо-пептонным бульоном засевают
исследуемую культуру бактерий. Потом в одну из них добавляют не-
сколько капель индикаторного фага. Пробирки инкубируют при
оптимальной температуре в течение 18−24 ч. Сравнивают мутность
бульона в контрольной и опытной пробирках и делают вывод о чув-
ствительности микроорганизмов к литическому действию бакте-
риофагов (рис. 19).

Рис. 19. Литическое действие бактериофагов
(справа – позитивный результат)
С этой целью можно использовать плотную питательную среду,
на которую газоном засевают исследуемую культуру бактерий. После
подсушивания чашек на них бактериологической петлей или пасте-
ровской пипеткой наносят каплю соответствующего разведения бак-
териофага, которое указано на ампуле. Посевы инкубируют в термо-
стате при 37 °С в течение 18−24 ч и фиксируют наличие прозрачных
круглых пятен, которые свидетельствуют о литическом действии
бактериофагу. Позитивный результат свидетельствует о принадлеж-
ности бактерий к определенному виду.
Фаготипирование микроорганизмов проводят с целью анализа
эпидемиологической ситуации для определения источника инфекции.
Чаще всего его выполняют при диагностике стафилококковых, ки-
шечных и других инфекций.
В основе теста лежит определение фаговариантов (фаговаров)
возбудителей. Для этого дно чашки с мясо-пептонным агаром по
числу бактериофагов разделяют на квадраты. Выращивают четырех-
часовую бульонную культуру исследуемого штамма и 1 мл ее засе-
вают на поверхность среды. Распределяют равномерно культуру по
поверхности среды и избыток ее сливают. Чашку подсушивают в
термостате при 37 °С в течение 30−40 мин и на поверхность агара в
каждый квадрат капают пипеткой бактериофаги соответствующих
разведений. Посевы ставят в термостат или оставляют при комнатной
температуре в течение 18−20 ч, после чего оценивают результаты.
Учет результатов проводят на темном фоне с помощью лупы. В зави-
симости от степени чувствительности культуры к бактериофагам вы-
деляют разные степени лизиса бактерий, который оценивается по
наличию лизиса или его отсутствию (рис. 20).

Рис. 20. Фаготипирование бактерий
Учитывая, что чувствительность бактерий к фагу является до-
статочно постоянным признаком, сравнивают фаготипы исследуемых
культур с фаготипом микроба, который был выделен от достоверного
источника инфекции. При их совпадении делают вывод об обнару-
женном источнике инфекции.
ИССЛЕДОВАНИЯ
• Кровь. Кровь для исследования следует брать у больного в
период подъема температуры тела, в начале появления лихорадки.
Рекомендуется исследовать 3−4 пробы крови, взятые с интервалом
4−6 ч, что обоснованно с точки зрения снижения риска «упустить»
транзиторную бактериемию и повышения возможности подтвердить
этиологическую роль выделенной из крови условно-патогенной мик-
рофлоры (например, Staphylococcus epidermidis), если эта микрофло-
ра обнаруживается в нескольких пробах венозной крови. Пробу кро-
ви в количестве 10 мл у взрослого и 5 мл у детей засевают как
минимум в два флакона со средой для аэробных и анаэробных мик-
роорганизмов в соотношении 1:10. Желательно однократное иссле-
дование и артериальной крови.
• Спинномозговая жидкость. Взятие спинномозговой жидкости
(СМЖ) производит врач при люмбальной пункции в количестве
1−2 мл в сухую стерильную пробирку. Пробу немедленно доставляют
в лабораторию, где к ее исследованию приступают также немедлен-
но. При отсутствии такой возможности материал сохраняется при
37 °С в течение нескольких часов. Существенно повышает количество
положительных результатов бактериологического исследования посев
1−2 капель СМЖ в пробирку, содержащую полужидкую среду с глюко-
зой, и в чашку Петри с «кровяным» агаром. Для пересылки материала
используют изотермальные ящики, грелки, термосы или любую дру-
гую упаковку, где поддерживается температура около 37 °С.
• Испражнения. Испражнения для бактериологического иссле-
дования отбирают с помощью стерильных деревянных шпателей в
количестве 3−5 г в стерильный сосуд с плотно закрывающейся
крышкой. Исследование взятого материала должно быть начато не
позже чем через 2 ч. Если невозможно приступить к исследованию в
течение этого времени, следует отобрать небольшое количество ма-
териала, который помещают в соответствующую транспортную сре-
ду. При отборе испражнений следует стремиться направлять для ис-
следования патологические примеси (слизь, гной, частицы эпителия
и др.), если они имеются, избегая попадания в материал примеси кро-
ви, обладающей бактерицидными свойствами.
Для взятия материала могут быть использованы ректальные
тампоны (с ватным наконечником). Тампон должен быть увлажнен
стерильным изотоническим раствором натрия хлорида или транс-
портной средой (но не масляным гелем). Его вводят per rectum на
глубину 5−6 см и, поворачивая тампон, осторожно его извлекают,
контролируя появление на тампоне фекальной окраски. Тампон по-
мещают в сухую пробирку, если к исследованию материала присту-
пят в течение 2 ч, в ином случае − в транспортную среду.
• Мочу (средняя порция свободно выпущенной мочи) в коли-
честве 3−5 мл собирают в стерильную посуду после тщательного
туалета наружных половых органов.
Предпочтительней отбирать утренние порции мочи.
• Желчь собирают во время дуоденального зондирования в
процедурном кабинете отдельно по порциям А, В и С в три стериль-
ные пробирки, соблюдая правила асептики.
Промывные воды желудка собирают в стерильные банки в ко-
личестве 20−50 мл. Следует иметь в виду, что промывание желудка в
этих случаях проводят только индифферентными (не обладающими
бактериостатическим или бактерицидным действием на микроорга-
низмы) растворами − лучше кипяченой водой (без добавления соды,
перманганата калия и пр.).
• Мокрота. Утреннюю мокроту, выделяющуюся во время при-
ступа кашля, собирают в стерильную банку. Перед откашливанием
больной чистит зубы и полощет рот кипяченой водой с целью меха-
нического удаления остатков пищи, слущенного эпителия и микро-
флоры ротовой полости. Промывные воды бронхов. При бронхоско-
пии вводят не более 5 мл изотонического раствора натрия хлорида с
последующим его отсасыванием в стерильную пробирку.
• Материал, отделяемый глоткой, ротовой полостью и носом.
Материал из ротовой полости берут натощак или через 2 ч по-
сле еды стерильным ватным тампоном либо ложечкой со слизистой
оболочки и ее пораженных участков у входов протоков слюнных же-
лез, поверхности языка, из язвочек. При наличии пленки последнюю
снимают стерильным пинцетом. Материал из носовой полости заби-
рают сухим стерильным ватным тампоном, который вводят в глубь
полости носа. Материал из носоглотки берут стерильным заднегло-
точным ватным тампоном, который осторожно вводят через носовое
отверстие в носоглотку. Если при этом начинается кашель, тампон не
удаляют до окончания кашля. Для проведения анализа на дифтерию
исследуют одновременно пленки и слизь из носа и глотки, забирая
материал разными тампонами.
Исследуемый материал засевают на плотные питательные сре-
ды, используя специальные методики для получения роста отдельных
колоний микроорганизмов, которые далее отсевают с целью выделе-
ния чистой культуры возбудителя. Определенные виды бактерий
выделяют, используя элективные (избирательные) среды, которые за-
держивают рост посторонних микроорганизмов или содержат веще-
ства, стимулирующие рост определенных патогенных микробов. Вы-
деленные на питательных средах микроорганизмы идентифицируют,
т.е. определяют видовую или типовую их принадлежность. В послед-
нее время для идентификации в практике здравоохранения исполь-
зуют микротест-системы, представляющие собой панели с набором
дифференциально-диагностических сред, что ускоряет исследование.
Микротест-системы применяют и для определения чувствительности
микроорганизмов к антимикробным препаратам методом разведения
антибиотика в жидкой питательной среде.
Оценивая результаты бактериологического исследования, врач
должен учитывать, что отрицательный результат не всегда означает
отсутствие возбудителя и может быть связан с применением анти-
микробных препаратов, высокой микроцидной активностью крови,
техническими погрешностями. Обнаружение патогенного микроба
в материале от больного вне связи с клинической картиной возможно
в случае реконвалесцентного, здорового или транзиторного бактерио-
носительства.
Выделение из крови при соблюдении всех правил асептики
условно-патогенных микроорганизмов (эпидермальный стафилококк,
кишечная палочка) и даже сапрофитов следует считать проявлением
бактериемии, особенно если эти микробы обнаружены больше чем в
одной пробе материала или в разных субстратах (кровь, моча), по-
скольку при снижении иммунореактивности организма эти и другие
«непатогенные» микроорганизмы могут быть возбудителями инфек-
ционных процессов, в том числе и сепсиса.
Определенную сложность представляет трактовка результатов
бактериологического исследования нестерильных сред, а именно до-
казательство этиологической роли условно-патогенных микроорга-
низмов. В этом случае учитывают в комплексе такие показатели, как
вид выделенных культур, количество микробных клеток данного ви-
да в материале, повторное их выделение в течение заболевания, при-
сутствие монокультуры или ассоциации микроорганизма.
СПИСОК ЛИТЕРАТУРЫ
1. Борисов, Л. Б. Медицинская микробиология, вирусология,
иммунология / Л. Б. Борисов. − 4-е изд. перераб. и доп. − М. : Меди-
цинское информагенство, 2005. − 735 с.
2. Васильев, Д. А. Методы общей бактериологии : учеб.-метод.
пособие / Д. А. Васильев, С. Н. Золотухин, Н. М. Никишина. – Улья-
новск, 1998.
3. Воробьев, А. А. Медицинская и санитарная микробиология :
учеб. пособие для студентов мед. вузов / А. А. Воробьев, Ю. С. Кри-
вошеин, В. П. Широбоков. − М. : Academia, 2005. − 462 с.
4. Зверев, В. В. Микробиология, Вирусология, иммунология :
учеб. / В. В. Зверев. − М. : Медицина, 2007. – 814 с.
5. Лабинская, А. С. Микробиология с техникой микробиологи-
ческих исследований : руководство / А. С. Лабинская. − М. : Меди-
цина, 2005. – 157 с.
6. Нетрусов, А. И. Микробиология : учеб. / А. И. Нетрусов,
И. Б. Котова. − 3-е изд., испр. − М., 2009. − 352 с.
7. Основы микробиологии, вирусологии и иммунологии : учеб.
пособие / под ред. А. А. Воробьева, Ю. С. Кривошеина. − М. : Высш.
шк., 2001. − 224 с.
8. Поздеев, О. К. Медицинская микробиология : учеб. /
О. К. Поздеев. М., 2004. – 779 с.
9. Ткач И. С. Бактериологическое исследование кала. Анализ
кала на дисбактериоз, анализ кала на кишечную инфекцию /
И. С. Ткач // Клиническая микробиология и антимикробная химиоте-
рапия. – 2014. № 10(3). – С. 135−144.
10. Шаршкова, М. А. Результаты бактериологического иссле-
дования у пациентов с кератитом / М. А. Шаршкова, Л. А. Деев //
Клиническая микробиология и антимикробная химиотерапия. − 2012. −
№ 14(3). – С. 260−264.
11. Хаитов, Р. М. Иммунология : учеб. / Р. М. Хаитов. − М. :
Тематический материал к теме «Бактериологический метод диагностики»
Дата: 2019-03-05, просмотров: 635.