Вычисляют площадь S , занимаемую одной молекулой изобутилового спирта в насыщенном адсорбционном слое:
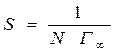 ,
,
где N – число Авогадро, равное 6,023*1023.
Вычисляют длину молекулы ( l ) изобутилового спирта:
l = М·Гмах. / d,
где М – молекулярная масса изобутилового спирта,
d – удельная плотность спирта – d = 0,808.
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Что такое сорбция и каковы её виды.
2. Что такое поверхностное натяжение и методы его изменения.
3. Поверхностно-активные вещества. Примеры. Практическое применение ПАВ.
4. Уравнение Гиббса и его анализ.
5. Смачивание, виды смачивания и его мера.
ЛАБОРАТОРНАЯ РАБОТА № 9
КОЛЛОИДЫ, ИХ ОБРАЗОВАНИЕ И СВОЙСТВА
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: Изучение получения коллоидных систем двумя методами конденсационным и дисперсионным. Очистка коллоидных растворов методом диализа. Устройство простейшего диализатора. Получение коллоидных систем с помощью химических реакций двойного обмена и термического гидролиза. Использование электрофоретического метода для измерения величины и знака электрокинетического потенциала. Устойчивость коллоидных систем, величина электрокинетического потенциала как мера устойчивости. Расчет дзета-потенциала по формуле Смолуховского. Кинетические явления в коллоидных системах, наблюдение броуновского движения с помощью ультрамикроскопа. Наблюдение эффекта Тиндаля.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Электрокинетическая трубка в модификации С.Н. Булычёва.
2. Две конические колбы по 250 мл и одна коническая колба на 100 мл.
3. Покровное стекло с фильтрованной бумагой для определения знака электрода.
4. Электроды и источник постоянного тока.
5. Газовая горелка.
6. Ультрамикроскоп.
7. Набор коллоидных и истинных растворов, источник света с собирающими линзами.
8. 0,02 М растворы хлорида калия (KCl)и азотнокислого серебра (AgNO3).
9. 2% раствор хлорного железа (FeCl3).
10. Фенолфталеин.
11. Насыщенный раствор хлорида калия.
12. Надстилающая жидкость.
13. Дистиллированная вода.
Задание 1. Получение гидрозоля гидрата окиси железа конденсационным методом.
Записать происходящую реакцию образования коллоидной частицы Fe ( OH )3 (при нагревании).
Аналогичный опыт проводят с холодной водой.
Сделайте соответствующие выводы и напишите формулу образовавшейся мицеллы.
Задание 2. Испытание на коллоидность полученных растворов – эффект Тиндаля.
Сделать вывод:
Задание 3. Наблюдение броуновского движения частиц гидрозоля при помощи ультрамикроскопа.
Задание 4. Определение знака заряда и величины дзета-потенциала гидрозоля хлорида серебра электрофоретическим методом.
Таблица 19
Результаты определение ζ – потенциала
| Положение границ раздела, см | Смещение S, см | Время t, c | Е, В |
| z - потенциал, В | Знак заряда | |||
| До прохождения тока | После прохождения тока | ||||||||
| Катод | анод | катод | анод | ||||||
Вычисляют величину z - потенциала по уравнению
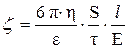 ,
,
где h - вязкость дисперсионной среды, e - диэлектрическая проницаемость, 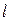 - расстояние между электродами (см), Е – электродвижущая сила (В), S - расстояние (см), пройденное дисперсной фазой за время t (с).
- расстояние между электродами (см), Е – электродвижущая сила (В), S - расстояние (см), пройденное дисперсной фазой за время t (с).
После подстановки постоянных величин уравнение принимает вид
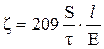
Смещение золя S равно полусумме расстояний, пройденных дисперсной фазой в катодном и анодном коленах U – образной трубки.
Знак заряда коллоидных частиц противоположен знаку заряда того электрода, по направлению к которому смещался золь.
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Классификация дисперсных систем.
2. Методы получения и очистки коллоидных систем.
3. Кинетическая и агрегативная устойчивость коллоидных систем.
4. Теория ДЭС по Штерну.
5. Строение коллоидной мицеллы.
ЛАБОРАТОРНАЯ РАБОТА № 10
КОАГУЛЯЦИЯ КОЛЛОИДОВ
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ:
Изучение правила Шульце – Гарди на примере коагуляции гидрофобных коллоидов. Определение иона – коагулятора, порога коагуляции и коагулирующей силы электролита. Расчет коагулирующей силы ионов – коагуляторов для различных электролитов. Изучение коагуляции и высаливания для гидрофобных и гидрофильных коллоидных систем. Обратимая и необратимая коагуляция.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Штатив с пробирками.
2. Автоматические пипетки на 1 мл.
3. Измерительные бюретки.
4. Растворы гидрозолей по заданию преподавателей.
5. 1 М растворы электролитов (хлорид калия, хлорид кальция, сульфата калия).
6. Дистиллированная вода.
7. Спирт этиловый 96%.
8. Концентрированный раствор сульфата аммония (NH4)2SO4.
9. 2% раствор желатины.
Задание 1. Определение порога коагуляции гидрофобных золей, вычисление коагулирующей силы ионов – коагуляторов и знака заряда частиц.
Коагуляцию гидрофобных золей осуществляют действием следующих растворов: KCl, K2SO4, CaCl2 (все растворы 1 М), результаты определения заносят в таблицу 20.
Таблица 20
Результаты определения порога коагуляции гидрофобных золей
| N п/п | Концентрация электролита С, ммоль/л | Номер испытуемого золя | ||
| KCl | CaCl2 | K2SO4 | ||
| 1 2 3 4 … | ||||
По величине порогов коагуляции устанавливают ионы-коагуляторы. Затем вычисляют коагулирующую силу иона-коагулятора, условно принимая коагулирующую силу одновалентного иона равной единице. Коагулирующую силу двухвалентного иона (S) вычисляют по формуле
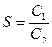 .
.
Результаты заносят в таблицу 21.
Таблица 21
Дата: 2019-03-05, просмотров: 375.
 , см
, см