| V мл, NaOH | Rсравн., Ом | m | Rx, Ом | c, Ом см |
| 0 1 2 3 4 ... |
где Rсравн – сопротивление магазина (1, 10, 1000, 10000 ом), m – точка компенсации, Rx – сопротивление раствора (Rсравн.*m).
Рассчитывают c раствора:
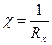
По полученным данным строят кривую титрования и рассчитывают концентрацию кислоты:
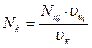 .
.
График
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. На чем основан метод кондуктометрического титрования.
2. Преимущества и точность кондуктометрического метода.
3. Недостатки метода кондуктометрического титрования.
4. Использование метода кондуктометрического титрования в агрономических объектах.
5. Графики кондуктометрического титрования сильной, слабой и смеси кислот.
ЛАБОРАТОРНАЯ РАБОТА № 6
ТЕРМОХИМИЯ. ЗАКОН ГЕССА. ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ. ОПРЕДЕЛЕНИЕ ЭНТРОПИИ РЕАКЦИИ
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: устройство калориметра для измерения тепловых эффектов химических реакций. Измерение водяного числа калориметра и теплового эффекта химической реакции Zn + CuSO 4 = Cu + ZnSO 4 + Q . Расчет свободной энергии Гиббса (G) и изменения энтропии (ΔS).
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Калориметр с механической мешалкой;
2. Металлический цинк (3 г);
3. Хлористый калий (7,2 г);
4. 0,05 М раствор сульфата меди;
5. Измерительный стакан объемом 500мл
Задание 1. Определение постоянной калориметра
Теплота химической реакции, принимаемая или отдаваемая водяным калориметром, будет изменять температуру воды, находящейся в стакане Б, и температуру других частей прибора, находящихся в воде. В этом случае количество теплоты будет равно
Q = (M1C1 + M2C2) × Dt
где M1 - масса воды, С1 - теплоемкость воды, М2 и С2 - усредненные значения масс и теплоемкости для стекла стакана, мешалки и других частей калориметра.
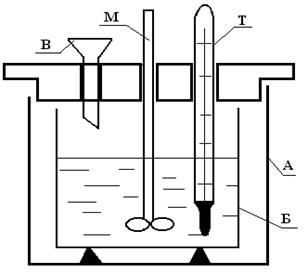
Рис.1. Калориметр.
А – внешний сосуд, Б – внутренний сосуд, в который заливается реагент, Т – термометр, М – мешалка, В – воронка, через которую всыпается второй реагент.
При данном наполнении стакана Б и неизменности частей, погружаемых в воду, М1С1 + М2C2 = const = Z - постоянной калориметра. Таким образом,
Q = Z×Dt
из чего следует, что при Dt = 1° Q = Z, иначе говоря, постоянная калориметра - это количество теплоты, необходимое для изменения температуры всех частей калориметра на 1°. Следовательно, до проведения эксперимента по определению теплового эффекта химической реакции Qp следует прокалибровать прибор (калориметр), т.е. определить постоянную калориметра Z. Этого можно достичь, вводя или отнимая известное количество теплоты (Qp) в данном калориметре с одновременным точным измерением изменения температуры. Тогда постоянную калориметра можно определить по формуле
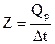
В работе постоянная Z устанавливается по теплоте растворения KCl, для этого производят измерения изменения температуры при растворении KCl, данные заносят в таблицу 10.
Таблица 10
Определение постоянной калориметра
Масса KCl – 7,2 г.
| Периоды, мин. | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин. | Температура, град. | Время, мин. | Температура, град. | Время, мин. | Температура, град. |
| 0 | 10,5 | 16 | |||
| 1 | 11,0 | 17 | |||
| 2 | 11,5 | 18 | |||
| 3 | 12,0 | 19 | |||
| 4 | 12,5 | 20 | |||
| 5 | 13,0 | 21 | |||
| 6 | 13,5 | 22 | |||
| 7 | 14,0 | 23 | |||
| 8 | 14,5 | 24 | |||
| 9 | 15,0 | 25 | |||
| 10 | 15,5 | 26 | |||
Полученные данные наносят на миллиметровую бумагу, откладывая по оси абсцисс время в минутах, а по оси ординат – температуру. Через точки предварительного и заключительного периодов проводят прямые линии. Из последней точки предварительного и первой точки заключительного периода опускают перпендикуляр на ось абсцисс. Находят середину главного периода. Из середины главного периода проводят перпендикуляр до пересечения с продолжением прямых предварительного и заключительного периодов. Из точек пересечения опускают перпендикуляры на ось ординат. Отсекаемый отрезок на оси ординат (t1 - t2) равен Dt.
Тепловой Qp, как ранее было сказано, вычисляется на 1 моль прореагировавшего вещества, но в данном случае в калориметре находилось g г вещества, а потому
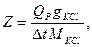
где g - навеска КСl, М – молекулярная масса для КСl, Qp в случае растворения KCl в воде равно 4440 кал/моль.
Задание 2. Определение теплового эффекта реакции окисления металлического цинка и восстановления ионов меди в водном растворе
Тепловые эффекты реакций измеряются так же, как постоянная калориметра.
Полученные данные записывают в таблицу 11, строят график изменения температуры и находят Dt.
Таблица 11
Определение теплового эффекта реакции
| Периоды, мин. | |||||
| Предварительный | Главный | Заключительный | |||
| Время, мин. | Температура, град. | Время, мин. | Температура, град. | Время, мин. | Температура, град. |
| 0 | 10,5 | 16 | |||
| 1 | 11,0 | 17 | |||
| 2 | 11,5 | 18 | |||
| 3 | 12,0 | 19 | |||
| 4 | 12,5 | 20 | |||
| 5 | 13,0 | 21 | |||
| 6 | 13,5 | 22 | |||
| 7 | 14,0 | 23 | |||
| 8 | 14,5 | 24 | |||
| 9 | 15,0 | 25 | |||
| 10 | 15,5 | 26 | |||
Тепловой эффект реакции рассчитывают по уравнению
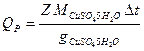 ,
,
где gCuSO4 5H2O – количество кристаллогидрата, содержащегося в 400 мл 0,05 М раствора.
ВЫЧИСЛЕНИЯ:
Максимальная работа по перенесению заряда равна (Дж×моль-1)
W = n × F × E ,
где n – число переносимых электронов, F - число Фарадея (96500 Кл), E - электродвижущая сила (1,10 В). Максимальная работа равна, но противоположна по знаку изменению свободной энергии DG. Следовательно, DG процесса можно рассчитать по уравнению:
W = - DG
“ – “ означает, что работа совершается против сил внешней среды. При расчете DS “ минус “ не учитывается.
Свободная энергия является частью энтальпии и связана с ней соотношением DG = DH - T×DS, где T×DS – связанная энергия. Зная DH и DG, можно рассчитать энтропию реакции окисления цинка и восстановления ионов меди по уравнению
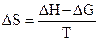 ,
,
где Т – температура, при которой проводился эксперимент (температура окончания реакции окисления Zn с точностью до 10).
После проведения вычислений их результаты заносят в таблицу 12.
Таблица 12
Результаты вычислений
| Опыт | Dt, OC | Z | QP, ккал/моль | DG, кДж/моль | DS, Дж/моль К |
| Определение Z | - | - | |||
| Определение QP | - |
Графическое определение Δ t для вычисления постоянной калориметра ( Z ).
Δt =
Графическое определение Δ t для вычисления теплового эффекта реакции .
Δt =
ВЫЧИСЛЕНИЯ:
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Первое начало термодинамики. Его математическая запись.
2. Что представляет собой энтальпия, каков её физический смысл.
3. Тепловые эффекты при постоянном объеме и постоянном давлении.
4. Второе начало термодинамики. Его математическая запись.
5. Закон Гесса, его математическая запись и следствия.
ЛАБОРАТОРНАЯ РАБОТА 7
Дата: 2019-03-05, просмотров: 338.