ОСНОВНЫЕ ПРАВИЛА РАБОТЫ В ЛАБОРАТОРНОМ ПРАКТИКУМЕ
1. К учебным занятиям в химической лаборатории практикума физической и коллоидной химии допускаются лица, прошедшие инструктаж по технике безопасности при выполнении работ лабораторного практикума.
2. Студенты и другие обучаемые лица перед началом занятий размещаются в учебных лабораториях. Нахождение их в других помещениях кафедры без разрешения преподавателя или без сопровождения сотрудником кафедры не допускается.
3. До начала занятий не разрешается приступать к выполнению лабораторных работ, брать и переставлять реактивы и химическую посуду на столах, включать приборы и оборудование. К работе приступать только после начала занятий и с разрешения преподавателя или лаборанта. Не приступайте к работе без уяснения всех требований техники безопасности.
4. В ходе учебных занятий строго придерживайтесь порядка и метода выполнения работы, согласно имеющихся требований. Пользуйтесь реактивами и посудой, предназначенными только для выполнения данной работы. Не берите реактивы и химическую посуду с других столов. При отсутствии требуемого реактива обращайтесь к лаборанту или преподавателю.
5. Категорически запрещается проводить в лаборатории какие-либо работы, не связанные с выполнением полученного от преподавателя задания.
6. Во время занятий в лаборатории необходимо соблюдать чистоту, тишину, выполнять требования техники безопасности, указания преподавателя или старшего лаборанта. Запрещается посторонним лицам посещать студентов, работающих в лаборатории и отвлекать их.
7. При работе не пробуйте на вкус и не нюхайте никаких реактивов и растворов. Не пейте в лаборатории воду и не принимайте пищу.
8. Соблюдайте осторожность при выполнении работ. Не допускайте попадания реактивов на слизистые оболочки рта, носа и глаз. При попадании реактивов на слизистые оболочки немедленно сообщите об этом преподавателю.
9. Экономьте газ, электричество, воду, реактивы. Не превышайте установленных норм расхода реактивов.
10. Растворы солей серебра сливайте в специальную посуду. Почвенные растворы собирайте в специальные емкости.
11. При неисправности электропроводки, газовой или водопроводной сети, лабораторной посуды, приборов и оборудования немедленно сообщите об этом лаборанту или преподавателю.
12. Бережно обращайтесь с посудой и оборудованием.
13. По окончании работы уберите рабочее место и сдайте его лаборанту.
14. Лица, нарушающие правила техники безопасности при проведении работ лабораторного практикума, отстраняются от занятий и вновь допускаются только после повторного инструктажа.
Лабораторная работа № 1
Определение электродных потенциалов и концентрации ионов в растворе методом измерения электродвижущих сил
Краткий конспект:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: овладение навыками работы на ионометре при измерении электродвижущей силы гальванических цепей с помощью электродов первого и второго рода. Расчет электродных потенциалов и концентрации ионов в растворах.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Потенциометр «Ионометр универсальный ЭВ -74»;
2. Набор электродов первого рода, электрода сравнения, окислительно-восстановительного электрода;
3. Подставка для электродов с измерительным стаканчиком;
4. Растворы электролитов: 1М соли CuSO4 , ZnSO4 , 0,01 М CuSO4, КС1 (насыщенный раствор), 0,1 М растворы К3[Fe(CN)6] и К4[Fe(CN)6], почва №1 и №2.
Задание 1. Измерение ЭДС медно-цинкового гальванического элемента (элемента Даниеля – Якоби).
Схематическая запись элемента:
Сu|CuSO4| KCl | ZnSO4|Zn
E = eCu - eZn
Задание 2. Измерение электродвижущей силы хлорсеребряно-цинкового гальванического элемента и вычисление потенциала цинкового электрода.
Схематическая запись элемента:
Ag|AgCl, KCl| KCl | ZnSO4 (1 M)|Zn
Вычисляют потенциал цинкового электрода, используя уравнение:
Еоп = eхс - eZn, откуда eZn = eхс - Еоп
Задание 3. Измерение ЭДС медно-хлорсеребряного гальванического элемента и вычисление потенциала медного электрода.
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | KCl, AgCl|Ag
Затем вычисляют потенциал медного электрода, используя уравнение
Еоп = eCu - eхс, откуда eCu = Еоп + eхс.
Задание 4. Измерение ЭДС медного концентрационного гальванического элемента
Схематическая запись элемента:
Cu|CuSO4 (1 M)| KCl | CuSO4 (0,01 M)|Cu
Задания 5 и 6. Измерение ЭДС окислительно-восстановительной цепи и вычисление окислительно-восстановительного потенциала.
Контрольные растворы для выполнения заданий 5 и 6 получают у преподавателя.
Задание 5.
Схематическая запись элемента:
Pt| 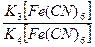 | |KCl, AgCl|Ag
| |KCl, AgCl|Ag
Еоп = eов - eхс, откуда eов = Еоп + eхс.
Задание 6.
Схематическая запись элемента:
Pt| почва| | KCl, AgCl|Ag
Таблица 1
Результаты определения ЭДС гальванических элементов и
Дата: 2019-03-05, просмотров: 333.