КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: овладение навыками измерения рН на ионометре “ЭКОТЕСТ – 2000” с использованием стеклянно-хлорсеребряной гальванической цепи различных водных растворов, суспензий и буферных систем. Составление ацетатной и фосфатной буферных систем и измерение их буферной ёмкости. Определение концентрации ионов водородов в природных жидкостях по известным значениям рН.
РЕАКТИВЫ И ОБОРУДОВАНИЕ:
1. Ионометр “ЭКОТЕСТ-2000”.
2. Стеклянный и хлорсеребряный электроды.
3. Подставка для электродов с измерительными стаканчиками.
4. Измерительные пипетки, бюретки и цилиндры.
5. Конические колбы для приготовления буферных растворов и почвенных вытяжек.
6. 0,1 М растворы уксусной кислоты и уксуснокислого натрия.
7. 1/15 М растворы гидрофосфата натрия и дигидрофосфата калия.
8. 0,1 М растворы соляной кислоты и едкого натра.
9. Почвы № 1 и № 2.
Задание 1. Приготовление буферных растворов.
1. Ацетатный буферный раствор
Приготовить 50 мл буферного раствора сливанием из бюретки 0,1 М CH3COOH и 0,1 М CH3COONa при соотношении 1 : 1.
рН этого раствора равен 4,65.
2. Фосфатный буферный раствор
Приготовить 50 мл буферного раствора сливанием из бюретки 0,1 М Na2HPO4 и 0,1 М NaH2PO4 при соотношении 1 : 1.
рН этого раствора равен 6,86.
Задание 2. Приготовление водной почвенной вытяжки. Измерение её рН проводятся в конце работы (таблица 5)
Задание 3. Изучение буферности дистиллированной, водопроводной воды и буферных растворов (таблица 2)
Задание 4. Влияние разбавления на рН буферных растворов (таблица 3)
Задание 5. Определение буферной емкости буферного раствора по кислоте или щелочи. Контрольные растворы для выполнения задания получают у преподавателя, результаты записывают в таблицу 4.
Вычислить буферную емкость по формуле:
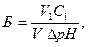
где Б – буферная емкость по кислоте или щелочи; С1 – концентрация кислоты или щёлочи; V1 – объём прибавленного раствора кислоты или щелочи, мл; V – объём буферного раствора, взятый для исследования, мл; DрН – разность значений рН до и после прибавления кислоты или щёлочи (берётся величина DрН наиболее близкая к 1.
Результаты определения буферной емкости записать в табл.4.
По найденным значениям рН вычислить активность ионов водорода в растворе.
Пример: рН = 2,34
- lg aH+ = 2,34 lg aH+ = -2,34
lg aH+ = `3,66 aH+ = 4,57×10-3 М.
Результаты записать в табл. 4.
Таблица 2
Результаты определения буферного действия растворов
| Исследуемый раствор | Объем раствора, мл | рН исследуемо-го раствора | Объем и концентрация прибавленного раствора | рН раствора после прибавления реактива | DрН |
| Н2О дистил. | 20 | 0,5 мл 0,1 М HCl | |||
| Н2О дистил. | 20 | 0,5 мл 0,1 М NaOH | |||
| Ацетатный буферный раствор | 20 | 0,5 мл 0,1 М HCl | |||
| Ацетатный буферный раствор | 20 | 0,5 мл 0,1 М NaOH | |||
| Н2О водопр. | 20 | 0,5 мл 0,1 М HCl | |||
| Н2О водопр. | 20 | 0,5 мл 0,1 М NaOH |
Таблица 3
Влияние разбавления на рН буферных растворов
| Исследуемый раствор | Объем раствора, мл | рН исследуемого раствора | Объем и концентрация прибавленного раствора | рН раствора после прибавления реактива | DрН |
| Фосфатный буферный раствор | 20 | 10 мл Н2О | |||
| Полученный раствор | 30 | 10 мл Н2О |
Таблица 4
Результаты определения буферной емкости номерного раствора
| Исследуемый раствор | Объем раствора, мл | рН исследуемого раствора | Объем прибавленного раствора кислоты или щелочи | рН раствора после прибавления реактива | DрН |
| 20 | 1 2 3 4... |
Б =
Таблица 5
Результаты измерения рН и вычисления СН+ растворов
| N п/п | Исследуемый раствор | рН | СН+, М |
| 1 | Дистиллированная вода | ||
| 2 | Почвенная вытяжка (водная) |
ВЫВОДЫ:
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Буферные растворы, их состав, свойства и механизм действия.
2. Основное уравнение буферных растворов.
3. Буферная емкость, её определение. Буферность почв и почвенного раствора.
4. Ионное произведение воды. Водородный показатель (рН).
5. Потенциометрический метод определения рН.
ЛАБОРАТОРНАЯ РАБОТА № 3
Дата: 2019-03-05, просмотров: 347.