КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: Изучение кислотно-щелочного потенциометрического титрования с использованием стеклянно-хлорсеребряной гальванической цепи. Определение концентрации кислоты. Определение силы и основности кислот. Расчет константы электролитической диссоциации для слабой кислоты. Использование потенциометрического метода для определения концентрации ионов в различных биологических жидкостях.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Ионометр “ЭКОТЕСТ – 2000” с измерительной ячейкой.
2. Стеклянно-хлорсеребряная гальваническая цепь.
3. Градуированные пипетки на 10 мл.
4. Два стеклянных измерительных стаканчика.
5. 0,1 М раствор едкого натра.
6. Исследуемые растворы кислот по заданию преподавателя.
Задание 1. Определение концентрации, основности и силы кислот титрованием NaOH
Предварительное титрование
Таблица 6
Предварительное титрование
| Прибавлено щелочи, мл | рН раствора | Ориентировочная точка эквивалентности |
| 0 1 2 3 4 ... |
Точное титрование
Таблица 7
Точное титрование
| Прибавлено щелочи, мл | рН | Объём щелочи в точке эквивалентности | Характеристика кислоты | |||
| молярность | сила | основность | Константа диссоциации К | |||
| 0 1 2 3 4 ... | ||||||
На основании полученных данных точного титрования строят график, где по оси абсцисс откладывают объем добавленной щелочи (мл), по оси ординат – значение рН.
Кривая потенциометрического титрования
На основе полученных данных (количество скачков титрования, величина скачка титрования, константа электролитической диссоциации) делают заключение о характере оттитрованной кислоты.
ВОПРОСЫ:
1. На чем основан метод потенциометрического титрования.
2. Что такое индикаторный электрод. Привести пример.
3. Какие реакции используются в методе потенциометрического титрования.
4. Каким способом определяется точка эквивалентности при использовании метода потенциометрического титрования.
5. Напишите гальванические цепи при определении ионов бария, хлора, серебра и серы методом потенциометрического титрования.
ЛАБОРАТОРНАЯ РАБОТА № 4
Электрическая проводимость и ее использование для анализа растворов электролитов
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: освоение навыков работы на кондуктометре типа «Маrk-II» или «HANNA», измерение удельной электрической проводимости в водных растворах сильных и слабых электролитов. Расчет молярной электрической проводимости, степени и константы электролитической диссоциации слабых электролитов, коэффициента активности для сильных электролитов.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Кондуктометр «Маrk-II»; «HANNA».
2. Измерительная ячейка для исследуемых растворов.
3. Измерительные цилиндры на 25 мл, градуированные пипетки на 10 мл, стеклянные стаканчики, емкость 100 мл.
4. 0,1 М раствор КС1, вода дистиллированная, водопроводная, исследуемые растворы слабых электролитов (по заданию преподавателя).
Задание 1. Измерение электрической проводимости растворов электролитов. Расчет степени и константы диссоциации слабого электролита и коэффициента активности сильного электролита
По заданию преподавателя получают исследуемый раствор кислоты, точно отмеряют 20 мл и приступают к измерениям.
Все результаты записывают в таблицу 8.
Таблица 8
Результаты измерения электрической проводимости растворов
Электролитов
| Раствор | С | c | lv | a | K | fэ |
| КCl | 0,1 М | - | - | |||
| Исследуемый раствор кислоты, Моль/л | C C/2 C/4 | - | ||||
| Вода водопровод- ная | - | - | - | - | - |
Задание 2. Определение солесодержания водопроводной воды по измеренному значению удельной электрической проводимости.
Для приблизительной оценки солесодержания следует воспользоваться таблицами перевода значений удельной электрической проводимости в величину эквивалентного содержания NaCl из приложения.
Содержание солей в воде составляет:
ВЫЧИСЛЕНИЯ:
Для каждого разбавления рассчитать:
1. Эквивалентную электропроводность
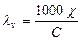
2. Степень электролитической диссоциации
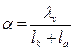
3. Константу электролитической диссоциации
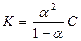
Сделать выводы об изменении степени электролитической диссоциации, c и lv растворов слабого электролита с изменением концентрации.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ:
1. Понятие электролита. Сильные и слабые электролиты. Понятие степени и константы электролитической диссоциации.
2. Удельная электрическая проводимость растворов и факторы, влияющие на её величину.
3. Основное уравнение электропроводности для сильных и слабых электролитов.
4. Молярная электрическая проводимость. График зависимости молярной электрической проводимости от разбавления для сильных и слабых электролитов.
5. Закон независимого перемещения ионов (закон Кольрауша). Закон разведения Оствальда.
ЛАБОРАТОРНАЯ РАБОТА № 5
КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
КРАТКИЙ КОНСПЕКТ:
ОБЩАЯ ПОСТАНОВКА ЗАДАЧИ: Определение концентрации ионов методом кондуктометрического титрования. Нахождение точки эквивалентности на графике кондуктометрического титрования сильной, слабой кислоты, смеси кислот методом кондуктометрического титрования. Использование кондуктометров различных типов при определении концентрации ионов методом кондуктометрии.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
1. Измерительный мостик Кольрауша.
2. Платиновый электрод.
3. Коническая колба на 250 мл, бюретка, градуированная пипетка.
4. 0,1 М раствор едкого натра.
5. Исследуемый раствор электролитов по заданию преподавателя.
Задание 1. Определение концентрации кислоты
По полученным данным кондуктометрического титрования строят соответствующий график, где по оси абсцисс откладывается объем добавленной щелочи в мл, по оси ординат – значение удельной электрической проводимости.
Таблица 9
Дата: 2019-03-05, просмотров: 330.