Углеводы
Общая постановка задачи: освоить методику качественного определения сахаров с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. 5%-ный водный раствор сульфата меди (II)
3. 10%-ный водный раствор щелочи (NaOH)
4. Аммиачный раствор оксида серебра
5. Реактив Селиванова
6. Раствор альдозы
7. Раствор кетозы
8. Водяная баня
9. Газовая горелка (или электрическая плитка)
Краткий конспект*:
Задание 1. Взаимодействие моносахаридов с гидроксидом меди (II).
Реакцию с солями меди (II) выполняют как для альдозы, так и для кетозы. После нагревания полученных растворов сравнивают результаты. Обратите внимание, что альдегидная группа более активна в реакциях окисления, чем кето-группа.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие кетозы с реактивом Селиванова.
Наблюдения записывают в виде уравнений реакций.
Задание 3. Реакция серебряного зеркала.
Обратите внимание, что для выполнения реакции серебряного зеркала необходима чистая пробирка, при добавлении аммиачного раствора оксида серебра в неё не должны попадать частицы осадка (в противном случае выпадение серебра будет происходить не на стенках пробирки, а в объеме раствора).
Наблюдения записывают в виде уравнений реакций.
Задание 4. Взаимодействие сахаров с медно-виннокислым комплексом (реактивом Фелинга).
Реактивы и материалы: 5%-ные растворы глюкозы, лактозы, сахарозы, реактив Фелинга А и Б.
Раствор А: сульфат меди в водном растворе (3,5 г на 50мл)
Раствор Б: тартрат калия, натрия в водно-щелочном растворе (17,3г сегнетовой соли и 6г гидроксида натрия в 50мл воды)
В пробирке смешивают по 5 капель реактива Фелинга А и Б и используют в дальнейшей работе.
В три пробирки наливают по 5 капель исследуемых сахаров: в первую - глюкозу, во вторую - лактозу, в третью – сахарозу, и в каждую добавляют по 1-2 капли реактива Фелинга. Смесь в пробирках нагревают в водяной бане. Наблюдают выпадение оксида меди (I) в пробирках с глюкозой и лактозой. В пробирке с сахарозой сохраняется синий цвет
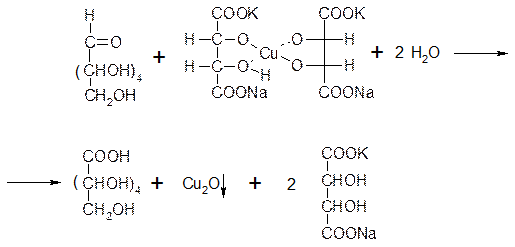
Восстанавливать соединения меди из реактива Фелинга при нагревании способны лишь те сахара, которые имеют в молекуле свободную альдегидную группу или глюкозидный гидроксил.

Сахароза не восстанавливает раствор Фелинга, что указывает на отсутствие в ее молекуле свободной альдегидной группы.
Задание 5. Образование озазона глюкозы.
Реактивы: 0,5%-ный раствор глюкозы, солянокислый фенилгидразин, ацетат натрия.
В пробирку вносят небольшое количество кристаллов солянокислого фенилгидразина и такое же количество ацетата натрия, добавляют 3 капли раствора глюкозы. Ставят пробирку в заранее нагретую до кипения водяную баню. Через 10-15 минут в пробирке образуется желтый кристаллический осадок озазона глюкозы. В растворе смеси солянокислого фенилгидразина и ацетата натрия в результате обменной реакции образуется уксуснокислый фенилгидразин, последний, как соль слабой кислоты и слабого основания, сильно гидролизован и в растворе находится в равновесии со свободным фенилгидразином, который реагирует с углеводом. Синтез озазона протекает через стадии образования фенилгидразона и кетофенилгидразона глюкозы (см. ниже).

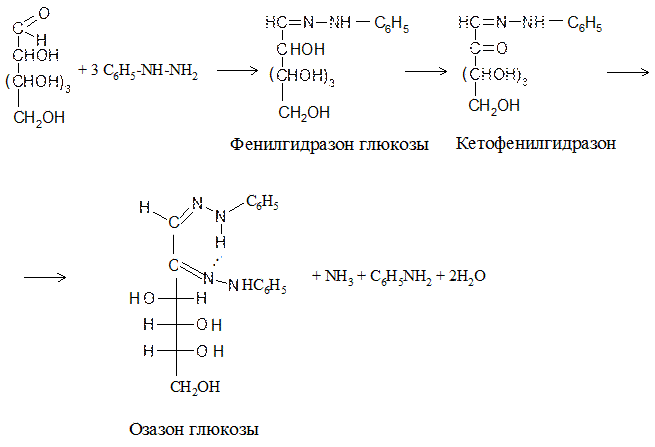
Озазоны - труднорастворимые вещества желтого цвета - служат для идентификации углеводов.
Задание 6. Гидролиз сахарозы.
Реактивы: 1%-ный раствор сахарозы, 2 н раствор серной кислоты, реактив Фелинга (А и Б).
Наливают в 2 пробирки по 5 капель раствора сахарозы, в одну из пробирок добавляют 2 капли разбавленной серной кислоты. Обе пробирки одновременно нагревают в кипящей водяной бане 10-15 минут, затем охлаждают и проводят с содержимым каждой из них реакции с реактивом Фелинга..
Отмечают различия в результатах реакции для раствора сахарозы, нагревавшихся с кислотой и без кислоты.
Сахароза не имеет в молекуле ни свободных гликозидных гидроксилов, ни карбонильных групп и поэтому существенно отличается по реакционной способности от моносахаридов и большинства дисахаридов.
При гидролизе сахароза расщепляется на α,D-глюкопиранозу и β,D- фруктофуранозу.

Реакция с реактивом Фелинга указывает, что в результате гидролиза в растворе появляются карбонильные группы, способные восстанавливать двухвалентную медь до оксида меди (I).
Задание 7. Гидролиз крахмала кислотами.
Реактивы: 2%-ный раствор крахмального клейстера, 2 н раствор серной кислоты, 0,1н раствор йода в KI, 2 н раствор гидроксида натрия, реактив Фелинга (А и Б).
В большую пробирку помещают 20 капель крахмального клейстера, 6 капель серной кислоты, пробирку встряхивают и ставят в кипящую водяную баню. Каждую минуту отбирают пипеткой по 1 капле гидролизата и переносят в пробирку с раствором йода. Для этого предварительно в 8 пробирок помещают по 1 капле раствора йода и по 5 капель воды.
Последовательные пробы обнаруживают постепенное изменение окраски при реакции с йодом (синюю, сине-фиолетовую, красно-фиолетовую, красновато-оранжевую, оранжевую и желтую).
Гидролиз крахмала заканчивают, когда гидролизат с йодом не будет давать цветной реакции. Раствор охлаждают, нейтрализуют раствором щелочи, добавляют 2 капли реактива Фелинга и нагревают. Выпадает осадок оксида меди (I), что указывает на присутствие мальтозы и глюкозы.
При нагревании с разбавленными минеральными кислотами крахмал подвергается гидролизу по следующей схеме:

крахмал декстрины мальтоза глюкоза
Крахмал с йодом дает синее окрашивание, декстрины, в зависимости от величины цепочки, окрашиваются йодом в фиолетовые, красные, оранжевые цвета. Мальтоза и глюкоза не изменяют окраски йода.
Выводы:
Вопросы для самоконтроля:
1. Будет ли рибоза давать реакцию серебряного зеркала? Ответ обоснуйте.
2. Напишите таутомерные формы для альдопентозы.
3. Приведите примеры восстанавливающих и невосстанавливающих дисахаридов. Покажите различия в их строении и химических свойствах.
ЛАБОРАТОРНАЯ РАБОТА №11
Дата: 2019-03-05, просмотров: 358.