Общая постановка задачи: освоить метод качественного определения азота, серы и галогенов в органических соединениях.
Оборудование и реактивы:
1. Фарфоровая чашка
2. Пробирки
3. Газовая горелка
4. Медная проволока
5. Органическое вещество, содержащее галоген (хлороформ или четыреххлористый углерод)
6. Коническая воронка
7. Бумажные фильтры
8. Рыбная мука (или тиосемикарбазид)
9. Натрий металлический
10. Хлорид железа (III)
11. Сульфат железа (II)
12. Соляная кислота
13. Ацетат свинца
Краткий конспект*:
Обратите внимание, что реакции необходимо проводить в вытяжном шкафу. Необходимо использовать чистые сухие пробирки, поскольку реакцию проводят с металлическим натрием.
Задание 1. Сплавление органического вещества, содержащего азот и серу, с металлическим натрием.
Задание 2. Качественное определение азота.
Задание 3. Качественное определение серы.
Наблюдения записывают в виде уравнений реакций.
Задание 4. Качественное определение галогена.
Наблюдения записывают в виде уравнений реакций.
Выводы:
Вопросы для самоконтроля:
1. Как количественно определяют содержание углерода и водорода в органических веществах?
2. В виде какого азотсодержащего соединения определяют азот в органических веществах по методу Дюма?
3. В виде какого азотсодержащего соединения определяют азот в органических веществах по методу Кьельдаля?
4. Напишите простейшую брутто-формулу вещества, если известно, что оно содержит 79,19 % углерода, 5,74 % водорода и 15,07 % кислорода.
5. Определите процентный состав углерода, водорода и азота в соединении состава С3Н9N.
ЛАБОРАТОРНАЯ РАБОТА №5
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Кратная связь
Общая постановка задачи: освоить методику качественного определения кратной С=С связи в органических соединениях с помощью химических реакций
Оборудование и реактивы:
1. Пробирки
2. 0,2%-ный водный раствор перманганата калия
3. 1% -ный раствор брома в воде или хлороформе
4. Раствор органического соединения, содержащего двойную С=С связь
Краткий конспект*:
Обратите внимание, что при выполнении данной работы удобнее сначала наливать в пробирку окрашенные растворы (растворы брома и перманганата калия), затем прибавлять испытуемый раствор.
Задание 1. Взаимодействие вещества с кратной связью с раствором перманганата калия.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие вещества с кратной связью с бромной водой.
Наблюдения записывают в виде уравнений реакций.
Выводы:
Вопросы для самоконтроля:
1. Напишите уравнения реакции, которая применяется для определения места положения двойной связи.
2. Предложите примеры уравнений реакций, протекающих по правилу Марковникова.
3. В каких случаях используют правило Зайцева? Приведите примеры.
4. Почему для алкенов более характерны реакции электрофильного присоединения?
ЛАБОРАТОРНАЯ РАБОТА №6
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Гидроксильная группа
Общая постановка задачи: освоить методику качественного определения гидроксильной группы в органических соединениях с помощью химических реакций
Оборудование и реактивы:
1. Пробирки
2. 1%-ный водный раствор хлорида железа (III)
3. 3%-ный водный раствор сульфата меди (II)
4. 5% -ный водный раствор щелочи (NaOH)
5. Раствор многоатомного спирта
6. Раствор фенола
7. Раствор «енола»
Краткий конспект*:
Задание 1. Взаимодействие фенола с хлоридом железа (III).
Наблюдения записывают в виде уравнений реакций:
Задание 2. Взаимодействие гликоля с гидроксидом меди (II)
Наблюдения записывают в виде уравнений реакций.
Задание 3. Взаимодействие «енола» с хлоридом железа (III)
Наблюдения записывают в виде уравнений реакций.
Задание 4. Цветные реакции фенолов и нафтолов с хлоридом железа.
Реактивы: хлорид железа (Fe3+), 1 н раствор фенола, 1 % - ные спиртовые растворы пирокатехина, резорцина, гидрохинона, пирогаллола и 1 – нафтола. Берут 6 пробирок. В первую пробирку вносят 3 капли 1 н раствора фенола, во вторую - 3 капли раствора пирокатехина, в третью - резорцина, в четвертую - гидрохинона, а пятую - пирогаллола и в шестую - нафтола.
В каждую пробирку добавляют по 1 капле хлорного железа. При этом в первой пробирке появляется фиолетовое окрашивание, во второй - зеленое, в третьей - фиолетовое, в четвертой - зеленое, затем переходящее в желтое, в пятой - красное и в шестой - фиолетовое.
Фенолы с хлоридом железа дают различного цвета комплексные соединения.
Задание 5. Образование этилата натрия и его гидролиз.
Реактивы: металлический натрий, этиловый спирт безводный, раствор фенолфталеина.
В пробирку помещают кусочек металлического натрия, добавляют 3 капли этилового спирта и закрывают отверстие пробирки пальцем. Наблюдается бурное выделение водорода. По окончании реакции подносят отверстие пробирки к пламени горелки. При открытии пробирки водород воспламеняется. На дне пробирки остается беловатый осадок этилата натрия. К нему прибавляют 2 - 3 капли воды (если весь натрий прореагировал). Затем добавляют 1 каплю раствора фенолфталеина. Появляется красное окрашивание, так как этилат натрия в присутствии воды разлагается, выделяя гидроксид натрия.
2C2H5OH + 2Na  C2H5ONa + H2
C2H5ONa + H2
C2H5ONa + HOH  C2H5OH + NaOH
C2H5OH + NaOH
Задание 6. Образование трибромфенола.
Реактивы: бромная вода, раствор фенола.
В пробирку помещают 3 капли бромной воды и добавляют 1 каплю прозрачного раствора фенола. Образуется осадок 2,4,6-трибромфенола.
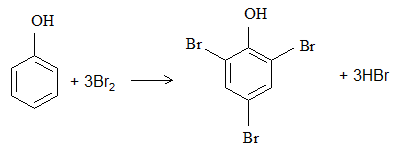
Данная реакция является реакцией электрофильного замещения в ароматическом ряду.
Выводы:
Вопросы для самоконтроля:
1. Напишите примеры реакций межмолекулярной и внутримолекулярной дегидратации.
2. Как вы думаете, почему нельзя разделить метанол и этанол с помощью простой перегонки?
3. Объясните, почему у этанола (С2Н6О) более высокая температура кипения, чем у диметилового эфира (С2Н6О).
4. Какое влияние на кислотность многоатомных спиртов оказывает внутримолекулярная водородная связь?
ЛАБОРАТОРНАЯ РАБОТА №7
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Амины
Общая постановка задачи: освоить методику качественного определения амино-группы в органических соединениях с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. Насыщенный бензольный раствор п-диэтиламинобензальдегида
3. Раствор первичного амина
4. Раствор анилина в диэтиловом эфире
5. Раствор алифатического амина
6. Универсальная индикаторная бумага
7. Фильтровальная бумага
Краткий конспект*:
Задание 1. Взаимодействие п-диэтиламинобензальдегида с первичным амином (реакция Эрлиха).
Обратите внимание, что при выполнении реакции на обнаружение первичных аминов с п-диметиламинобензальдегидом следует очень аккуратно наносить капли раствора амина и п-диметиламинобензальдегида, капли должны перекрываться, но не следует капать один раствор на другой.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Определение основности аминов с помощью универсальной индикаторной бумаги.
Наблюдения записывают в виде уравнений реакций и значений рН исследуемых аминов.
Выводы:
Вопросы для самоконтроля:
1. Объясните различие в оснόвных свойствах алифатических и ароматических аминов.
2. Будет ли влиять введение дополнительной нитрогруппы в п-нитроанилин на основность амино-группы?
3. Предложите способы, с помощью которых можно отличить следующие вещества друг от друга: анилин, метиламин, диметиламин и триметиламин.
ЛАБОРАТОРНАЯ РАБОТА №8
Дата: 2019-03-05, просмотров: 375.