Реактивы, материалы и приборы: ацетон, насыщенный раствор гидросульфита натрия, 2 Н раствор соляной кислоты, предметное стекло, запаянный капилляр, микроскоп.
На предметное стекло наносят 2 капли насыщенного раствора гидросульфита натрия, добавляют 1 каплю ацетона и размешивают концом запаянного капилляра. Вскоре начинают выпадать кристаллы гидросульфитного соединения ацетона. Предметное стекло переносят под микроскоп и рассматривают кристаллы. Кристаллы гидросульфитного соединения представляют собой четырехугольники неправильной формы.
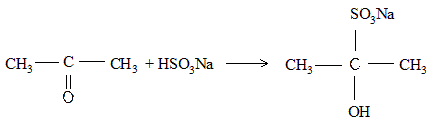
Альдегиды и алифатические метилкетоны реагируют с гидросульфитом натрия с образованием кристаллических гидросульфитных соединений, которые являются натриевыми солями оксисульфокислот.
К полученным кристаллам добавляют 1 каплю соляной кислоты - осадок растворяется и выделяются исходные карбонильные соединения.
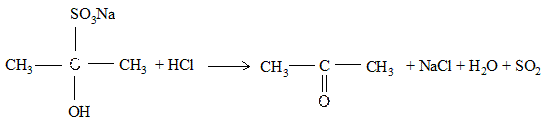
Выводы:
Вопросы для самоконтроля:
1. Напишите уравнение реакции пентандиона-2,4 с 1 и 2 молями фенилгидразина.
2. Объясните, почему самым активным в карбонильных соединениях является α-атом водорода. Напишите уравнение реакции пропаналя с бромом.
3. Предложите реакцию, которая легко позволяет отличить альдегид от кетона.
ЛАБОРАТОРНАЯ РАБОТА №9
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Карбоксильная группа
Общая постановка задачи: освоить методику определения карбоксильной группы в органических соединениях с помощью химических реакций.
Оборудование и реактивы:
1. Пробирки
2. Насыщенный водный раствор гидрокарбоната натрия
3. 5%-ный водный раствор щелочи (NaOH)
4. Концентрированные водные растворы нитрата свинца (II) или нитрата серебра
5. Растворы карбоновых кислот (муравьиной и уксусной) – 10%-ный и 50%-ный
6. Универсальная индикаторная бумага
Краткий конспект*:
Задание 1. Взаимодействие карбоновой кислоты с гидрокарбонатом натрия.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Определение кислотности карбоновых кислот.
Наблюдения записывают в виде уравнений реакций и значений рН испытуемых кислот:
Задание 3. Получение нерастворимых солей свинца или серебра.
Обратите внимание, что при выполнении реакции по получению нерастворимых солей карбоновых кислот не следует наливать слишком много щёлочи. Рекомендуется брать разбавленную щёлочь и добавлять её по каплям, поскольку щёлочь может образовывать нерастворимые осадки с нитратом свинца или серебра.
Наблюдения записывают в виде уравнений реакций:
Задание 4. Растворимость в воде различных кислот.
Реактивы: муравьиная, уксусная, масляная, щавелевая, стеариновая кислоты.
3 капли или несколько кристалликов каждой из кислот взбалтывают в пробирке с 5 каплями воды. Если кислота не растворяется, пробирку нагревают.
Горячие растворы охлаждают и отмечают выделение кристаллов некоторых плохо растворимых кислот.
Задание 5. Образование и гидролиз сложного эфира.
Реактивы, материалы и приборы: изоамиловый спирт, ледяная уксусная кислота, серная кислота (плотность 1,84), 2н раствор серной кислоты, насыщенный раствор хлорида натрия, концентрированный раствор гидроксида натрия, водяная баня, пипетка.
Смешивают в двух пробирках по 5 капель уксусной кислоты и изоамилового спирта. В одну пробирку осторожно приливают 1 каплю концентрированной серной кислоты. Встряхнув пробирки, помещают их на 10 минут в горячую (но не кипящую) водяную баню.
Затем охлаждают обе пробирки в холодной воде и добавляют в каждую по 5 капель воды. Отмечают запах образовавшегося сложного эфира. Затем добавляют в каждую по 5 капель насыщенного раствора хлорида натрия и наблюдают изменение объема эфирного слоя.
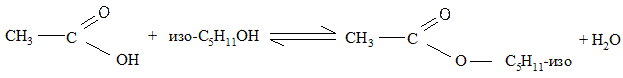
Пипеткой осторожно снимают слой образовавшегося эфира и сливают по 2 капли эфира в 3 чистые пробирки. В эти пробирки добавляют по 4-5 капель воды и приливают в одну - 2 капли 2н серной кислоты, во вторую - 2 капли концентрированного раствора гидроксида натрия. Пробирки нагревают на водяной бане и отмечают различие в скорости исчезновения капель эфира и его запаха.
Гидролиз эфира быстрее происходит в присутствии щелочи, которая связывает образующуюся при гидролизе кислоту:
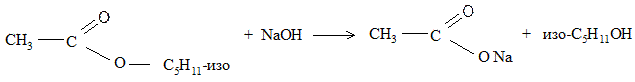
Задание 6. Растворимость и обменные реакции мыла.
Реактивы и материалы: мыло хозяйственное, 0,1 Н раствор хлорида кальция, 0,1 Н раствор ацетата свинца, 0,01 Н раствор сульфата меди.
В пробирку помещают около 10 мг твердого мыла, добавляют 10 капель воды и тщательно взбалтывают 1-2 минуты. Затем содержимое пробирки нагревают в пламени горелки. При нагревании мыло растворяется быстрее. Раствор мыла используют для обменных реакций. Для этого в 3 пробирки помещают по 3 капли раствора мыла и добавляют в одну пробирку 2 капли раствора хлорида кальция, в другую - 2 капли раствора ацетата свинца, в третью - 2 капли раствора сульфата меди.
Наблюдают выпадение осадков нерастворимых мыл.

Мыла - соли высших предельных и непредельных органических кислот.
Задание 7. Гидролиз мыла.
Реактивы и материалы: мыло, этиловый спирт, 1%-ный спиртовой раствор фенолфталеина.
В сухую пробирку помещают кусочек мыла, 4 капли спирта и энергично взбалтывают, затем добавляют 1 каплю фенолфталеина.
Окраска раствора не меняется. Затем к спиртовому раствору мыла добавляют по каплям воду. По мере прибавления воды появляется желтое окрашивание.
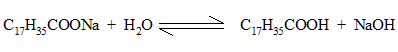
В результате гидролиза образуются малодиссоциированные карбоновые кислоты и едкий натр.
Выводы:
Вопросы для самоконтроля:
1. Объясните, почему при нанесении на индикаторную бумагу раствора бензойной кислоты окраска индикатора практически не меняется.
2. Объясните, чем отличается муравьиная кислота от остальных карбоновых кислот; подтвердите уравнениями реакций.
3. Объясните, как влияет длина углеродного скелета карбоновой кислоты на ее кислотные свойства.
4. Объясните, почему самым активным в карбоновых кислотах является α-атом водорода.
ЛАБОРАТОРНАЯ РАБОТА №10
Дата: 2019-03-05, просмотров: 897.