1.12.1 Адиабатный процесс – процесс, происходящий без теплообмена с окружающей средой, т.е. 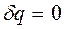 . Для осуществления такого процесса следует:
. Для осуществления такого процесса следует:
1) теплоизолировать газ, поместив его в адиабатную оболочку;
2) провести процесс так быстро, чтобы изменение температуры газа из-за теплообмена с окружающей средой было пренебрежимо мало по сравнению с изменением температуры, вызванным расширением или сжатием газа. Это возможно, т.к. теплообмен протекает значительно медленнее, чем сжатие или расширение газа.
Уравнение адиабаты идеального газа при постоянном отношении теплоёмкостей 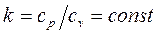 :
:
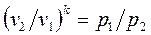 ;
; 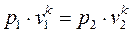 . (1.65)
. (1.65)
Величина
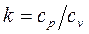 (1.66)
(1.66)
называется показателем адиабаты. Подставив уравнение Майера в выражение (1.66), получим 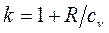 . Поскольку видно, что
. Поскольку видно, что 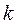 >1, то в координатах
>1, то в координатах 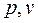 (рисунок 7) линия адиабаты идёт круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
(рисунок 7) линия адиабаты идёт круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа.
Уравнение адиабатного процесса в форме, выражающей зависимость температуры от объёма или давления:
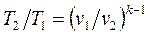 ;
; 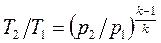 . (1.67)
. (1.67)
Работа расширения при адиабатном процессе согласно первому закону термодинамики совершается за счет уменьшения внутренней энергии и может быть вычислена по одной из формул:
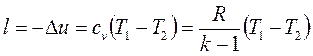 , (1.68)
, (1.68)
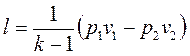 , (1.69)
, (1.69)
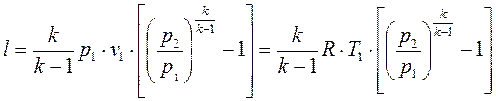 . (1.70)
. (1.70)
В данном процессе теплообмен газа с окружающей средой исключается, поэтому 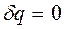 . Выражение
. Выражение 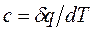 показывает, что теплоёмкость адиабатного процесса равна нулю.
показывает, что теплоёмкость адиабатного процесса равна нулю.
Т.к. при адиабатном процессе 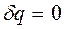 , энтропия рабочего тела не изменяется (
, энтропия рабочего тела не изменяется ( 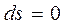 и
и 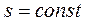 ). Следовательно, на
). Следовательно, на 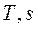 - диаграмме адиабатный процесс изображается вертикалью (рисунок 7).
- диаграмме адиабатный процесс изображается вертикалью (рисунок 7).
1.12.2 Политропный процесс – это процесс, удовлетворяющий уравнению
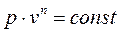 . (1.71)
. (1.71)
Подбирая соответствующее значение 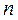 , можно описать этим уравнением любой произвольный процесс в координатах
, можно описать этим уравнением любой произвольный процесс в координатах 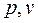 . Показатель политропы
. Показатель политропы 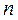 может принимать любое численное значение в пределах от -∞ до +∞, но для данного процесса он является величиной постоянной.
может принимать любое численное значение в пределах от -∞ до +∞, но для данного процесса он является величиной постоянной.
Аналогично адиабатному процессу существуют выражения, устанавливающие связь между 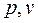 и
и 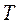 в любых двух точках на политропе:
в любых двух точках на политропе:
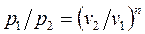 ;
; 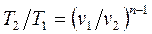 ;
; 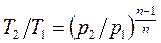 (1.72)
(1.72)
Работа расширения в политропном процессе:
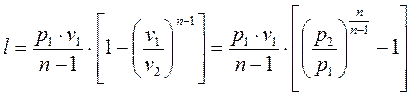 , (1.73)
, (1.73)
Уравнение (1.80) можно преобразовать к виду:
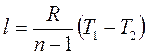 , (1.74)
, (1.74)
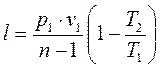 , (1.75)
, (1.75)
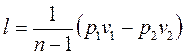 , (1.76)
, (1.76)
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики: 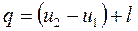 .
.
Так как 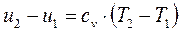 ;
; 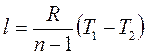 , то
, то
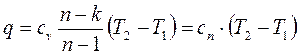 , (1.77)
, (1.77)
где
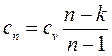 (1.78)
(1.78)
представляет собой теплоёмкость идеального газа в политропном процессе. При постоянных 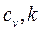 и
и 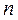 теплоёмкость
теплоёмкость 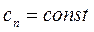 , поэтому политропный процесс иногда определяют как процесс с постоянной теплоёмкостью.
, поэтому политропный процесс иногда определяют как процесс с постоянной теплоёмкостью.
Изменение энтропии в политропном процессе выражается формулой
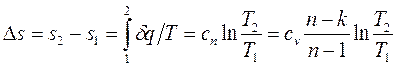 , (1.79)
, (1.79)
Политропный процесс имеет обобщающее значение, так как охватывает всю совокупность основных термодинамических процессов:
| Процесс | 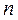
| 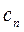
|
| Изохорный | +∞ | 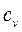
|
| Изобарный | 0 | 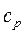
|
| Изотермический | 1 | ∞ |
| Адиабатный | 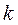
| 0 |
На рисунке 8 показано взаимное расположение на 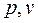 и
и 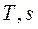 - диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
- диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
Изохора ( 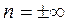 ) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, т.к. сопровождаются расширением рабочего тела; для процессов левее изохоры – работа отрицательна.
) делит поле диаграммы на две области: процессы, находящиеся правее изохоры, характеризуются положительной работой, т.к. сопровождаются расширением рабочего тела; для процессов левее изохоры – работа отрицательна.
Процессы, расположенные правее и выше адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее и ниже адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой ( 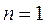 ), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
), характерно увеличение внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную теплоёмкость, так как 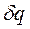 и
и 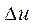 (а следовательно, и
(а следовательно, и 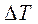 , имеют в этой области противоположные знаки. В таких процессах
, имеют в этой области противоположные знаки. В таких процессах 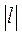 >
> 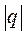 , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
1.13 Процесс парообразования. Основные понятия и определения
В качестве реального газа рассмотрим водяной пар – основное рабочее тело в теплоэнергетике. Изобразим процесс парообразования, т.е. превращения вещества из жидкого состояния в газообразное в 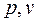 - диаграмме (рисунок 9).
- диаграмме (рисунок 9).
Начальное состояние воды с давлением 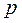 и температурой 0°С на диаграмме изобразится точкой
и температурой 0°С на диаграмме изобразится точкой 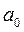 . При подводе теплоты к воде при постоянном давлении её температура постепенно повышается до температуры кипения
. При подводе теплоты к воде при постоянном давлении её температура постепенно повышается до температуры кипения 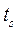 , соответствующей данному давлению. Состояние жидкости, доведённой до температуры кипения, изображается на диаграмме точкой
, соответствующей данному давлению. Состояние жидкости, доведённой до температуры кипения, изображается на диаграмме точкой 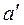 . При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объёма. В этом случае вода – смесь жидкости и пара, которая называется влажным насыщенным паром (это двухфазная смесь, состоящая из пара со взвешенными в нём капельками жидкости). По мере подвода теплоты количество жидкой фазы уменьшается, а паровой – растёт. Температура смеси при этом остается неизменной и равной
. При дальнейшем подводе теплоты начинается кипение воды с сильным увеличением объёма. В этом случае вода – смесь жидкости и пара, которая называется влажным насыщенным паром (это двухфазная смесь, состоящая из пара со взвешенными в нём капельками жидкости). По мере подвода теплоты количество жидкой фазы уменьшается, а паровой – растёт. Температура смеси при этом остается неизменной и равной 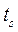 , так как вся теплота расходуется на испарение жидкости. Когда последняя капля жидкости превращается в пар, то пар становится сухим насыщенным. Его состояние изображается точкой
, так как вся теплота расходуется на испарение жидкости. Когда последняя капля жидкости превращается в пар, то пар становится сухим насыщенным. Его состояние изображается точкой 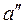 .
.
Насыщенным называется пар, находящийся в термическом и динамическом равновесии с жидкостью, из которой он образуется.
Сухой насыщенный пар – это насыщенный пар, в котором отсутствуют частицы жидкой фазы. Его удельный объём и температура являются функциями давления, поэтому состояние сухого пара можно задать любым из параметров – давлением, удельным объёмом или температурой.
Степень сухости – массовая доля сухого насыщенного пара во влажном, обозначается 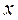 .
.
Степень влажности – массовая доля кипящей воды во влажном паре, обозначается 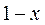 . Для кипящей жидкости
. Для кипящей жидкости 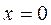 , а для сухого насыщенного пара
, а для сухого насыщенного пара 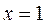 .
.
Состояние влажного пара характеризуется двумя параметрами: давлением (или температурой насыщения 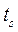 , определяющей это давление) и степенью сухости пара.
, определяющей это давление) и степенью сухости пара.
При сообщении сухому пару теплоты при том же давлении его температура будет увеличиваться, пар будет перегреваться. Точка 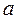 изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки
изображает состояние перегретого пара и в зависимости от температуры пара может лежать на разных расстояниях от точки 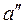 .
.
Перегретым называется пар, температура которого превышает температуру насыщенного пара того же давления. Состояние перегретого пара определяется двумя любыми независимыми параметрами.
Если парообразование производить при более высоком давлении, то:
1) точка 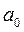 остается на той же вертикали, т.к. вода практически несжимаема;
остается на той же вертикали, т.к. вода практически несжимаема;
2) точка 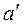 смещается вправо из-за расширения жидкости с увеличением температуры кипения из-за роста давления;
смещается вправо из-за расширения жидкости с увеличением температуры кипения из-за роста давления;
3) точка 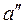 смещается влево из-за падения удельного объёма под влиянием растущего давления.
смещается влево из-за падения удельного объёма под влиянием растущего давления.
Критическая точка 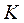 – это точка, в которой удельные объёмы жидкости и пара сравниваются, а различия между жидкостью и паром исчезают. Для воды параметры критической точки составляют
– это точка, в которой удельные объёмы жидкости и пара сравниваются, а различия между жидкостью и паром исчезают. Для воды параметры критической точки составляют 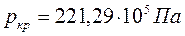 ;
; 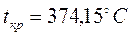 ;
; 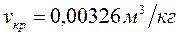 .
.
Критическая температура – это максимально возможная температура сосуществования двух фаз; при больших температурах возможна только одна фаза.
Тройная точка 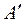 - единственное состояние, в котором одновременно находятся в равновесии пар, вода и лёд. Параметры тройной точки для воды:
- единственное состояние, в котором одновременно находятся в равновесии пар, вода и лёд. Параметры тройной точки для воды: 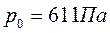 ;
; 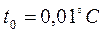 ;
; 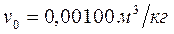 . Изобара
. Изобара 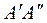 при абсолютном давлении
при абсолютном давлении 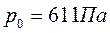 - самая низкая для парообразования из воды. При более низких давлениях пар существует в равновесии только со льдом.
- самая низкая для парообразования из воды. При более низких давлениях пар существует в равновесии только со льдом.
Сублимация – процесс образования пара непосредственно изо льда.
Линия 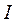 - нулевая изотерма, каждая точка которой соответствует состоянию 1 кг воды при 0°С и давлении
- нулевая изотерма, каждая точка которой соответствует состоянию 1 кг воды при 0°С и давлении 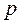 .
.
Линия 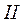 - нижняя пограничная кривая, представляющая зависимость удельного объёма жидкости от давления при температуре кипения (состояние кипящей воды).
- нижняя пограничная кривая, представляющая зависимость удельного объёма жидкости от давления при температуре кипения (состояние кипящей воды).
Линия 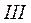 - верхняя пограничная кривая, представляющая зависимость удельного объёма сухого насыщенного пара от давления (состояние сухого насыщенного пара).
- верхняя пограничная кривая, представляющая зависимость удельного объёма сухого насыщенного пара от давления (состояние сухого насыщенного пара).
Влево от линии 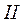 до нулевой изотермы – область некипящей однофазной жидкости, вправо от кривой
до нулевой изотермы – область некипящей однофазной жидкости, вправо от кривой 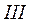 - область перегретого пара. таким образом, кривые
- область перегретого пара. таким образом, кривые 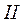 и
и 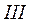 ограничивают область насыщенного пара, отделяя её от области воды и перегретого пара (поэтому пограничные).
ограничивают область насыщенного пара, отделяя её от области воды и перегретого пара (поэтому пограничные).
1.14 Параметры воды и пара. Теплота парообразования. Влажный пар
Термодинамические параметры кипящей воды и сухого насыщенного пара размещены в таблицах теплофизических свойств воды и водяного пара. В них термодинамические величины со штрихом относятся к воде, нагретой до температуры кипения, а величины с двумя штрихами – к сухому насыщенному пару.
Теплота парообразования 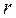 – количество теплоты, необходимое для превращения одного килограмма воды в сухой насыщенный пар той же температуры. Из рисунка 9 находим
– количество теплоты, необходимое для превращения одного килограмма воды в сухой насыщенный пар той же температуры. Из рисунка 9 находим 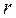 :
:
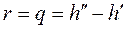 . (1.87)
. (1.87)
Приращение энтропии в процессе парообразования:
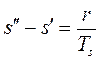 . (1.88)
. (1.88)
Так как состояние кипящей воды и сухого насыщенного пара определяется только одним параметром, то по известному давлению или температуре из таблиц воды и водяного пара берутся значения 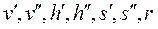 .
.
Удельный объём 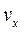 , энтропия
, энтропия 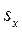 и энтальпия
и энтальпия 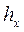 влажного насыщенного пара определяются по правилу аддитивности. Так как в 1 кг влажного пара содержится
влажного насыщенного пара определяются по правилу аддитивности. Так как в 1 кг влажного пара содержится 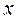 кг сухого и
кг сухого и 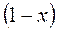 кг кипящей воды, то
кг кипящей воды, то
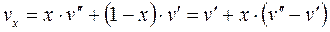 ; (1.89)
; (1.89)
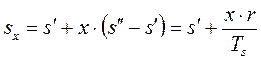 ; (1.90)
; (1.90)
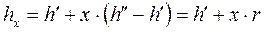 . (1.91)
. (1.91)
Непосредственно из таблиц параметры влажного пара взять нельзя. Их определяют по формулам (1.89) – (1.91) по заданному давлению (или температуре) и степени сухости.
По заданным давлению и температуре из таблиц находят требуемые параметры для воды и перегретого пара.
1.15 Вода и водяной пар.  - и
- и 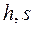 - диаграммы. Основные термодинамические процессы
- диаграммы. Основные термодинамические процессы
Для исследования различных процессов с водяным паром кроме таблиц используется 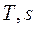 - диаграмма. Она строится путем переноса числовых данных таблиц водяного пара в
- диаграмма. Она строится путем переноса числовых данных таблиц водяного пара в 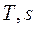 - координаты (рисунок 10).
- координаты (рисунок 10).
Состояние воды в тройной точке 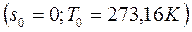 изображается в диаграмме точкой
изображается в диаграмме точкой 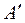 . Откладывая для различных температур значения
. Откладывая для различных температур значения 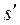 и
и 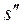 , получим нижнюю и верхнюю пограничные кривые. Влево от нижней пограничной кривой располагается область жидкости, между пограничными кривыми – двухфазная область влажного насыщенного пара, вправо и вверх от верхней пограничной кривой – область перегретого пара.
, получим нижнюю и верхнюю пограничные кривые. Влево от нижней пограничной кривой располагается область жидкости, между пограничными кривыми – двухфазная область влажного насыщенного пара, вправо и вверх от верхней пограничной кривой – область перегретого пара.
На диаграмму наносят изобары, изохоры и линии постоянной степени сухости, для чего каждую изобару 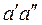 делят на одинаковое число частей и соединяют соответствующие точки линиями
делят на одинаковое число частей и соединяют соответствующие точки линиями 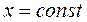 . Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси пар + лёд.
. Область диаграммы, лежащая ниже нулевой изотермы, отвечает различным состояниям смеси пар + лёд.
На рисунке 11 показана 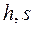 - диаграмма для водяного пара, которая строится путём переноса числовых данных таблиц водяного пара в
- диаграмма для водяного пара, которая строится путём переноса числовых данных таблиц водяного пара в 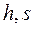 - координаты. Построение аналогично
- координаты. Построение аналогично 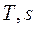 - диаграмме.
- диаграмме.
Особенности 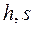 - диаграммы:
- диаграммы:
1) изобары в двухфазной области влажного пара – это пучок расходящихся прямых;
2) в области насыщения изобара совпадает с изотермой;
3) чем больше давление, тем выше лежит изобара;
4) критическая точка 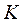 лежит не на вершине, как в других диаграммах, а на левом склоне пограничной кривой;
лежит не на вершине, как в других диаграммах, а на левом склоне пограничной кривой;
5) в области перегрева изобары и изотермы расходятся: температура пара растёт по логарифмической кривой, а крутизна изобары увеличивается;
6) в области воды изобары имеют тот же характер, но проходят очень близко от пограничной кривой, практически сливаясь с ней;
7) при низких давлениях и высоких температурах пар по свойствам близок к идеальному газу, для которого при изотермическом процессе энтальпия постоянна, поэтому в диаграмме изотерма горизонтальна;
8) линии изохор идут круче изобар.
9) количество теплоты в изобарном процессе равно разности ординат конечной и начальной точек процесса и изображаются отрезком вертикальной прямой, а не площадью как в 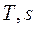 - диаграмме.
- диаграмме.
Всю диаграмму не выполняют, а строят только её верхнюю часть, наиболее употребляемую для расчетов.
Общий метод расчета по 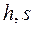 - диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса, и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
- диаграмме состоит в следующем. По известным параметрам наносится начальное состояние рабочего тела, затем проводится линия процесса, и определяются его параметры в конечном состоянии. Далее вычисляется изменение внутренней энергии, определяются количества теплоты и работы в заданном процессе.
Изохорный процесс (рисунок 12):
1) изменение внутренней энергии
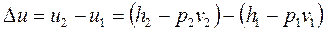 . (1.92)
. (1.92)
Данная формула справедлива для всех остальных термодинамических процесса.
2) работа 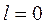 ;
;
3) теплота (из первого закона термодинамики) расходуется на увеличение внутренней энергии
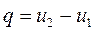 . (1.93)
. (1.93)
Изобарный процесс (рисунок 13):
1) изменение внутренней энергии – по уравнению (1.92);
2) теплота, полученная в процессе, равна разности энтальпий
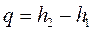 . (1.94)
. (1.94)
3) работа процесса
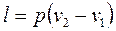 . (1.95)
. (1.95)
Изотермический процесс (рисунок 14):
1) внутренняя энергия водяного пара не остаётся постоянной (как у идеального газа), так как изменяется её потенциальная составляющая. Величина 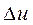 находится по формуле (1.92);
находится по формуле (1.92);
2) количество полученной теплоты
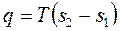 . (1.96)
. (1.96)
3) работа расширения определяется из первого закона термодинамики
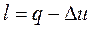 . (1.97)
. (1.97)
Адиабатный процесс (рисунок 15):
1) изменение внутренней энергии – по уравнению (1.92);
2) теплота не подводится;
3) работа адиабатного процесса
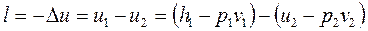 . (1.98)
. (1.98)
Дата: 2019-02-19, просмотров: 445.