Действительно существующие газы можно считать идеальными при высоких температурах и малых давлениях.
В газах, находящихся в состояниях, близких к сжижению, нельзя пренебречь объёмом молекул и силами притяжения между ними. Такие газы к идеальным не относятся, и их называют реальными газами.
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния:
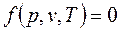 .
.
Уравнение состояния можно представить в виде
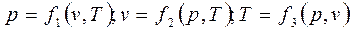 .
.
Эти уравнения показывают, что из трёх основных параметров, определяющих состояние системы, независимыми являются два любых.
Выведем уравнение состояния идеального газа.
Из уравнений (1.1) и (1.4) следует, что
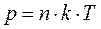 .
.
Рассмотрим 1 кг газа. Учитывая, что в нем содержится 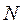 молекул, и, следовательно,
молекул, и, следовательно, 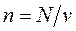 , получим:
, получим:
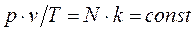
Постоянную величину 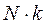 , отнесенную к 1 кг газа, обозначают буквой
, отнесенную к 1 кг газа, обозначают буквой 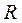 и называют характеристической газовой постоянной. Поэтому
и называют характеристической газовой постоянной. Поэтому
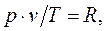 или
или 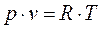 , (1.5)
, (1.5)
Соотношение (1.5) - уравнение Клапейрона.
Умножив (1.5) на 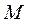 , получим уравнение состояния для произвольной массы газа
, получим уравнение состояния для произвольной массы газа 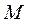 кг:
кг:
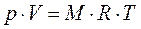 . (1.6)
. (1.6)
Уравнение Клапейрона можно перевести в универсальную форму, если отнести газовую постоянную к одному киломолю газа, т.е. к количеству газа, масса которого в килограммах численно равна молекулярной массе 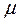 . Примем в уравнении (1.6)
. Примем в уравнении (1.6) 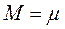 и
и 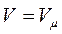 , тогда получим для одного моля:
, тогда получим для одного моля:
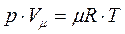 . (1.7)
. (1.7)
Здесь 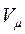 - объём одного киломоля газа, а
- объём одного киломоля газа, а 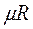 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Уравнение (1.7) - уравнение Менделеева-Клапейрона.
По закону Авогадро объём одного моля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4 м3/кмоль, поэтому
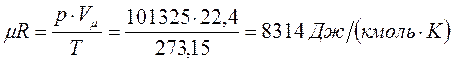 .
.
Газовая постоянная одного килограмма газа
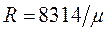 . (1.8)
. (1.8)
В реальных газах в отличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Свободный для движения молекул объём будет равен 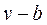 , где
, где 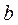 - тот наименьший объём, до которого можно сжать газ.
- тот наименьший объём, до которого можно сжать газ.
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления 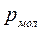 . Сила молекулярного притяжения пропорциональна квадрату плотности газа, поэтому молекулярное давление обратно пропорционально квадрату удельного объёма:
. Сила молекулярного притяжения пропорциональна квадрату плотности газа, поэтому молекулярное давление обратно пропорционально квадрату удельного объёма:
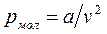 ,
,
где 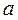 - коэффициент пропорциональности, зависящий от природы газа.
- коэффициент пропорциональности, зависящий от природы газа.
Уравнение Ван-дер-Ваальса – одно из уравнений состояния реального газа:
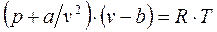 . (1.9)
. (1.9)
При больших удельных объёмах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса переходит в уравнение Клапейрона для идеального газа, т.к. величины 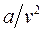 (по сравнению с
(по сравнению с 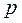 ) и
) и 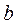 (по сравнению с
(по сравнению с 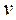 ) становятся пренебрежимо малыми.
) становятся пренебрежимо малыми.
Дата: 2019-02-19, просмотров: 553.