1.9.1 Энтропия – функция состояния системы, для которой выражение 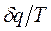 при равновесном изменении состояния газа есть полный дифференциал, обозначается для 1 кг газа через
при равновесном изменении состояния газа есть полный дифференциал, обозначается для 1 кг газа через 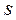 и измеряется в
и измеряется в 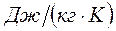 . Для произвольного количества газа энтропия, обозначаемая через
. Для произвольного количества газа энтропия, обозначаемая через 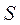 , равна
, равна 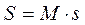 и измеряется в Дж/К.
и измеряется в Дж/К.
Аналитически энтропия определяется:
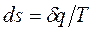 . (1.37)
. (1.37)
Формула (1.37) справедлива для идеальных и реальных газов.
Подобно другим функциям состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
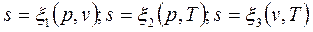 .
.
Значение энтропии для заданного состояния определяется интегрированием уравнения (1.37):
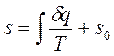 ,
,
где 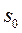 - константа интегрирования.
- константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. Нернст В. и Планк М. вывели следующий принцип: при температуре, стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т.е. 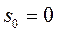 при
при 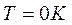 Это – третий закон термодинамики или тепловая теорема Нернста. Этот закон позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Это – третий закон термодинамики или тепловая теорема Нернста. Этот закон позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
В технической термодинамике обычно используют не абсолютное значение энтропии, а её изменение в каком-либо процессе, поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
Изменение энтропии идеального газа можно вычислить по формулам:
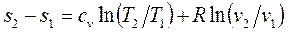 , (1.38)
, (1.38)
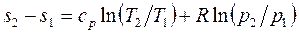 , (1.39)
, (1.39)
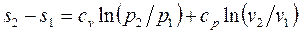 , (1.40)
, (1.40)
Так как энтропия есть функция состояния рабочего тела, уравнениями (1.38) – (1.40) можно пользоваться независимо от пути перехода рабочего тела из начального в конечное состояние, а также от того, равновесный этот переход или нет.
1.9.2 Понятие энтропии позволяет ввести очень удобную для термодинамических расчетов  - диаграмму, на которой (как и на
- диаграмму, на которой (как и на  - диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией.
- диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией.
Преобразовав выражение (1.37), получим
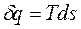 ; (1.41)
; (1.41)
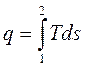 . (1.42)
. (1.42)
В 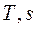 - диаграмме (рисунок 3) элементарная теплота процесса
- диаграмме (рисунок 3) элементарная теплота процесса 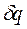 изображается элементарной площадкой с высотой
изображается элементарной площадкой с высотой 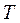 и основанием
и основанием 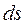 , а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула (1.41) показывает, что 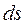 и
и 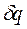 имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен: а) при нагревании тела (
имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен: а) при нагревании тела ( 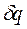 >0) его энтропия возрастает (
>0) его энтропия возрастает ( 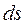 >0); б) при охлаждении тела (
>0); б) при охлаждении тела ( 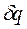 <0) его энтропия убывает (
<0) его энтропия убывает ( 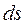 <0).
<0).
1.9.3 Одним из важнейших понятий термодинамики является понятие об обратимых и необратимых процессах.
Термодинамический процесс представляет собой совокупность непрерывно изменяющихся состояний термодинамической системы. Между двумя состояниями 1и 2 системы можно представить себе два процесса, проходящих по одному и тому же пути: от состояния 1 к состоянию 2 и, наоборот, от состояния 2 к состоянию 1, так называемые прямой и обратный процессы.
Обратимыми называют процессы, в результате которых в прямом и обратном направлениях термодинамическая система возвращается в исходной состояние; таким образом совокупность прямого и обратного процессов не вызывает в окружающей среде никаких изменений.
Необратимыми называют процессы, при проведении которых в прямом и затем в обратном направлении система не возвращается в исходное состояние. В ходе процесса в системе происходят изменения, которые отличают её состояние после проведения обратного процесса от состояния, в котором она находилась до проведения прямого процесса.
Для обратимых процессов справедливо соотношение 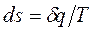 . В необратимых процессах
. В необратимых процессах 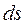 >
> 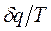 , если под
, если под 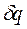 понимать количество подведенной к системе или отведённой от неё теплоты.
понимать количество подведенной к системе или отведённой от неё теплоты.
Аналитические формулировки второго закона термодинамики:
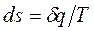 - в обратимых процессах
- в обратимых процессах
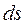 >
> 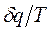 - в необратимых процессах.
- в необратимых процессах.
Для теплоизолированных систем, которые не обмениваются теплотой с окружающей средой 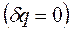 , эти выражения приобретают вид:
, эти выражения приобретают вид:
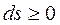 . (1.43)
. (1.43)
Дата: 2019-02-19, просмотров: 445.