В азотной кислоте сильным окислителем является нитрат- ион NO 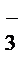 , поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO
, поэтому при её взаимодействии с металлами водород Н2 не выделяется, а протекает восстановление NO 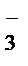 .Какойпродукт восстановления будет– зависит от концентрации кислоты и активности металла.
.Какойпродукт восстановления будет– зависит от концентрации кислоты и активности металла.
Чем активнее металл и чем меньше концентрация кислоты, тем в большей степени восстанавливается азот (+5) (понижается его степень окисления). Азотная кислота как сильный окислитель окисляет металлы до высоких степеней окисления, взаимодействует со всеми металлами, стоящими в «Ряду напряжений», по серебро включительно.
В зависимости от концентрации кислоты и активности металла получаются следующие продукты:
-3
HNO3 + Me(акт) = NH4NO3 + Me(NO3)n + H2O
Очень разб.
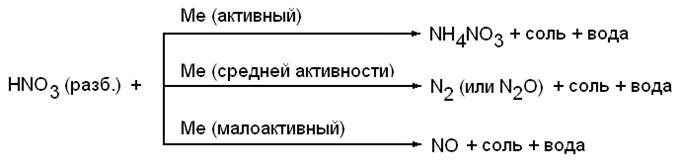
Активный+2
NO
Средней +4
HNO3 + Me  активности NO2+ Me(NO3)n + H2O
активности NO2+ Me(NO3)n + H2O
конц. +4
Малоактивный NO2
Примеры:
1. Ba + HNO3®NH4NO3 + Ba(NO3)2 + H2O
Очень разб.
1 NO 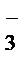 + 10H+ + 8
+ 10H+ + 8 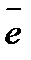 ® NH4+ + 3H2O
® NH4+ + 3H2O
4 Ba – 2 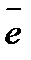 ® Ba2+
® Ba2+
NO 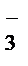 + 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
+ 10H+ + 4Ba = NH4+ + 3H2O + 4Ba2+
4Ba + 10HNO3 = NH4NO3 + 4Ba(NO3)2+ 3H2O
2. Zn + HNO3® Zn(NO3)2 + N2O + H2O
разб.
4 Zn – 2 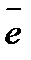 ® Zn2+
® Zn2+
1 2NO 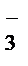 + 10H+ + 8
+ 10H+ + 8 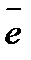 ® N2O + 5H2O
® N2O + 5H2O
4Zn + 2NO3- + 10H+ = 4Zn2+ + N2O + 5H2O
4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O
Особенности взаимодействия металлов с концентрированной серной кислотой
Концентрированная серная кислота реагирует со всеми металлами, кроме Ag, Au, Pt. В концентрированной серной кислоте более сильным окислителем, чем катионы водорода, являются сульфат-ионы SO 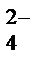 , поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO
, поэтому при её взаимодействии с металлами Н2 не выделяется, а идёт восстановление серы S+6 в анионе SO 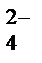 , при этом продукт восстановления зависит от активности металла:
, при этом продукт восстановления зависит от активности металла:
| Активный ® | H2S | ||
| H2SO4(конц.)+ Ме | Ср. активности ® | S¯ | + Ме2(SO4)n + Н2О |
| Малоактивный ® | SO2 |
Пример:
Zn + H2SO4® S + ZnSO4 + H2O
конц.
3 Zn – 2 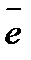 ® Zn2+
® Zn2+
1 SO 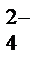 + 8H+ + 6
+ 8H+ + 6 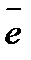 ® S + 4H2O
® S + 4H2O
3Zn + SO42- + 8H+ = 3Zn2+ + S + 4H2O
3Zn + 4H2SO4 = S + 3ZnSO4 + 4H2O
Примечание: в концентрированных растворах кислот Н NO 3 , Н2 SO 4 такие металлы как Fe , Al , Cr пассивируются образующимися оксидами (Э2О3).
Например:
Fe + HNO3® Fe2O3 + NO2 + H2O
конц.
Восстановительные свойства металлов по отношению к катионам металлов
В общем ионно-молекулярном виде такой тип взаимодействия можно представить следующим образом:
Ме1 + Ме2n+® Ме1m+ + Ме2
в-ль ок-ль пр. ок-ия пр. в-ния
Ме1– m 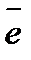 ® Ме1m+
® Ме1m+
Ме2n+ + n 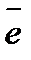 ® Ме2
® Ме2
Е0 = 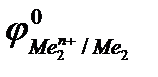 –
– 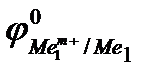
Так как самопроизвольному процессу отвечает Е0> 0, то 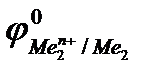 >
> 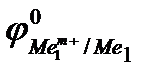 . Это означает,что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
. Это означает,что более активный металл (с меньшим электродным потенциалом, Ме1) вытесняет менее активный металл (с большим электродным потенциалом, Ме2) из раствора его соли.
Например, реакция омеднения цинка в растворе сульфата меди (II) возможна, т.к. 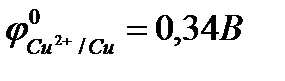 >
> 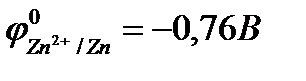 :
:
Zn + CuSO4 = ZnSO4 + Cu.
ЛИТЕРАТУРА
1. Ахметов Н.С. Общая и неорганическая химия. 4-е изд., испр – М.: Высшая школа, 2006. – 743 с.
2. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2009. – 727 с.
3. Коровин Н.В. Общая химия.. – М.: Высшая школа, 2007. – 556 с.
4. Лидин Р.А. Общая и неорганическая химия в вопросах Учебное пособие для ВУЗов. – М.: Изд-во Дрофа, 2005. – 230 с.
5. Лидин Р.А. Аликберова Л.Ю. Логинова Г.П. Общая и неорганическая химия в вопросах: Учеб пособие для вузов - 2-е изд. перераб и доп. – М.: Изд-во Дрофа, 2004. – 216 с.
6. Хомченко И.Г. Общая химия. – М.: Новая волна, 2004. – 464 с.
7. Севастьянова Г.К., Т. М. Карнаухова Общая химия. Курс лекций: учебное пособие. – 2-е изд. перераб и доп. –Тюмень: ТюмГНГУ, 2014. –210 с.
Приложение 1
Дата: 2019-02-19, просмотров: 420.