Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону E. Сродство к электрону выражается в кДж/моль или эВ/атом.
Сродство к электрону характеризует окислительные или неметаллические свойства атома элемента. Принимая электроны, атом превращается в отрицательно заряженный ион по схеме:
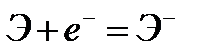 .
.
Надежные значения сродства к электрону найдены лишь для небольшого числа элементов. Понятно, что сродство к электрону зависит от электронной конфигурации атома, и в характере его изменения с увеличением порядкового номера элемента наблюдается отчетливо выраженная периодичность (рис. 2.7). Сравнение с изменением энергии ионизации показывает, что максимумы и минимумы на кривой сродства к электрону смещены по сравнению с кривой энергии ионизации на один элемент влево.
В периодах слева направо сродство к электрону и окислительные свойства элементов возрастают (исключение для N и P). В подгруппах сверху вниз сродство к электрону, как правило, уменьшается.
Как следует из данных табл. 2.3 и рис. 2.7, наибольшим сродством к электрону обладают р – элементы VII группы. Наименьшее и даже отрицательное сродство к электрону имеют атомы с конфигурацией s2 (Be, Mg, Zn) и s2p6 (Ne, Ar, Kr) или с наполовину заполненным р–подуровнем (N, P, As). Это служит дополнительным доказательством повышенной устойчивости указанных электронных конфигураций.
Выделением энергии сопровождается присоединение одного электрона к атомам кислорода, серы, углерода и некоторым другим. Таким образом, для указанных элементов силы притяжения к ядру дополнительного электрона оказываются большими, чем силы отталкивания между дополнительным электроном и электронной оболочкой атома.
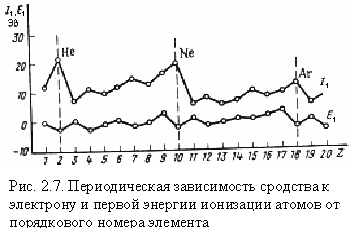
Таблица 2.3
Энергия сродства к электрону (Е) атомов некоторых элементов
| Элемент | Е, эВ | Элемент | Е, эВ | Элемент | Е,эВ |
| H | 0,754 | N | -0,21 | Al | 0,52 |
| He | -0,22 | O | 1,467 | Cl | 3,61 |
| Li | 0,59 | F | 3,45 | K | 0,52 |
| Be | -0,19 | Ne | -0,57 | Br | 3,54 |
| B | 0,3 | Na | 0,34 | I | 3,29 |
| C | 1,27 | Mg | -0,22 |
Присоединение последующих электронов, т. е. двух, трех электронов и более к атому, согласно квантово-механическим расчетам, невозможно. Поэтому одноатомные (простые) многозарядные анионы (О2-, S2-, N3-) в свободном состоянии существовать не могут.
Электроотрицательность
Электроотрицательность (ЭО) элементахарактеризует способность его атомов притягивать к себе электроны, участвующие в образовании химических связей с другими атомами вмолекуле, ионе. Очевидно, что эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно одному из определений (Малликен), электроотрицательность атома ЭО может быть выражена как полусумма его энергии ионизации и сродства к электрону: 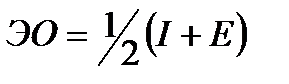 .
.
Имеется около 20 шкал электроотрицательностей, в основу расчета значений которых положены разные свойства вещества. Значения электроотрицательностей разных шкал отличаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково.
В шкале относительных электроотрицательностей (ОЭО) по Полингу (рис. 2.8) электроотрицательность фтора принята равной 4,0.
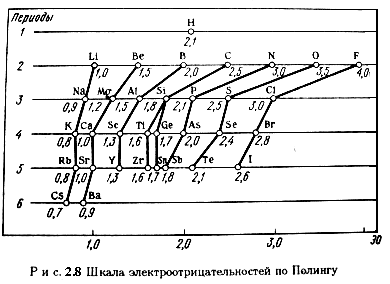
Как видно из приведенных данных, в периодах наблюдается общая тенденция роста величины электроотрицательности, а в подгруппах - ее падения. Наименьшими значениями электроотрицательности характеризуются s–элементы I группы, а наибольшими – р–элементы VII группы.
Дата: 2019-02-19, просмотров: 447.