Элементы в периодической системе располагаются в последовательности возрастания порядковых номеров Z от 1 до 110.
Порядковый номер элемента Z соответствует заряду ядра его атома, а также числу движущихся в поле ядра электронов.
Химические элементы по структуре невозбужденных атомов подразделяются на естественные совокупности, что отражено в периодической системе в виде горизонтальных и вертикальных рядов – периодов и групп.
Период представляет собой последовательный ряд элементов, в атомах которых происходит заполнение одинакового числа энергетических уровней (электронных слоев).
Номер периода указывает на число электронных слоев в атомах элементов.
Периоды начинаются s-элементами, в атомах которых на новом уровне появляется первый s-электрон с новым значением главного квантового числа n (водород и щелочные металлы), а заканчиваются р-элементами, атомами благородных газов, имеющих устойчивую электронную структуру внешнего уровня ns2np6 (у первого периода – s-элементом2He).
Различие в последовательности заполнения электронных слоев (внешних и более близких к ядру) объясняет причину различной длины периодов: 1,2,3 периоды – малые, 4,5,6,7 – большие периоды. Малые периоды содержат 2 и 8 элементов, большие периоды – 18 и 32 элемента, седьмой период остается незавершенным, хотя конструктивно он построен аналогично шестому периоду.
В соответствии с максимальным числом электронов на внешнем уровне невозбужденных атомов элементы периодической системы подразделяются на восемь групп.
Группы элементов – это совокупность элементов с одинаковым количеством валентных электронов в атоме. Номер группы равен числу валентных электронов.
Положение в группах s- и p-элементов определяется общим числом электронов внешнего слоя. Например, фосфор ( 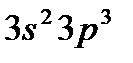 ), имеющий на внешнем слое пять электронов, относится к V группе, аргон (
), имеющий на внешнем слое пять электронов, относится к V группе, аргон ( 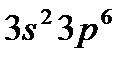 ) – к VIII, кальций (
) – к VIII, кальций ( 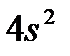 ) – ко II группе и т. д.
) – ко II группе и т. д.
Положение в группах d-элементов обусловливается общим числом s- электронов внешнего и d-электронов предвнешнего уровня.
По этому признаку первые шесть элементов каждого семейства d-элементов располагаются в одной из соответствующих групп: скандий 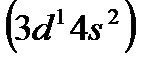 вIII, марганец
вIII, марганец 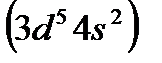 в VII, железо
в VII, железо 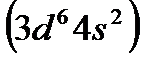 в VIII и т. д. Цинк
в VIII и т. д. Цинк 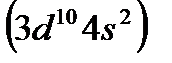 , у которого предвнешний слой завершен и внешними являются
, у которого предвнешний слой завершен и внешними являются 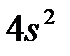 –электроны, относится ко II группе.
–электроны, относится ко II группе.
В атомах d-элементов, как правило, на внешнем уровне содержится по два электрона, исключение составляют: Cr, Cu, Nb, Mo, Ru, Rh, Ag, Pt, Au. У атомов перечисленных элементов наблюдается энергетически выгодный «провал» одного электрона с внешнего уровня на d-подуровень предвнешнего уровня, что происходит при достройке этого подуровня до пяти (половинная емкость) или десяти электронов (максимальная емкость), т. е. до состояния, когда все орбитали заняты, каждая одним электроном, или, когда они заняты каждая парой электронов. В атоме палладия (Pd) происходит «двойной провал» электронов.
По наличию на внешнем слое лишь одного электрона (за счет «провала» одного из s–электронов внешнего слоя в предвнешний d–подслой) медь ( 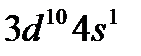 ), а также серебро
), а также серебро 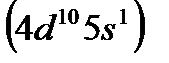 и золото
и золото 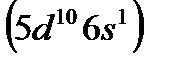 относят к I группе.
относят к I группе.
Кобальт 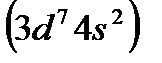 и никель
и никель 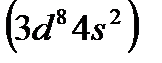 , родий
, родий 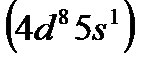 и палладий
и палладий 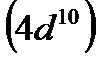 , иридий
, иридий 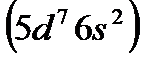 и платину
и платину 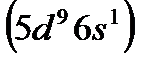 вместе с Fe, Ru, и Os обычно помещают в VIII группу.
вместе с Fe, Ru, и Os обычно помещают в VIII группу.
В соответствии с особенностями электронных структур семейства 4f-(лантаноиды) и 5f-(актиноиды) элементов помещают в III группу.
Группы делятся на подгруппы: главные (подгруппы А) и побочные (подгруппы В).
Подгруппы включают в себя элементы с аналогичными электронными структурами (электронные аналоги). s- и р-элементы составляют так называемую главную подгруппу, или подгруппу А, d-элементы – побочную, или подгруппу В.
Например, IV группа периодической системы состоит из следующих подгрупп:
| Элементы главной подгруппы (А): | Элементы побочной подгруппы (В): | ||
| 6C | …2s22p2 | 22Ti | …4s23d2 |
| 14Si | …3s23p2 | 40Zr | …5s24d2 |
| 32Ge | …4s24p2 | 72Hf | …6s25d2 |
| 50Sn | …5s25p2 | ||
| 82Pb | …6s26p2 | ||
f-элементы (4f-лантаноиды и 5f-актиноиды) вынесены вниз таблицы, в отдельные строки, в соответствии с особенностями их конфигурации. Лантаноиды и актиноиды иногда объединяют во вторые побочные подгруппы. В каждой из них по два элемента – один лантаноид и один актиноид.
Дата: 2019-02-19, просмотров: 413.