Согласно МВС наиболее прочные химические связи возникают в направлении максимального перекрывания атомных орбиталей. Поскольку атомные орбитали имеют определённую форму, их максимальное перекрывание возможно при определённой пространственной ориентации, поэтому ковалентная связь характеризуется направленностью. Иначе говоря, направленность заключается в том, что максимальное перекрывание валентных электронных облаков взаимодействующих атомов возможно при определенной их взаимной ориентации. Направленность ковалентной связи определяет пространственную конфигурацию молекул.
В зависимости от направления перекрывания атомных орбиталей различают σ-, π- и δ-связи.
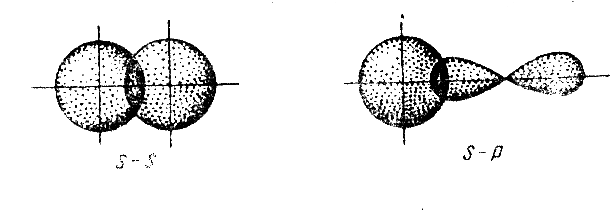
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ–связью.
Сигма-связь может возникать при перекрывании s–орбиталей (рис. 3.3,а), s– , p–орбиталей (рис. 3.3,б), р –орбиталей (рис. 3.3,в), d–орбиталей (рис. 3.3,г), а также d– и s–орбиталей, и f–орбиталей с друг другом и другими орбиталями.
σ-связь обычно охватывает два атома и не простирается за их пределы, поэтому является локализованной двухцентровой связью.
Простейший случай σ-связи наблюдается у молекулы Н2, образующейся за счет перекрывания s-орбиталей атомов водорода (s-s перекрывание, рис. 3.4). Геометрическая форма молекулы линейная.
Рассмотрим образование молекулы HCl.
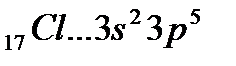
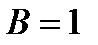
3s 3p 3d
3s 3p 3d
Исходя из стехиометрического состава молекулы HCl и валентности водорода, равной единице, мы видим, что хлор, находясь в невозбужденном состоянии, проявляет валентность В=1 (в возбужденном состоянии хлор проявляет валентности 3, 5, 7). При образовании молекулы HCl происходит перекрывание s–орбитали атома водорода с р–орбиталью атома хлора (s – р перекрывание). Молекула имеет линейную форму (рис. 3.5). Очевидно, такие же линейные молекулы должны образовать с водородом аналоги хлора – бром, йод, астат.
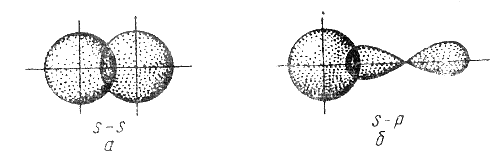
| Рис. 3.3. Перекрывание атомных орбиталей при образовании σ-связей |
| Рис.3.5. Схема образования молекулы HCl |
| Н |
| Cl |
| Рис. 3.4. Схема образования молекулы Н2. |
| Н |
| Н |
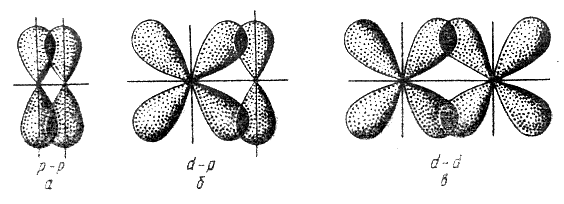
Рис. 3.6 . Перекрывание атомных орбиталей при образовании π-связей
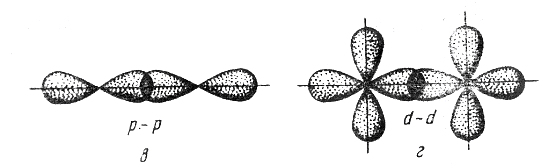
Связь, образованная перекрыванием АО по обе стороны линии, соединяющей ядра атомов (боковые перекрывания), называется π-связью. Пи-связь может образовываться при перекрывании р – р-орбиталей (рис. 3.6, a), p – d-орбиталей (рис. 3.6,б), d – d-орбиталей (рис. 3.6,в), а также f– p-, f – d- и f – f-орбиталей.
Связь, образованная перекрыванием d-орбиталей всеми четырьмя «лепестками» называется δ-связью (дельта-связью, рис. 3.7).
Соответственно, s-элементы могут образовывать только σ-связи, р-элементы – σ- и π-связи, d-элементы – σ-, π- и δ-связи, а f-элементы – σ-, π-, δ- и еще более сложные связи. В связи с меньшим перекрыванием АО прочность у π- и δ-связей ниже, чем у σ-связей.

Рис. 3.7. Направления перекрывания атомных d – орбиталей при образовании δ-связей
Кратность связи
Связь, которая образована одной электронной парой между двумя атомами, называется одинарной. Одинарная связь всегда σ – связь. Химическая связь может осуществляться более чем одной парой электронов. Связь, образованная более чем одной электронной парой, называется кратной (двойной или тройной), которая образуется при наложении σ-, π- и δ-связей. В кратных связях одна из связей обязательно является σ – связью.
При наложении π-связи на σ-связь образуется двойная связь, например в молекулах кислорода, этилена, диоксида углерода.
\ /
Двойная связь изображается двумя черточками: О =О, С = С, О = С = О.
/ \
Хотя энергия π-связи меньше, чем энергия σ-связи, однако суммарная энергия двойной связи выше энергии одинарной связи, а длина двойной связи меньше длины одинарной связи.
При наложении двух π-связей на σ-связь возникает тройная связь, например в молекулах азота, ацетилена и оксида углерода (II). Тройная связь изображается тремя черточками: N ≡ N, ─ C ≡ C ─, C ≡ O. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связей.
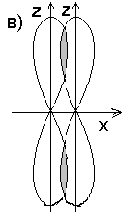
Число связей между атомами в МВС называется кратностью связи. Примером образования кратной связи может служить молекула азота N2.
 В=3
В=3
2s 2p
На рис. 3.8,а показано расположение в пространстве р - орбиталей в двух атомах азота. В молекуле азота рх – орбитали образуют одну σ-связь (рис. 3.8,б).
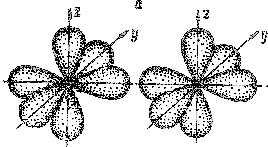
| Рис. 3.8. Образование σ- и π-связей в молекуле азота |
В некоторых молекулах и ионах, содержащих двойные связи, π-связи являются делокализованными, т. е. охватывающими не два атома, а часть или целые молекулы или ионы. Например, структура молекулы 1, 3-бутадиена может быть записана в двух формах:
СН2 = СН – СН = СН2 и СН2 – СН = СН – СН2
В действительности в чистом виде не существует ни та, ни другая структура, а гибридная структура, в которой π-электроны не принадлежат двум конкретным атомам, а всей молекуле в целом. π-связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами, называются делокализованными связями, обозначаемыми пунктиром:

Приведенная структура называется резонансной.
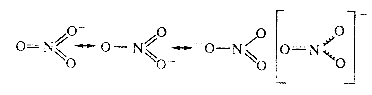 Другими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:
Другими примерами соединений с делокализованными связями служат молекула озона О3, бензола С6Н6, а также ионы NO3‾, СО32-, SO42-:
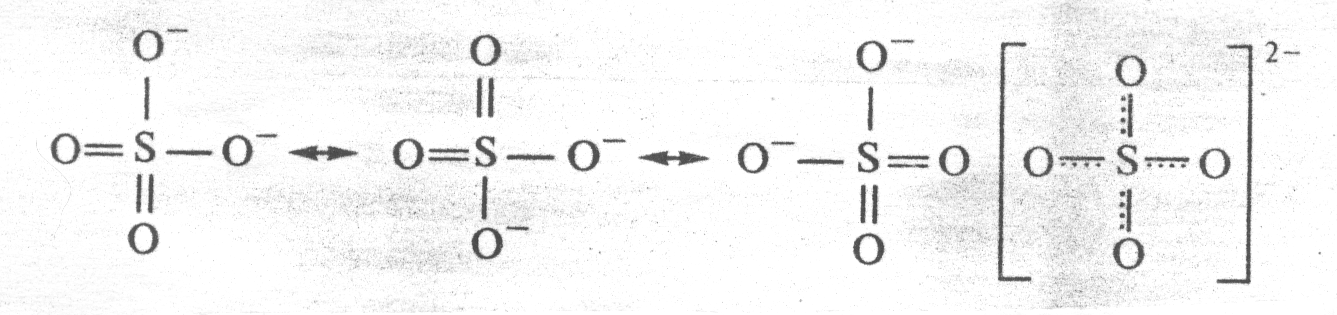
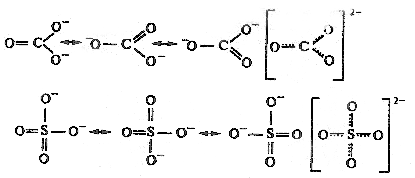
Пространственные формы молекул весьма разнообразны. Так, молекула СО2 имеет линейную структуру, молекула СН4 – тетраэдрическую, молекула NH3 – пирамидальную, воды – угловую, SO3 – треугольную.
Для объяснения пространственной конфигурации молекул используется модель (теория) гибридизации атомных орбиталей.
Дата: 2019-02-19, просмотров: 590.