Последовательность заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах определяют:
- принцип наименьшей энергии;
- правило Клечковского;
- принцип запрета Паули;
- правило Гунда.
1. Принцип наименьшей энергии: максимуму устойчивости системы соответствует минимум её энергии.
Следовательно, в соответствии с принципом наименьшей энергии, электроны будут вначале располагаться наатомных орбиталях, имеющих минимальную энергию, в этом случае связь электронов с ядром наиболее прочная и атомная система находится в состоянии максимальной устойчивости.
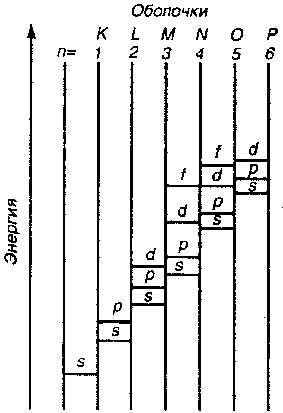
| Рис. 2.4. Примерная схема относительного расположения энергетических подуровней в многоэлектронных атомах |
2. Порядок возрастания энергии атомных орбиталей в сложных атомах описывается правилом Клечковского: при увеличении заряда ядра атома заполнение орбиталей происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n+l), а при равных значениях суммы (n+l) – в порядке возрастания n.
Соответственно этому правилу, подуровни выстраиваются в следующий ряд: 1s<2s<2p<3s<3p<4s≈3d<4p<5s≈4d<5p<6s≈4f≈5d<6p<7s≈5f≈6d.
Например:
| Подуровни | 3d | 4s | 4p |
| n | 3 | 4 | 4 |
| l | 2 | 0 | 1 |
| n+l | 5 | 4 | 5 |
Таким образом, в данном случае порядок заполнения будет следующий: 4s, 3d, 4p.
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подуровнями, у которых наблюдается так называемый «провал» (или «проскок») электронов, например: Cu, Ag, Cr, Mo, Pd, Pt (это явление будет рассмотрено позднее).
3. Принцип запрета Паули: в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел.
Согласно этому принципу, на одной орбитали, характеризуемой определенными значениями трех квантовых чисел n, l и ml, могут находиться только два электрона, отличающихся значением спинового квантового числа ms, а именно ms=+ 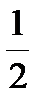 и ms=–
и ms=– 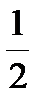 , т.е. спины которых противоположно направлены.Символически это можно представить следующей схемой ..
, т.е. спины которых противоположно направлены.Символически это можно представить следующей схемой ..
Заполнение и не допускается.
Принцип запрета Паули определяет электронную емкость энергетических уровней и подуровней:
- на s-подуровне (одна орбиталь) может быть два электрона,
- на p-подуровне (три орбитали) – шесть,
- на d-подуровне (пять орбиталей) – десять,
- на f-подуровне (семь орбиталей) – четырнадцать электронов.
Вобщем случае, максимальное число электронов на подуровне с орбитальным квантовым числом l равно 2(2l+1). Поскольку число орбиталей данного энергетического уровня равно n2, емкость энергетического уровня составляет 2n2 электронов, где n – соответствующее значение главного квантового числа.
4. Правило Гунда: устойчивому (невозбужденному) состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спинового числа их (│∑ms│) максимально.
Рассмотрим распределение электронов по энергетическим ячейкам в атоме углерода, электронная конфигурация которого 1s22s22p2. Возможны три варианта:
а) б) в)
1s 2s 2p 1s 2s 2p 1s 2s 2p
∑ms= 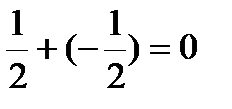 ∑ms =+
∑ms =+  ∑ms=0
∑ms=0
Во всех вариантах спиновое число 1s2- и 2s2-электронов равно 0 (в каждой энергетической ячейке спины электронов антипараллельны).
Суммарное спиновое число p-электронов в вариантах a) и в) равно нулю (∑ms=0), а в варианте (б) ∑ms=1.
В соответствии с правилом Гунда реализуется только вариант (б).
Другими словами:заполнение орбиталей одного подуровня в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данном подуровне, заполняются орбитали вторыми электронами с противоположными спинами.
Дата: 2019-02-19, просмотров: 466.