Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций (формул) первых двух периодов приведены в табл. 2.2.
Таблица 2.2
Электронные конфигурации элементов первых двух периодов
| Атомный номер | Элемент | Электронная конфигурация |
| 1 | Водород | 1s1 |
| 2 | Гелий | 1s2 |
| 3 | Литий | 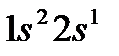
|
| 4 | Бериллий | 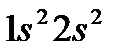
|
| 5 | Бор | 1s22s22p1 |
| 6 | Углерод | 1s22s22p2 |
| 7 | Азот | 1s22s22p3 |
| 8 | Кислород | 1s22s22p4 |
| 9 | Фтор | 1s22s22p5 |
| 10 | Неон | 1s22s22p6 |
Первый период состоит из двух элементов: водорода и гелия (Z=2). Оба элемента являются s-элементами. Атомом гелия заканчивается формирование первого уровня (K-оболочки; n = 1) атома, обозначим её [He].
У элементов второго периода формируется второй энергетический уровень (L-оболочка; n = 2), заполняются s- и p-подуровни. Li (Z = 3) и Be (Z= 4) относятся к s-элементам, остальные шесть элементов периода входят в число p-элементов. У элемента Ne (Z= 10) полностью заполнен 2p-подуровень, обозначим его электронную конфигурацию как [Ne]. Электронные конфигурации элементов в основном состоянии в краткой записи представлены в приложении 1(запись электронной конфигурации полностью заполненных подуровней предыдущих периодов не приводится).
У элементов 3-го периода заполняется третий уровень (оболочка М; n=3), состоящий из 3s-, 3p- и 3d-орбиталей. Начинается период с натрия (Z=11),электронная конфигурация которого 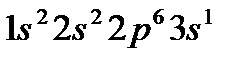 , и заканчивается аргоном (Z=18), с электронной конфигурацией
, и заканчивается аргоном (Z=18), с электронной конфигурацией 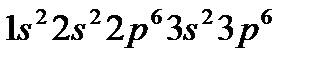 . Натрий –электронный аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al–Ar) –p-элементами.
. Натрий –электронный аналог лития, аргон – неона. В третьем периоде, так же, как и во втором, восемь элементов, из них два первых элемента Na(Z=11) и Mg(Z=12) являются s-элементами, шесть последних (Al–Ar) –p-элементами.
Хотя в третьем уровне (оболочка М) имеется 3d-подуровень, который остается незаконченным, в четвертом периоде начинает формироваться следующий уровень – четвертый (оболочка N; n=4) и период начинается с s-элемента калия (Z=19).
Внешний 4s - электрон придает элементу свойства, сходные со свойствами натрия. Появление электрона в 4s-состоянии при наличии свободных 3d-орбиталей обусловливается экранированием(заслонением) ядра плотным и симметричным электронным слоем 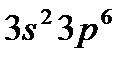 . В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция энергетически выгодным оказывается 4s-состояние:
. В связи с отталкиванием от этого слоя для 19-го электрона атома калия и 20-го электрона атома кальция энергетически выгодным оказывается 4s-состояние:
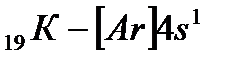 ,
, 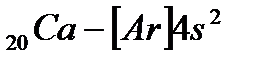 .
.
То есть энергия 4s–подуровня несколько ниже, чем энергия 3d- подуровня (см. рис. 2.4). В соответствии с правилом Клечковского, (n+l) у 4sниже(4), чем (n+l) у 3d (5).
С элемента скандия (Z=21) начинается заполнение 3d-подуровня, так как он энергетически более выгоден, чем 4p-подуровень. Пять орбиталей 3d-подуровня могут быть заняты десятью электронами, что осуществляется у атомов от скандия до цинка (Z=30). Элементы от 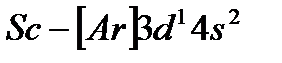 до
до 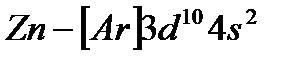 относятся к d-элементам. Cледовательно, у d-элементов 4-го периода, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв.
относятся к d-элементам. Cледовательно, у d-элементов 4-го периода, достраивается слой М (третий уровень; n=3) до 18 электронов. В связи с этим важно отметить, что физические и химические свойства элементов в первую очередь определяются структурой внешнего энергетического слоя их атомов и лишь в меньшей степени зависят от строения предшествующих (внутренних) электронных слоёв.
У атомов всех d-элементов внешний слой образован одним или двумя s-электронами, поэтому химические свойства d-элементов с увеличением порядкового номера изменяются не так резко, как свойства s- и p-элементов. Все d-элементы принадлежат к металлам, тогда как заполнение внешнего p-подуровня приводит к переходу от металла к типичному неметаллу и, наконец, к благородному (инертному) газу.
После заполнения 3d-орбиталей у последующих шести элементов (Ga – Kr) заполняются p-орбитали внешнего слоя. Четвертый период завершается формированием подуровня 4р у криптона – [Ar] 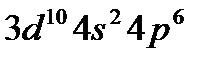 или[Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
или[Kr], являющегося аналогом аргона. Всего в четвертом периоде 18 элементов. Таким образом, четвертый период начинается двумя s-элементами и заканчивается шестью р-элементами, но в отличие от второго и третьего периодов между s- и p-элементами располагаются десять d-элементов (вставная декада большого периода; переходные элементы).
В пятом периоде заполнение электронных уровней и подуровней происходит, как и в четвертом периоде, а именно: у двух первых элементов (s-элементов 37Rb и 38Sr) и шести последних (р-элементов 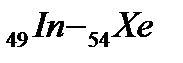 ) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов (
) заполняется внешний слой. Между s- и р - элементами располагаются десять d – элементов ( 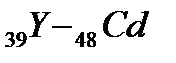 ), у которых заполняются d-орбитали предвнешнего уровня (4d-подуровень). Всего в пятом периоде 18 элементов.
), у которых заполняются d-орбитали предвнешнего уровня (4d-подуровень). Всего в пятом периоде 18 элементов.
Шестой период содержит 32 элемента (см. приложение 1) и тоже начинается двумя s-элементами ( 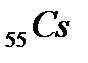 и
и 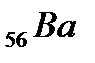 ). Далее у лантана начинает заполняться d-орбиталь предвнешнего уровня (5d-подуровень):
). Далее у лантана начинает заполняться d-орбиталь предвнешнего уровня (5d-подуровень):
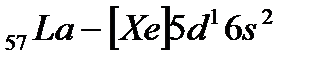 .
.
После чего заполнение этого подуровня приостанавливается, а начинает заполняться энергетически более выгодный 4f-подуровень (рис. 2.4), семь орбиталей которого могут быть заняты 14 электронами. Это происходит у 14 атомов элементов лантаноидов 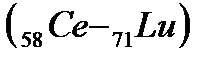 , относящихся к f-элементам. Поскольку у этих элементов заполняется глубинный 4f- подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р-элементами
, относящихся к f-элементам. Поскольку у этих элементов заполняется глубинный 4f- подуровень третьего снаружи уровня, они обладают близкими химическими свойствами. С гафния (Z=72) возобновляется заполнение 5d подуровня и заканчивается у ртути (Z=80), после чего электроны заполняют 6р – подуровень: шестой период, как и пятый, завершается шестью р-элементами 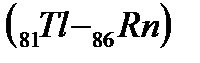 . В шестом периоде 32 элемента, из них: два s-элемента, шесть р-элементов, десять d-элементов и четырнадцать f-элементов.
. В шестом периоде 32 элемента, из них: два s-элемента, шесть р-элементов, десять d-элементов и четырнадцать f-элементов.
В седьмом периоде имеются два s-лемента 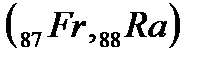 , за ними следуют:d-элемент
, за ними следуют:d-элемент 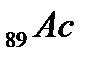 и четырнадцать f-элементов – актиноидов
и четырнадцать f-элементов – актиноидов 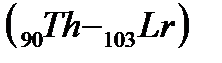 , далее снова d-элементы (
, далее снова d-элементы ( 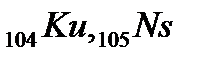 , элементы 106 - 110).Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.
, элементы 106 - 110).Актиноиды, как и лантаноиды, обладают многими сходными химическими свойствами. В противоположность предыдущим, 7-й период не завершён.
Как следует из изложенного, по мере роста заряда ядра происходит закономерная периодическаяповторяемость сходных электронных структур элементов, а следовательно, и повторяемость их свойств, зависящих от строения электронных оболочек атомов.
Периодическая система Д. И. Менделеева отражает периодический закон, является естественной классификацией химических элементов по электронной структуре их атомов.
Дата: 2019-02-19, просмотров: 415.