Материальный баланс реактора
Обозначим количество изобутилена, поступающего в реактора как GИБ. Тогда количество конвертированного изобутилена составит

где ХИБ – конверсия изобутилена, доля масс. (таблица 3.1).
Количество образовавшегося МТБЭ составит:

где S – селективность процесса по изобутилену (на МТБЭ); ММТБЭ и МИБ – молекулярные массы МТБЭ и изобутена соответственно, г/моль.
Таблица 3.3 – Варианты заданий для расчета реактора синтеза МТБЭ
| Вариант | Производительность реактора, т/год по МТБЭ | Количество дней работы | Температура процесса, °С |
| 1 | 25000 | 325 | 60 |
| 2 | 27500 | 330 | 65 |
| 3 | 30000 | 335 | 70 |
| 4 | 32500 | 340 | 75 |
| 5 | 35000 | 325 | 80 |
| 6 | 37500 | 330 | 60 |
| 7 | 40000 | 335 | 65 |
| 8 | 42500 | 340 | 70 |
| 9 | 45000 | 325 | 75 |
| 10 | 47500 | 330 | 80 |
| 11 | 50000 | 335 | 60 |
| 12 | 52500 | 340 | 65 |
| 13 | 55000 | 325 | 70 |
| 14 | 57500 | 330 | 75 |
| 15 | 60000 | 335 | 80 |
| 16 | 62500 | 340 | 60 |
| 17 | 65000 | 325 | 65 |
| 18 | 67500 | 330 | 70 |
| 19 | 70000 | 335 | 75 |
| 20 | 72500 | 340 | 80 |
| 21 | 75000 | 325 | 60 |
| 22 | 77500 | 330 | 65 |
| 23 | 80000 | 335 | 70 |
| 24 | 82500 | 340 | 75 |
| 25 | 85000 | 325 | 80 |
| 26 | 87500 | 330 | 60 |
| 27 | 90000 | 335 | 65 |
| 28 | 92500 | 340 | 70 |
| 29 | 95000 | 325 | 75 |
| 30 | 97500 | 330 | 80 |
Подбираем значение GИБ таким образом, чтобы количество образовавшегося МТБЭ совпадало со значением, представленным в таблице 3.1. В ходе подбора определили, что GИБ = 4271,6 кг/ч. Таким образом,
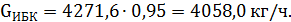
Количество образовавшегося МТБЭ составит
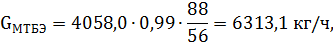
что совпадает с табличным значением.
Количество непрореагировавшего изобутилена определяется по формуле

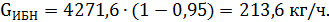
Количество углеводородной фракции, поступающей в реактор,

где 0,484 – содержание изобутилена в исходном сырье, доля мас. (таблица 3.2).
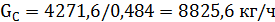 .
.
Массовое соотношение метанол : изобутилен определится как
 )
)
где К – мольное соотношение метанол : изобутилен (табл. 3.1); ММЕТ – молекулярная масса метанола, г/моль.
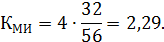
Количество метанола на входе в реактор:

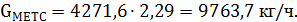
Количество метанола, пошедшего на образование МТБЭ:

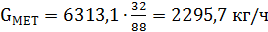 .
.
Количество непрореагировавшего метанола на выходе из реактора:

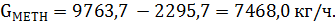
Количество воды, пошедшей на образование третбутилового спирта:
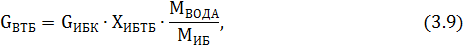
где МВОДА – молекулярная масса воды, г/моль; ХИБТБ - доля изобутилена, пошедшего на образование третбутанола, доля мас. (таблица 3.1).
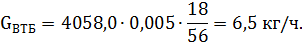
Количество образовавшегося третбутанола:

где МТБ – молекулярная масса третбутанола, г/моль.
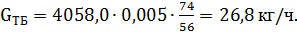
Количество образовавшегося изооктилена:

где ХИБИО – доля изобутилена, пошедшая на образование изооктилена, доля мас.
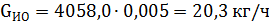 .
.
Материальный баланс реактора представлен в таблице 3.4.
Таблица 3.4 – Материальный баланс реактора
| Компонент | % масс. | т/год | т/сут | кг/ч | кг/с |
| Приход |
|
|
|
|
|
| ∑C3 | 0,24 | 349,5 | 1,1 | 44,1 | 0,012 |
| Изобутан | 0,95 | 1398,0 | 4,2 | 176,5 | 0,049 |
| Н-бутан | 5,70 | 8387,9 | 25,4 | 1059,1 | 0,294 |
| Бутен-1 + бутен-2 | 17,56 | 25862,6 | 78,4 | 3265,5 | 0,907 |
| Изобутилен | 22,97 | 33831,1 | 102,5 | 4271,6 | 1,187 |
| ∑C5 | 0,05 | 69,9 | 0,2 | 8,8 | 0,002 |
| Метанол | 52,50 | 77328,3 | 234,3 | 9763,7 | 2,712 |
| Вода | 0,04 | 51,7 | 0,2 | 6,5 | 0,002 |
| Итого | 100,0 | 147279,0 | 446,3 | 18595,8 | 5,166 |
| Расход | |||||
| МТБЭ | 33,95 | 50000,0 | 151,5 | 6313,1 | 1,754 |
| Непрореагировавший метанол | 40,16 | 59146,5 | 179,2 | 7468,0 | 2,074 |
| Непрореагировавший изобутилен | 1,15 | 1691,6 | 5,1 | 213,6 | 0,059 |
| ∑C3 | 0,24 | 349,5 | 1,1 | 44,1 | 0,012 |
| Изобутан | 0,95 | 1398,0 | 4,2 | 176,5 | 0,049 |
| Н-бутан | 5,70 | 8387,9 | 25,4 | 1059,1 | 0,294 |
| Бутен-1 + бутен-2 | 17,56 | 25862,6 | 78,4 | 3265,5 | 0,907 |
| ∑C5 | 0,05 | 69,9 | 0,2 | 8,8 | 0,002 |
| Изооктилен | 0,11 | 160,7 | 0,5 | 20,3 | 0,006 |
| Третбутанол | 0,14 | 212,4 | 0,6 | 26,8 | 0,007 |
| Итого | 100,0 | 147279,0 | 446,3 | 18595,8 | 5,166 |
Тепловой баланс реактора
Суть теплового баланса реактора заключается в определении количества несбалансированного тепла, образующегося в ходе процесса и в расчете количества водяного конденсата, необходимого для снятия избытка тепла процесса синтеза МТБЭ. Количество вносимого в реактор или уносимого из реактора тепла определится по формуле

где Gi – расход i-го компонента, кг/с; Сpi – теплоемкость i-го компонента, кДж/(кг∙град); ti – температура, °С.
Для углеводородных компонентов сырья и продуктов реакции теплоемкость определим по формуле
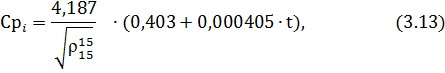
где 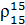 – относительная плотность нефтепродукта.
– относительная плотность нефтепродукта.
Значение 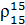 определим по формуле
определим по формуле
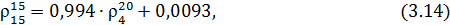
где 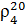 - относительная плотность нефтепродукта при 20 °С. Является справочной величиной.
- относительная плотность нефтепродукта при 20 °С. Является справочной величиной.
Значения плотностей углеводородных компонентов сырья представлены в таблице 3.5.
Таблица 3.5 – Плотности углеводородных компонентов сырья
| Компонент | Плотность, ρ420 | Плотность, ρ1515 |
| ∑C3 | 0,5100 | 0,5162 |
| Изобутан | 0,5573 | 0,5633 |
| Н-бутан | 0,5789 | 0,5847 |
| Бутен-1 + бутен-2 | 0,5945 | 0,6002 |
| Изобутилен | 0,595 | 0,6007 |
| ∑C5 | 0,6262 | 0,6317 |
| Диизобутилен | 0,7149 | 0,7199 |
Значения теплоемкости метанола, третбутанола и МТБЭ являются справочной величиной.
Потери тепла в реакторе принимаются равными 1 % от входящего тепла.
Реакция синтеза МТБЭ протекает с выделением тепла. Тепловой эффект реакции определяется по формуле

где НПРОД и НС – теплоты образования продуктов реакции и исходного сырья соответственно, кДж/моль.
Ввиду малой доли побочных реакций в ходе процесса их влиянием на тепловой эффект пренебрегаем. Теплоты образования метанола, изобутилена и МТБЭ приведены в таблице 3.6.
Таблица 3.6 – Теплоты образования компонентов
| Компонент | МТБЭ | Метанол | Изобутилен |
| Теплота образования, кДж/моль | -291 | -201 | -16,92 |
Таким образом, согласно реакции, по которой протекает процесс, тепловой эффект реакции составит
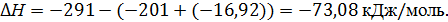
Мольное количество образовавшегося МТБЭ составит
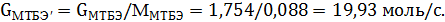
Таким образом, количество тепла, выделившееся в ходе синтеза МТБЭ составит
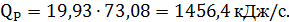
Тепловой баланс реактора представлен в таблице 3.7.
Из таблицы 3.7 видно, что разность входящего и уходящего тепла равняется
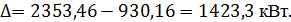
Количество воды, необходимой для снятия избытка тепла процесса, вычисляется по формуле:

где Срв – теплоемкость воды, принимается равной 4,187 кДж/(кг∙К); tН и tК – начальная и конечная температура соответственно охлаждающей воды, °С; принимаем соответственно 20 и 40 °С.
Подставляя значения, получим
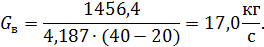
Таблица 3.7– Тепловой баланс реактора
| Компонент | Расход, кг/с | Температура, °С | Теплоемкость, кДж/(кг∙град) | Количество тепла, кДж/с |
| Приход |
|
|
|
|
| ∑C3 | 0,012 | 70,00 | 2,514 | 2,16 |
| Изобутан | 0,049 | 70,00 | 2,406 | 8,26 |
| Н-бутан | 0,294 | 70,00 | 2,362 | 48,64 |
| Бутен-1 + бутен-2 | 0,907 | 70,00 | 2,331 | 148,02 |
| Изобутилен | 1,187 | 70,00 | 2,330 | 193,54 |
| ∑C5 | 0,002 | 70,00 | 2,272 | 0,39 |
| Свежий метанол | 0,638 | 70,00 | 2,610 | 116,51 |
| Циркулирующий метанол | 2,074 | 70,00 | 2,610 | 379,00 |
| Вода | 0,002 | 70,00 | 4,187 | 0,53 |
| Тепло реакции | - | - | - | 1456,41 |
| Итого | 5,166 | 2353,46 | ||
| Расход | ||||
| МТБЭ | 1,754 | 70,00 | 2,511 | 308,20 |
| Непрореагировавший метанол | 2,074 | 70,00 | 2,610 | 379,00 |
| Непрореагировавший изобутилен | 0,059 | 70,00 | 2,330 | 9,68 |
| ∑C3 | 0,012 | 70,00 | 2,514 | 2,16 |
| Изобутан | 0,049 | 70,00 | 2,406 | 8,26 |
| Н-бутан | 0,294 | 70,00 | 2,362 | 48,64 |
| Бутен-1 + бутен-2 | 0,907 | 70,00 | 2,331 | 148,02 |
| ∑C5 | 0,002 | 70,00 | 2,272 | 0,39 |
| Изооктилен | 0,006 | 70,00 | 2,129 | 0,84 |
| Третбутанол | 0,007 | 70,00 | 2,771 | 1,44 |
| Потери | - | - | - | 23,53 |
| Итого | 5,166 | 930,16 |
Дата: 2019-02-25, просмотров: 629.