541. Закончите составление уравнения окислительно-восстановительной реакции
CrBr3 + H2O2 + … → Na2CrO4 + NaBr + H2O.
Расставьте коэффициенты, используя метод ионно-электронного баланса. Вычислите молярные массы эквивалентов окислителя и восстановителя для данной ОВР.
542. Будет ли протекать реакция между I– и Fe3+ с образованием свободного йода? Чему равна ЭДС реакции? Ответ мотивируйте.
543. Вычислите ЭДС системы
Fe3+ + I– + H2O ↔ Fe2+ + IO 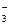 + H+.
+ H+.
Прямая или обратная реакция будет протекать в системе? Ответ мотивируйте (Е°(Fe3+/Fe2+) = +0,77 В, Е°(IO 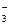 + 6Н+/ I– +
+ 6Н+/ I– +
+ 3H2O) = 1,09 В).
544. Напишите уравнения реакций взаимодействия между:
а) углеродом и азотной кислотой (при этом углерод окисляется до СО2, а азотная кислота восстанавливается до NO2);
б) йодидом водорода и перманганатом калия в сернокислой среде (при этом перманганат калия восстанавливается до сульфата марганца (II) и выделяется элементарный йод).
Для всех реакций составьте электронно-ионные схемы и подберите коэффициенты.
545. С помощью стандартных окислительно-восстановительных потенциалов определите, возможно ли окисление Fe2+ в Fe3+ в щелочной среде с помощью хромата калия? Ответ подтвердите расчетами.
546. Вычислите ЭДС системы
IO 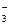 + SO
+ SO 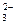 + H+ ↔ I2 + SO
+ H+ ↔ I2 + SO 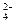 + H2O.
+ H2O.
Сделайте вывод прямая или обратная реакция будет протекать в системе?
547. Можно ли при стандартных условиях окислить хлорид водорода до Cl2 с помощью серной кислоты? Ответ подтвердите расчетом энергии Гиббса.
548. Закончите уравнение реакции и расставьте коэффициенты. В каком направлении протекает реакция? Ответ подтвердите расчетами
As2S3 + HNO3 → H3AsO4 + H2SO4 +… .
549. Уравняйте реакцию методом ионно-электронного баланса. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
MnO2¯ + О2 + KOH ® К2MnO4 + H2O.
550. Уравняйте реакцию методом ионно-электронного баланса. Укажите тип реакции, рассчитайте молярные массы эквивалентов окислителя и восстановителя.
Mn(OH)2¯ + Cl2 + KOH ® MnO2 + KCl + H2O.
551. К раствору сульфида натрия добавлена азотная кислота. Жидкость мутнеет вследствие образования свободной серы. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
552. Уравняйте ОВР, используя метод ионно-электронных уравнений. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
FeSO4 + KClO3 + H2SO4 = Fe2(SO4)3 + KCl + H2O.
553. Уравняйте реакцию методом ионно-электронного баланса и рассчитайте ЭДС
FeSO4 + Br2 + H2SO4 ® Fe2(SO4)3 + HBr.
554. Какие из ионов галогенов (F–, Cl–, Br–, I–) могут быть окислены до свободных галогенов азотистой кислотой (НNO2) в кислой среде? Для всех реакций составьте электронно-ионные схемы, подберите коэффициенты и рассчитайте стандартную ЭДС.
555. При взаимодействии йодоводородной и серной кислот образуется йод, сероводород и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
556. Вычислите окислительно-восстановительный потенциал для системы: MnO 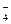 + 8H+ + 5e → Mn2+ + 4H2O, если Е°(MnO
+ 8H+ + 5e → Mn2+ + 4H2O, если Е°(MnO 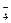 / Mn2+) = 1,51 В; С(MnO
/ Mn2+) = 1,51 В; С(MnO 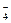 ) = 1×10- 5 моль/л; С(Mn2+) = 1×10‑2 моль/л; С(Н+) = 0,2 моль/л.
) = 1×10- 5 моль/л; С(Mn2+) = 1×10‑2 моль/л; С(Н+) = 0,2 моль/л.
557. По реакции между хроматом калия и соляной кислотой образовались хлорид хрома (III), хлор, хлорид калия и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя. Определите тип ОВР.
558. Чему равна концентрация ионов Н+ в растворе, если окислительно-восстановительный потенциал системы
Cr2O 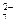 + 14H+ + 6e → 2Cr3+ + 7H2O
+ 14H+ + 6e → 2Cr3+ + 7H2O
равен 1,6 В, а концентрации ионов Cr2O 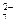 и Cr3+ равны, соответственно, 1 моль/л и 1×10-6 моль/л?
и Cr3+ равны, соответственно, 1 моль/л и 1×10-6 моль/л?
559. Может ли концентрированная азотная кислота при стандартных условиях окислить свинец до диоксида свинца? Ответ подтвердите расчетом энергии Гиббса.
560. Уравняйте ОВР, используя метод ионно-электронных уравнений. Определите тип реакции и вычислите молярные эквивалентные массы окислителя и восстановителя.
Zn + HNO3 = Zn(NO3)2 + NH4NO3 + H2O.
561. Закончите уравнения реакций и расставьте коэффициенты, используя метод ионно-электронного баланса. Определите тип ОВР. Рассчитайте молярные массы эквивалентов окислителя и восстановителя в ОВР:
а) KBr + MnO2 + H2SO4 → Br2 + MnSO4 +…;
б) FeS + HNO3 → Fe(NO3)3 + NO2 + H2SO4 +… .
562. При взаимодействии оксида хрома (III) с кремнием в присутствии оксида кальция образуется металлический хром и силикат кальция. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
563. Какой из окислителей – хромат или дихромат калия – является наиболее эффективным по отношению к бромоводороду при получении брома? Составьте уравнение реакции.
564. Закончите уравнения реакций и расставьте коэффициенты. В каком направлении протекают реакции?
а) KMnO4 + H3PO3 + H2SO4 → MnSO4 + H3PO4 + …;
б) K2Cr2O7 + H2O2 + H2SO4 → … .
565. Какой из окислителей – диоксид марганца, диоксид свинца или дихромат калия – является наиболее эффективным по отношению к хлороводородной кислоте при получении хлора? Составьте уравнения реакции.
566. Обработка сульфата железа (II) азотной и серной кислотами приводит к получению сульфата железа (III), оксида азота (II) и воды. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
567. По реакции оксида меди (II) с аммиаком образуются азот, медь и вода. Составьте уравнение реакции. Рассчитайте молярную эквивалентную массу окислителя и восстановителя.
568. Какую массу Al можно окислить с помощью 0,1 л 0,25 н. K2Cr2O7 по реакции:
Al+K2Cr2O7+H2SO4 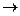 Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O.
Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O.
569. Какой объем 2 н Нbr необходим для взаимодействия с 0,25 моль K2Cr2O7 по реакции
Нbr + K2Cr2O7 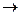 Kbr + CrBr3 + Br2 + H2O.
Kbr + CrBr3 + Br2 + H2O.
570. Какие из ионов галогенов (F–, Cl–, Br–, I–) могут быть окислены до свободных галогенов двуокисью свинца (PbO2) в кислой среде? Для всех реакций составьте электронно-ионные схемы, подберите коэффициенты и рассчитайте стандартную ЭДС.
Гальванические элементы
571. Составьте схемы двух гальванических элементов, в одном из которых медный электрод был бы катодом, а в другом – анодом. Приведите уравнения электродных и токообразующих процессов. Рассчитайте стандартные ЭДС этих элементов.
572. Вычислите потенциал железного электрода, погруженного в раствор, содержащий 0,0699 г дихлорида железа в 500 мл воды.
573. Какой должна быть активность ионов цинка в растворе, чтобы ЭДС гальванического элемента
Cu | Al | Al3+ || Zn2+ | Zn | Cu
при активности ионов алюминия 0,01 моль/л составила 0,947 В?
574. При какой активности ионов Pb2+ потенциал свинцового электрода составит 70 % от величины его стандартного потенциала?
575. Определите активность ионов Fe3+ в растворе, при которой потенциал железного электрода Fe3+/Fe при температуре 25 °C равен потенциалу водородного электрода в растворе с
рН = 2; Е°( Fe3+/ Fe) = 0,036 В.
576. Рассчитайте стандартную ЭДС и теоретическое время работы серебряно-цинкового элемента, в котором протекает токообразующая реакция
Ag2O + Zn → 2Ag + ZnO,
если при постоянном токе в 0,2 А израсходовано 13,8 г цинка; Е°(ZnO, H2O/Zn, 2OH–) = –1,246 В; Е°(Ag2O, H2O/2Ag, 2OH–) = = 0,344 В.
577. По уравнению токообразующей реакции
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb
составьте схему гальванического элемента. Напишите уравнения анодного и катодного процессов. Вычислите стандартную ЭДС этого элемента.
578. Составьте схему и напишите уравнения процессов, протекающих на его электродах при работе этого гальванического элемента, составленного из титана, погруженного в 0,1 М раствор сульфата титана (II), и никеля, погруженного в 0,01 М раствор сульфата никеля (II).
579. Определите значение электродного потенциала меди, погруженной в 0,0005 н раствор Cu(NO3)2.
580. Определите ЭДС концентрационного гальванического элемента при температуре 60 °C.
Ag | AgNO3(0,001M) || AgNO3 (0,1M) | Ag.
581. Вычислите потенциал свинцового электрода в насыщенном растворе PbBr2, если С(Br–) = 1 моль/л, а ПР(PbBr2) = 9,1 × × 10-6.
582. Вычислите потенциал водородного электрода, если С(Н+) в растворе равна 3,8 · 10-3 моль/л.
583. Вычислите потенциал серебряного электрода, погруженного в насыщенный раствор сульфида серебра. Во сколько раз надо изменить активность ионов Ag+ (увеличить или уменьшить), чтобы потенциал электрода стал равным нулю, если ПР(Ag2S) = = 6,3 · 10-50?
584. Гальваническая цепь составлена железом, погруженным в раствор его соли с концентрацией ионов Fe2+, равной 0,005 моль/л, и медью, погруженной в раствор ее соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС цепи стала равной нулю?
585. Составьте схему работы гальванического элемента, образованного железом и свинцом, которые погружены в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
586. Потенциал марганцевого электрода, помещенного в раствор его соли, составил –1,1 В. Вычислите активность ионов Mn2+.
587. Определите концентрацию ионов меди для концентрационной цепи
Cu| CuSO4 (0,1 г/л) || CuSO4 (х г/л)| Cu,
если ΔЕ = 0,059 В.
588. Вычислите ЭДС для концентрационных цепей.
а) Ag | AgNO3 (0,1 н) || AgNO3 (0,01 н) | Ag;
б) Zn| ZnSO4 (0,0001 г/л) || ZnSO4 (0,01 г/л)| Zn.
589. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Ni | NiSO4 (0,001 М) || CoSO4 (0,1 М) | Co.
590. Как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластина, уменьшится от 0,1 н до 0,01 н?
591. Рассчитайте величину потенциала окислительно-восстановительного электрода Pt|Fe3+, Fe2+, если активные концентрации FeCl3 и FeCl2 равны соответственно 0,05 М и 0,85 М; T = 298 К.
592. Для измерения рН сока поджелудочной железы была составлена гальваническая цепь из водородного и каломельного (насыщенного) электродов. На приборе при 30 ºC ЭДС показала значение 707 мВ. Вычислите рН сока поджелудочной железы и приведите схему гальванической цепи. (Е°(Hg2Cl2, KClнасыщен/Hg =0,241 В)
593. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Чему равна ЭДС этого элемента?
594. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрациями ионов Pb2+ и Mg2+ равными 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
595. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
596. Для питания различной аппаратуры используется сухой марганцево-цинковый элемент: (+)MnO2,C|NH4Cl|Zn (˗). Какова должна быть минимальная масса цинкового анода для получения 3,0 Вт·ч энергии при ЭДС элемента, равной 1,5 В. Составьте уравнение анодной реакции.
597. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Cd | CdSO4 (0,001 М) || CuSO4 (0,1 М) | Cu.
598. Определите, на сколько милливольт отличаются потенциалы кадмированного ножа космодесантника в растворах хлорида кадмия с концентрацией 0,01 М и 0,2 М.
599. Рассчитайте работу, совершаемую гальваническим элементом
(–) Cu | Cd| Сd2+(0,01М) || Мo3+ (0,01М)| Mo| Cu (+),
а также силу тока во внешней цепи, если за 10 мин в раствор перешло 1,124 г металла. Коэффициент выхода по току равен 0,9. Приведите уравнение токообразующего процесса.
600. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов концентрация ионов Cu2+ равна 1 моль/л, а у другого 10-3 моль/л? В каком направлении движутся электроны во внешней цепи? Вычислите ЭДС этого элемента.
Электролиз
601. Через две электролитические ячейки, соединённые последовательно, пропускался электрический ток, который выделил на катоде первой ячейки медь массой 19,5 г из раствора CuSO4. Найдите массу цинка, который выделится при этом на катоде второй ячейки, если его выход по току составляет 60 %.
602. При электролизе одного из соединений олова ток силой в 10 А за 3 мин выделил на электродах металл массой 0,554 г и хлор объёмом 209 мл (н.у.). Определите формулу этого соединения.
603. Вычислите время, в течение которого должен быть пропущен ток силой 0,5 А через раствор серебряной соли, чтобы покрыть металлическую пластинку слоем серебра толщиной 0,02 мм, если общая площадь поверхности пластинки 500 см2, а выход по току 95,5 % (плотность серебра 10,5 г/см3).
604. Деталь была оцинкована за 1 ч 40 мин. Электролит – раствор сульфата цинка. Вес металлического покрытия (т.е. Zn) составляет 7,8456 г. Выход по току – 77,2 %. Чему была равна сила тока?
605. Деталь подверглась марганцеванию. Электролит – раствор MnSО4. Сила тока – 5 А. Вычислите выход металлического покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
606. Электрический ток силой 6 А в течение 1 ч 14 мин 24 с осадил на катоде 8,14 г металла из химического соединения, в котором он двухвалентен. Чему равна атомная масса металла и какой это металл?
607. Ток силой 4 А пропускали через электролизер в течение 16 мин 5 с. За это время на катоде выделился свинец массой 4,14 г из расплава одного из его соединений. Было ли это соединение двух- или четырехвалентного свинца?
608. Сколько времени следует пропускать ток силой 5 А через раствор NaCl для получения 20 г NaOH? (Дайте полную схему электролиза раствора хлорида натрия с применением графитовых электродов.)
609. Никелевые электроды погружены в 1 М раствор NiSO4. В результате электролиза через 1 ч масса одного из электродов уменьшилась на 1,00 г. Чему равна сила тока? Напишите уравнение реакций.
610. Какую массу алюминия можно получить при электролизе расплава Al2O3, если в течение 1 ч пропускать ток силой 20 А при выходе по току 85 %? Напишите уравнение реакций.
611. Опишите процессы, протекающие на катоде и аноде при электролизе водного раствора сульфата никеля с концентрацией ионов никеля 0,1 моль/л при рН = 4 на графитовых электродах.
612. Деталь хромируется в водном растворе Cr2(SO4)3. Сила тока – 3 А. Определите продолжительность электролиза, если на поверхность детали необходимо нанести электрокристаллизацией 1,3 г хрома. Выход по току принять равным 40 %.
613. Для получения 1 м3 хлора при электролизе водного раствора хлорида магния было пропущено через раствор 2423 А · ч электричества. Вычислите выход по току. (Дайте полную схему электролиза раствора хлорида магния с применением графитовых электродов.)
614. Найдите толщину выделившегося при электролизе на железной проволоке слоя олова (плотность олова 7298 кг/м3), если длина проволоки 2 м, а её диаметр 0,0004 м. Ток силой 2,5 А в течение 30 мин пропускали через раствор SnCl2. Выход по току равен 93 %.
615. При электролизе раствора нитрата серебра в течение 50 мин при силе тока 3А на катоде выделилось 9,6 г серебра. Определите выход серебра в процентах от теоретического значения.
616. Через последовательно включенные в цепь постоянного тока растворы AgNO3 и CuSO4 пропускался ток силой в 5 А в течение 10 мин. Какая масса каждого металла выделится при этом на катодах?
617. При электролизе раствора соли трехвалентного металла при силе тока 2 А в течение 1 ч на катоде выделилось 2,57 г металла. Вычислите его атомную массу, если коэффициент выхода по току составил 0,9.
618. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла.
619. Определите процентное содержание индифферентных примесей в образце медного купороса, если после растворения его навески массой 0,4556 г в азотной кислоте и электролиза полученного раствора на платиновом катоде выделено 0,1145 г чистой меди.
620. Навеску сплава массой 0,5 г обработали и получили сульфатно-аммиачный раствор, из которого электролизом при постоянной силе тока 0,5 А на платиновом катоде полностью выделилось 0,0941 г никеля за 12 мин. Определите процентное содержание никеля в сплаве, относительную погрешность определения и выход по току.
621. Определите толщину слоя цинка, выделившегося в течение 30 мин на железном катоде площадью 800 см2 при электролизе раствора ZnCl2 силой тока, равной 2,5 А. Коэффициент выхода по току составил 0,8. Плотность цинка равна 7,15 г/см3.
622. При пропускании через раствор электролита 2 А · ч электричества на аноде окислилось 1,196 г сульфид-иона. Определите электрохимический и химический эквивалент серы.
623. Оцинкование детали проводили в растворе сульфата цинка в течение 1 ч 15 мин 32 с, вес покрытия составил 7,5467 г, выход по току 72,5 %. Чему была равна сила тока?
624. Определите время, теоретически необходимое для полного выделения на катоде кадмия из 20 см3 раствора сульфата кадмия концентрацией 0,0622 моль/дм3, если электролиз проводился при силе тока 0,1 А и выход по току составил 80 %.
625. При электролизе водного раствора NiSO4 на аноде выделилось 3,8 л кислорода, измеренного при температуре 27 °C и давлении 100 кПа. Сколько граммов никеля выделилось на катоде?
626. Железный предмет общей площадью 0,08 м2 помещен в качестве катода в раствор соли никеля. Какова толщина отложившегося слоя никеля? Плотность никеля – 8900 кг/м3. Ток силой 3,15 А пропускали в течение 42 мин.
627. При какой силе тока можно из водного раствора NaOH выделить 6 л кислорода в течение 3 ч? Газ измерен при температуре 17 °C и давлении 98 кПа.
628. Электролизом раствора сульфата цинка на катоде за время 786 с осаждено 0,12 г цинка. Какую силу тока поддерживали при электролизе, если выход по току составил 90 %?
629. Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропустить ток силой 1,8 А в течение 1,5 ч. Вычислите молярную массу эквивалента металла. Определите какой был взят металл, если валентность металла равна трем.
630. В водный раствор, содержащий по 1 моль/л ионов Al3+, Fe2+, Mg2+, погрузили платиновые электроды и начали медленно увеличивать напряжение. После начала выделения одного из металлов напряжение поддерживалось постоянным. Какой металл и в каком количестве выделился на катоде за 30 мин при силе тока, равной 2А?
Коррозия металлов
631. Вычислите ЭДС коррозионного элемента, наблюдаемого при контакте магния с железом в чистой воде, если наблюдается водородная деполяризация.
632. Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во внешней атмосфере. Приведите уравнения протекающих процессов.
633. Изделие из хрома покрыли цинком. Какое это покрытие – катодное или анодное? Почему? Составьте уравнения катодного и анодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии при этом образуются?
634. Как происходит атмосферная коррозия хромированного марганца при нарушении покрытия? Составьте уравнения катодного и анодного процессов.
635. Рассмотрите коррозию изделия из алюминиевой бронзы:
а) в дистиллированной воде; б) в сильно щелочной среде.
Приведите уравнения электродных процессов. Какие вещества являются продуктами коррозии?
636. Какой из металлов (Zn, Mg, Cr) целесообразно выбрать для протекторной защиты от атмосферной коррозии свинцовой оболочки кабеля? Ответ аргументируйте. Приведите уравнения электродных процессов. Каков состав продуктов коррозии?
637. Две железные пластинки, одна из которых частично покрыта оловом, другая медью, находятся во влажном воздухе. На какой из них быстрее появится ржавчина? Ответ обоснуйте. Приведите уравнения электродных процессов и состав продуктов коррозии.
638. Составьте уравнение электродных процессов, происходящих при коррозии луженого железа и луженой меди во влажной атмосфере в случае нарушения герметичности покрытий. Ответ аргументируйте.
639. Рассмотрите коррозию изделия из латуни (сплав Cu-Zn) в морской воде. Приведите уравнения электродных процессов и схему коррозионного микрогальванического элемента. Какие вещества являются продуктами коррозии?
640. В раствор соляной кислоты погружены две одинаковые никелевые пластинки, одна из которых частично покрыта цинком. В каком случае процесс коррозии никеля протекает интенсивнее? Ответ мотивируйте. Составьте уравнения соответствующих процессов.
641. Для транспортирования концентрированной серной кислоты применяют железные бочки, но после освобождения от кислоты бочки часто разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом, катодом? Составьте электронные уравнения соответствующих процессов.
642. Гальванический элемент
(–) Cr|Cr3+|H2SO4|(Pb) H2(+),
образовавшийся при коррозии хрома, спаянного со свинцом, дает ток силой 6 А. Какая масса хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?
643. Как происходит коррозия железа, покрытого:
а) никелем; б) цинком в кислотном растворе?
Составьте электронные уравнения анодного и катодного процессов при коррозии этих металлов.
644. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент
(–)Sn |Sn2+ |HCl| (Cu)H2 (+),
который дает ток силой 7,5 А. Какая масса олова растворится и сколько литров водорода выделится на медном катоде за 25 мин?
645. Составьте электродные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
646. При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент
(–)Fe|Fe2+(0,1M)|HCl(1н)|(Cd)H2 (+).
Как изменится ЭДС гальванического элемента, если концентрация иона Fe2+ возрастет до 0,15 моль/л.
647. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере влажного воздуха? Составьте схему процессов, происходящих на электродах.
648. При коррозии бериллиевой пластины весом 350 г и поверхностью 165 мм, на воздухе прокорродировало 10 % от массы бериллия в течение трех суток. Вычислите объемный показатель коррозии, считая, что продуктом коррозии является оксид бериллия, а внешние условия нормальными.
649. Найдите объемный показатель коррозии, если в результате коррозии железного листа с размерами 10 × 25 × 2 мм выделилось 2,7 см3 водорода (н.у.) за 18 мин.
650. Найдите объем водорода, который выделится при коррозии железной пластинки в 0,5 М растворе серной кислоты, если в течение 1 ч масса пластинки уменьшилась на 0,01 г. Физические условия в лаборатории: Т = 22 °С, Р = 1,01 атм.
651. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения катодного и анодного процессов.
652. Цинк и медь корродируют в морской воде со скоростью 1 г/(м2 · сут). Определите скорость коррозии в мм/год, если
ρZn = 7130 кг/м3, ρCu = 8920 кг/м3.
653. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Рассчитайте ЭДС и энергию Гиббса образующегося гальванического элемента.
654. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в нейтральную среду с рН = 7? Подсчитайте ЭДС коррозионного элемента для стандартного состояния. При каких значениях рН прекратится процесс выделения водорода?
655. Возможна ли электрохимическая коррозия олова в водном растворе при рН = 6 при контакте с воздухом? Напишите электронные уравнения анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода (Е°Sn/Sn2+ = –0,136 В)?
656. Вычислите ЭДС коррозионного элемента, наблюдаемого при контакте кобальта с оловом в 0,1 М растворе серной кислоты. Составьте электронные уравнения анодного и катодного процессов при работе такого коррозионного элемента.
657. Вычислите ЭДС коррозионного элемента, составленного из золотого электрода в 0,1 М растворе хлорида золота (III) и алюминиевого электрода в 0,02 н растворе хлорида алюминия.
658. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
659. Исходя из энергии Гиббса, определите, какие из приведенных металлов (Mg, Cu, Au) будут коррозировать во влажном воздухе по уравнению
Me + H2O + 1/2 O2 = Me(OH)2?
660. Найдите объем водорода, который выделится при коррозии железной пластинки в 0,01 М растворе серной кислоты, если в течение 10 мин масса пластинки уменьшилась на 0,003 г. Физические условия в лаборатории: Т = 25 °С, Р = 0,97 атм.
Жесткость воды
661. Определите массы реагентов, требуемых для полного умягчения воды, если природная вода имеет следующие показатели жесткости (ммоль·экв/л): ЖК=3,3; ЖНК=2,2. Объём воды 5 л. Солевой состав воды Са(НСО3)2 и MgCl2.
662. Рассчитайте общую жесткость воды (ммоль·экв/л), если в 250 мл воды содержится 14,2 мг гидрокарбоната магния, 8,12 мг хлорида кальция и 4,5 мг хлорида магния.
663. К 90 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько ммоль понизилась карбонатная жесткость этой воды?
664. Растворимость сульфата кальция в воде при 20°C равна 0,202 г на 100 г раствора. Плотность насыщенного раствора сульфата кальция равна 1000 кг/м3. Вычислите жесткость этого раствора.
665. Определите, чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,225 г гидрокарбоната кальция?
666. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом кальция, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1 н. раствора соляной кислоты.
667. При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 3,5 мг. Чему равна жесткость этой воды?
668. Сколько граммов гидроксида кальция необходимо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2,86 ммоль·экв/л?
669. Образец воды объемом 1 л содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество катионов Ca2+ и Mg2+ содержится в этом образце воды? Определите, чему равна общая жесткость воды.
670. Анализ воды показал, что в ней содержится гидрокарбонат кальция массой 1386 мг, хлорид кальция массой 610 мг. Объём воды составил 5 л. Определите общую, карбонатную и некарбонатную жесткость воды, солесодержание (г/л).
671. Общая жесткость волжской воды равна 6,52 ммоль·экв/л, а временная 3,32 ммоль·экв/л. Какую массу гидроксида кальция и карбоната натрия необходимо взять, чтобы устранить жесткость 5 л воды?
672. Вычислите карбонатную жесткость воды, зная, что на реакцию с гидрокарбонатом кальция, содержащимся в воде объемом 200 мл, потребовалось 25 мл 0,1 н. раствора соляной кислоты.
673. Жесткость некоторого образца воды обусловливается только гидрокарбонатом железа. При кипячении 0,25 л воды в осадок выпадает 4 мг карбоната железа (II). Определите жесткость воды.
674. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавили 8,2 г гидроксида кальция и 4,3 г карбоната натрия. Рассчитайте временную и постоянную жесткость воды.
675. На умягчение 10 л воды израсходовано Ca(OH)2 массой 3,7 г и Na2CO3 массой 1,06 г. Рассчитайте общую жесткость ЖОб исходной воды. Составьте уравнения процессов умягчения.
676. При термическом умягчении 10 л воды, содержащей гидрокарбонат кальция, образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жесткость воды ЖОб составляла 5,5 ммоль·экв/л. Составьте уравнения процессов умягчения.
677. В 4 м3 воды содержатся Ca(HCO3)2 массой 648 г и CaCl2 массой 1335 г. Определите жесткость, солесодержание и рН воды.
678. Определите, сколько мл 0,1 н. раствора трилона Б и 0,05 н. раствора HCl израсходовано при определении жесткости воды методом комплексонометрии, если объем пробы воды равен 100 мл. Результаты анализа: общая жесткость ЖОб = 2,5 ммоль·экв/л, карбонатная жесткость ЖК = 2 ммоль·экв/л.
679. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей следующие величины жесткости: ЖК = 4ммоль·экв/л, ЖОб = 5 ммоль·экв/л. Составьте уравнения процессов умягчения.
680. На умягчение 150 л воды израсходовано Ca(OH)2 массой 5,57 г и Na2CO3 массой 26,6 г. Рассчитайте общую жесткость ЖОб исходной воды. Составьте уравнения процессов умягчения.
681. При термическом умягчении 20 л воды, содержащей гидрокарбонат магния, образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жесткость воды ЖОб составляла 3,5 ммоль·экв/л. Составьте уравнения процессов умягчения.
682. Определите, сколько соды нужно для смягчения 10 л воды, содержащей 15 мг-экв/л ионов кальция? Составьте уравнения процессов умягчения.
683. Минеральная вода “Нарзан” содержит 0,3894 г/л кальция и 0,0884 г/л магния. Определите общую жесткость этой воды?
684. В 2 л воды содержится 3 г бикарбоната кальция, 0,29 г бикарбоната магния и 1,4 г сульфата кальция. Сколько натриевого мыла (соли стеариновой кислоты) будет перерасходовано за счет жесткости при использовании 1000 л воды? Образование кальциевого (или магниевого) мыла протекает по реакции:
2С17Н35СООNa+Ca(HCO3)2 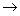 (С17Н35СОО)2Са+2NaHCO3
(С17Н35СОО)2Са+2NaHCO3
685. Общая жесткость воды, обусловленная присутствием в ней ионов Ca2+, HCO3˗, Cl-, составляет 10 ммоль·экв/л. Рассчитайте их концентрацию в г/л, если карбонатная жесткость воды равна 2 ммоль·экв/л.
686. Какой объем воды можно умягчить 10 м3 катионита с рабочей обменной емкостью, равной 220 ммоль·экв/л, если жесткость воды составляет 6,1 ммоль·экв/л.
687. Вычислите общую, карбонатную и некарбонатную жесткость воды, если на титрование двух ее проб по 100 мл каждая израсходовано на первую 8,2 мл 0,05 н раствора трилона Б, на вторую 2,8 мл 0,1 н раствора HCl.
688. Через ионообменный фильтр пропущено 200 л воды, при этом ее жесткость, обусловленная присутствием в ней ионов Ca2+, уменьшилась на 2,5 ммоль·экв/л и составила 0,2 ммоль·экв/л. Рассчитайте начальную жесткость воды, а также массу ионов кальция, задержанных фильтром.
689. При перегонке 2 л воды ее масса уменьшилась на 201,7 мг. Чему равна ее жесткость, если она обусловлена наличием в ней гидрокарбоната кальция? Приведите уравнение процесса, протекающего при перегонке.
690. Вычислите общую, карбонатную и некарбонатную жесткость воды, в 10 л которой содержится 0,41 г Ca(HCO3)2 и 0,91 г MgSO4. Составьте уравнения процессов умягчения.
Элементы органической химии
691. При взаимодействии 1,04 г смеси формальдегида и ацетальдегида с избытком аммиачного раствора оксида серебра образовалось 10,8 г металла. Какой была масса формальдегида в смеси?
692. Установите формулу соединения, при сжигании 2,40 г которого было получено 1,44 г воды, 896 мл углекислого газа и 1,12 г азота.
693. При взаимодействии 22 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
694. При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
695. Некоторый сложный эфир массой 7,4 г подвергнут щелочному гидролизу. При этом получено 9,8 г калиевой соли предельной одноосновной кислоты и 3,2 г спирта. Установите молекулярную формулу эфира.
696. При полном сгорании углеводорода образовалось 27 г воды и 33,6 л диоксида углерода (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу.
697. При полном сжигании вещества, не содержащего кислорода, образуется азот и вода. Относительная плотность паров этого вещества по водороду равна 16. Объём необходимого на сжигание кислорода равен объёму выделившегося азота. Определите общую формулу соединения и истинную формулу вещества.
698. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
699. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
700. При пропускании смеси пропана и ацетилена через раствор бромной воды масса раствора увеличилась на 1,3 г. При сгорании такой же смеси выделилось 14 л (н.у.) оксида углерода (IV). Определить массовую долю пропана в смеси.
701. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
702. При взаимодействии одного и того же количества алкена с галогенами образуется соответственно 11,3 г дихлорпроизводного или 20,2 г дибромпроизводного. Определите молекулярную формулу алкена, запишите его название и структурную формулу.
703. При взаимодействии первичного одноатомного спирта, содержащего 60 % углерода и 13,3 % водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна 58. Определите молекулярную формулу каждого из веществ, участвующих в реакции, и дайте им названия.
704. Масса неизвестного объёма воздуха равна 0,123 г, а масса такого же объёма газообразного алкана 0,246 г (при одинаковых условиях). Определите молекулярную формулу алкана.
705. Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.
706. Установите молекулярную формулу алкена, не имеющего геометрических изомеров, если известно, что 1,5 г его способны присоединить 0,6 л (н.у.) водорода. Запишите названия алкенов, удовлетворяющих условию задачи.
707. При сгорании в кислороде образца предельного одноатомного спирта количеством вещества 2,5 моль образовалось 224 л углекислого газа. Установите формулу спирта.
708. В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н.у.) газа. Определите молекулярную формулу исходного спирта.
709. Органическое вещество массой 1,875 г занимает объём 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г диоксида углерода и 5,4 г воды. Определим молекулярную формулу вещества.
710. При взаимодействии 1,48 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 224 мл этилена (н.у.). Определите молекулярную формулу спирта.
711. Образец алкена поглотили избытком раствора брома в ССl4. При этом массовая доля углерода в исходном алкене оказалась в 2,9 раза больше, чем в дибромалкане. Установите брутто-формулу исходного соединения.
712. Определите объем (н.у.) метиламина, который способен прореагировать с 500 г 9,8 %-ного раствора серной кислоты с образованием средней соли.
713. К смеси метанола и этанола массой 50 г прибавили избыток натрия, при этом выделилось 12,6 л водорода (н.у.). Определите массы спиртов в исходной смеси.
714. Напишите структурную формулу предельного амина, если известно, что при сгорании 2,36 г его образовалось 5,28 г углекислого газа и 0,448 л азота (н.у.). Относительная плотность его паров по водороду равна 29,5.
715. Какой объём 96 %-ного этилового спирта (плотностью 800 кг/м3) потребуется для этерификации 1,5 г аминоуксусной кислоты, если спирт в реакцию необходимо брать с двукратным избытком?
716. Вычислите, какой объём воздуха (н.у.) потребуется для сжигания 268,8 л метиламина. Хватит ли полученного при этом азота для получения 170 г аммиака? Ответ подтвердите расчетом.
717. К раствору анилина массой 500 г добавили избыток брома. Масса выпавшего осадка составила 3,3 г. Вычислите массовую долю (в %) анилина в исходном растворе.
718. При нагревании 1,36 г технического ацетата натрия с избытком разбавленной серной кислоты получили 0,6 г уксусной кислоты. Вычислите массовую долю (в %) примесей в техническом образце ацетата натрия.
719. Вычислите, сколько литров кислорода (н.у.) потребуется для полного сгорания 25 г этилового спирта. Какой объём 5,5 %-ного раствора гидроксида калия (плотность 1,05 г/мл) можно нейтрализовать при этом углекислым газом, считая, что образуется средняя соль?
720. При действии натрия на 13,8 г смеси этилового спирта и одноосновной органической кислоты выделяется 3,36 л газа, а при действии на ту же смесь насыщенного раствора питьевой соды – 1,12 л газа. Определите массовую долю (в %) каждого компонента в смеси и строение органической кислоты.
П р и л о ж е н и е 1
Константы диссоциации некоторых электролитов в водных растворах (при температуре 298 К)
| Электролит | КД | Электролит | КД |
| HNO2 | K = 4,6·10-4 | NH4OH | K =1,8·10-5 |
| HAlO2 | K = 6·10-13 | H2O | K =1,8·10-16 |
| H3BO3 | К1 = 5,8·10-10 К2 = 1,8·10-13 К3 = 1,6·10-14 | Al(OH)3 | К1 = 7,41 ·10-9 К2 = 2,14 ·10-9 К3 = 1,38 ·10-9 |
| HBrO | K = 2,1 ·10-9 | Fe(OH)2 | К1 = 5,5 ·10-8 К2 = 1,2 ·10-2 |
| H2SiO3 | К1 = 2,2·10-10 К2 = 1,6·10-12 | Fe(OH)3 | К1 = 4,79 ·10-11 К2 = 1,82·10-11 К3 = 1,48 ·10-12 |
| HCOOH | K =1,8·10-4 | Cu(OH)2 | К1 = 2,19 ·10-7 К2 = 6,61 ·10-8 |
| H2Se | К1 = 1,7·10-4 К2 = 1·10-11 | Ni(OH)2 | К2 = 2,5·10-5 |
| H2SO3 | К1 = 1,7·10-2 К2 = 6,3·10-8 | AgOH | K =1,1 ·10-4 |
| H2S | К1 = 5,7·10-8 К2 = 1,2·10-15 | Pb(OH)2 | К1 = 9,6·10-4 К2 = 3 ·10-8 |
| H2TeO3 | К1 = 3 ·10-3 К2 = 2 ·10-8 | Cr(OH)3 | К2 = 1,02·10-10 |
| H2Te | К1 = 1 ·10-3 К2 = 1 ·10-11 | Zn(OH)2 | К1 = 4,4 ·10-5 К2 = 1,5 ·10-9 |
| H2CO3 | К1 = 4,5 ·10-7 К2 = 4,8 ·10-11 | Cd(OH)2 | К1 = 8,13 ·10-4 К2 = 4,17 ·10-7 |
| CH3COOH | K =1,8 ·10-5 | Mn(OH)2 | К2 = 5 ·10-4 |
| HClO | K =5 ·10-8 | Со(ОН)2 | К1 = 8,32 ·10-5 К2 = 8,32 ·10-6 |
| H3PO4 | К1 = 7,5 ·10-3 К2 = 6,3 ·10-8 К3 = 1,3 ·10-12 | Sc(OH)3 | К1 = 3,16 ·10-8 К2 = 5,01 ·10-9 К3 = 4,07 ·10-10 |
| HF | K =6,6 ·10-4 | Th(OH)4 | К4 = 2 ·10-10 |
| HCN | K =7,9 ·10-2 | V(OH)3 | К3 = 8,3 ·10-12 |
| H2C2O4 | К1 = 5,4 ·10-2 К2 = 5,4·10-5 | Ga(OH)3 | К2 = 1,6 ·10-11 К3 = 4 ·10-12 |
| HClO | K1= 3,98 ×10-8 | Sn(OH)2 | К1 = 3,47 ·10-10 К2 = 1,26 ·10-12 |
| H2CrO4 | К1 = 1,8 ·10-1 К2 = 3,24·10-7 | Sn(OH)4 | К1 = 1,66 ·10-13 К2 = 2,14 ·10-14 |
П р и л о ж е н и е 2
Криоскопические ( K ) и эбулиоскопические (Е) константы некоторых растворителей
| Растворитель | К | Е | Растворитель | К | Е |
| Вода | 1,86 | 0,52 | Этиловый спирт | -- | 1,16 |
| Бензол | 5,10 | 2,57 | Ацетон | 2,40 | 1,50 |
| Анилин | 5,87 | 3,69 | Хлороформ | 4,90 | 3,89 |
| Тетрахлорид углерода | 2,98 | 5,02 | Фенол | 7,3 | 3,6 |
| Камфора | 40 | 6,09 | Нитробензол | 6,9 | 5,27 |
П р и л о ж е н и е 3
Дата: 2019-02-25, просмотров: 573.