391. Вычислите ионную силу раствора, в 1 л которого содержится 2,22 г СаСl2 и 0,492 г Ca(NO3)2.
392. Вычислите активную концентрацию 0,005 М раствора Al2(SO4)3. Коэффициенты активности ионов Al3+ и SO 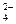 равны, соответственно, 0,285 и 0,495.
равны, соответственно, 0,285 и 0,495.
393. Вычислите концентрацию ионов водорода и степень диссоциации 5 %-ного раствора уксусной кислоты, плотность которого равна 1,004 г/см3.
394. Диссоциация угольной кислоты по первой ступени идет по схеме: Н2СО3 ↔ Н+ + НСО 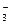 . Концентрация ионов водорода в 0,005 М растворе равна 4,25 · 10-5 моль/л. Определите константу диссоциации кислоты по первой ступени.
. Концентрация ионов водорода в 0,005 М растворе равна 4,25 · 10-5 моль/л. Определите константу диссоциации кислоты по первой ступени.
395. Степень диссоциации уксусной кислоты в 0,1 М растворе равна 1,23 ·10-2. Рассчитайте константу диссоциации кислоты.
396. Вычислите ионную силу раствора, содержащего 0,373 г KCl и 2,116 г Sr (NO3)2 в 250 г Н2О.
397. Вычислите ионную силу раствора «Трисоль», применяемого в медицинской практике, на основании его прописи: натрия хлорид – 0,5 г, калия хлорид – 0,1 г, натрия гидрокарбонат – 0,4 г, вода для инъекций – до 100 мл.
398. Вычислите ионную силу раствора, содержащего 0,85 г нитрата натрия и 8,1 г сульфата меди в 250 г воды.
399. В 1 л 0,01 М раствора уксусной кислоты содержится 6,26 ·1021 её молекул и ионов. Рассчитайте степень диссоциации уксусной кислоты.
400. Определите степень диссоциации муравьиной кислоты в 0,01 н растворе, если в 1 мл раствора содержится 6,82 ·1018 растворенных частиц.
401. Вычислите степень диссоциации сероводородной кислоты по первой ступени в 0,1 М растворе, если константа диссоциации кислоты для этой ступени равна 1,1 ·10-7 .
402. Рассчитайте концентрацию азотистой кислоты в растворе, если концентрация ионов Н+ равна 0,002 моль/дм3.
403. Водный раствор сульфата меди (II) с массовой долей 1 % мас. (ρ = 1,009 г/см3) назначают в малых дозах для улучшения кроветворной функции. Вычислите молярную концентрацию ионов меди в таком растворе, приняв степень диссоциации CuSO4 равной 1.
404. В растворе бензойной кислоты НС7Н5О2 концентрация ионов водорода 3·10-3моль/л. Вычислите концентрацию этого раствора (моль/л и г/л), если КД=6,14·10-5.
405. Вычислите константу диссоциации СН3СООН, если степень ее диссоциации в 13 %-ном растворе равна 1,9 %. Плотность раствора принять равной 1,012 г/см3.
406. Вычислите активность электролита LaCl3 в растворе с концентрацией 0,018 М, приняв средний ионный коэффициент активности f± = 0,57.
407. Вычислите концентрацию ионов водорода и степень диссоциации муравьиной кислоты в растворе, который приготовили путем растворения 20 г кислоты в 500 г воды. Плотность раствора принять равной 0,9978 г/см3.
408. Вычислите ионную силу раствора, содержащего 0,03 моль/дм3 MgCl2 и 0,02 моль/дм3 K2SO4.
409. Определите концентрацию ионов ОН– и степень диссоциации гидроксида аммония в растворе, приготовленном путем растворения 34 л аммиака, измеренного при температуре 22 °С и давлении 1,1 атм, в 1 дм3 воды. Плотность раствора примите равной 1,05 г/см3.
410. Электролит АВ в 0,1 М растворе имеет степень диссоциации, равную 85 %. Вычислите молярную концентрацию ионов А+ и В– в данном растворе.
411. Определите концентрации ионов в 0,01 М растворе NaBr , если i = 1,32 .
412. В 0,1 М растворах степень диссоциации щавелевой кислоты Н2С2О4 равна 31 % ( по I ступени), а соляной кислоты – 92 %. При какой концентрации раствора степень диссоциации щавелевой кислоты по I ступени достигнет значения степени диссоциации соляной кислоты?
413. Рассчитайте степень диссоциации и концентрацию ионов водорода в 0,1 М растворе H2S, полагая, что кислота диссоциирует только по первой ступени.
414. Вычислите активность Sr(NO3)2 в растворе, содержащем 3,17 г соли в 500 г воды, ели средний ионный коэффициент активности данного электролита f± = 0,59.
415. 1 дм3 раствора содержит по 0,01 моль AlCl3 и MgSO4. Рассчитайте ионную силу раствора.
416. Найдите степень диссоциации и концентрацию ионов водорода в 10 %-ном растворе уксусной кислоты, плотность которого равна 1,01 г/см3.
417. Вычислите ионную силу раствора, содержащего 0,085 г NaNO3 и 7,98 г CuSO4 в 200 г воды.
418. В воде растворили 0,35 моль электролита АВ. В растворе образовалось 0,014 моль катионов А+. Вычислите степень диссоциации электролита АВ в данном растворе.
419. Степень диссоциации электролита АВ2 в 0,1 М растворе равна 60 %. Рассчитать молярную концентрацию ионов А2+ и В – в этом растворе.
420. Определите концентрацию ионов Н+ в растворе, приготовленном путем растворения 10 л хлороводорода, измеренного при температуре 22 °С и давлении 1,1 атм, в 1 дм3 воды. Плотность раствора примите равной 1,01 г/см3, а степень диссоциации электролита a = 1.
Дата: 2019-02-25, просмотров: 467.