ФГБОУ ВО
«ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Инженерно-технический институт

Кафедра химических технологий
ХИМИЯ
Контрольные задания для студентов заочной формы обучения
Часть 2
Учебно-методическое пособие
ЧЕРЕПОВЕЦ
2018
Рассмотрено на заседании кафедры химии, протокол № 2 от __.___.18 г.
Одобрено редакционно-издательской комиссией ЧГУ, протокол № __ от ___.___.18 г.
Составители: О.А. Калько, канд. техн. наук, доцент; Ю.С. Кузнецова
Рецензенты: В.В.Ермилов, канд. техн. наук, доцент (ЧГУ);
А.В. Артамонов, канд. техн. наук, доцент (ЧГУ)
Научный редактор: К.В. Аксенчик, канд. техн. наук, доцент (ЧГУ)
© Калько О.А., Кузнецова Ю.С., 2018
 © ФГБОУ «Череповецкий государственный университет», 201
© ФГБОУ «Череповецкий государственный университет», 201  8
8
Введение
Данное учебно-методическое пособие содержит задачи по следующим темам дисциплины «Химия»: «Растворы. Дисперсные системы», «Окислительно-восстановительные реакции», «Электрохимические процессы», «Коррозия металлов», «Жесткость воды», «Элементы органической химии».
Пособие предназначено для студентов инженерно-технических направлений подготовки, обучающихся по заочной форме обучения, в качестве учебно-методического пособия, содержащего формулировки заданий для выполнения семестровой контрольной работы. Пособие также может использоваться преподавателями при составлении контрольно-измерительных материалов рейтинговой системы обучения студентов дневной формы обучения.
Произведение растворимости
451. Произведение растворимости PbCl2 равно 1,7 · 10-5. Чему равна концентрация ионов свинца в насыщенном растворе PbCl2?
452. Произведение растворимости CaSO4 равно 6 ·10-5. Выпадет ли осадок CaSO4, если смешать равные объемы 0,2 н растворов CaCl2 и Na2SO4? Степень диссоциации этих электролитов принять равной единице. Ответ подтвердите расчетами.
453. Насыщенный при комнатной температуре раствор PbSO4 объемом 3 дм3 содержит 0,132 г соли. Вычислите ПР(PbSO4).
454. Выпадет ли осадок Ag2CrO4 при сливании 0,5 л раствора, содержащего 0,1 моль/дм3 Ag+, и 0,5 л раствора, содержащего 0,01 моль/дм3 CrO42-, если ПР(Ag2CrO4) = 1,1 · 10-12? Ответ подтвердите расчетами.
455. Рассчитайте растворимость фторида кальция в воде, если его произведение растворимости составляет 4 · 10-11.
456. Выпадет ли осадок йодида свинца (II) при температуре 25 °C после сливания 100 см3 0,005 М раствора нитрата свинца (II) и 200 мл 0,01 М раствора йодида калия, если ПР(PbI2) = 8,7 × × 10-9? Ответ подтвердите расчетами.
457. Выпадет ли осадок при смешивании 200 мл раствора с концентрацией сульфата цинка 0,02 моль/л с 600 мл раствора с концентрацией сульфида натрия 0,008 моль/л? Ответ подтвердите расчетами.
458. С помощью расчетов докажите, что осадок не образуется при смешивании насыщенного раствора сульфата кальция с равным объёмом раствора с концентрацией хлорида стронция, равной 0,00001 моль/л.
459. Рассчитайте равновесную молярную концентрацию (моль/л) анионов в насыщенном растворе карбоната серебра (I) при температуре 25 °C, если ПР = 8,7 · 10-12.
460. Рассчитайте значение ПР гидроксида металла Ме(ОН)2, если рН его насыщенного раствора равен 9,54 при температуре 25 °C.
461. Выпадет ли осадок после сливания равных объёмов 0,0023 М растворов нитрата серебра и бромида калия при температуре 25 °C, если ПР(AgBr) = 6,3 · 10-13? Ответ подтвердите расчетами.
462. Выпадет ли осадок после сливания 5 мл 0,004 М хлорида кадмия и 15 мл 0,003 М раствора гидроксида натрия при 25 °C, если ПР(Сd(ОН)2) = 2 · 10-14? Ответ подтвердите расчетами.
463. Насыщенный раствор AgIO3 объёмом 3 дм3 содержит в виде ионов 0,176 г серебра. Вычислите произведение растворимости AgIO3.
464. Произведение растворимости сульфида магния равно 2 · 10-15. Выпадет ли осадок сульфида магния, если смешать равные объёмы 0,004 н раствора нитрата магния и 0,0006 н раствора сульфида натрия (α =1)? Ответ подтвердите расчетами.
465. Сколько воды потребуется для растворения 1 г СаС2О4 при комнатной температуре, если его ПР = 2,6 · 10-9?
466. Образование малорастворимых соединений используют в гидрометаллургии при выделении веществ из растворов. Величина произведения растворимости характеризует полноту выделения вещества в осадок. Вычислите концентрацию ионов Mg2+ в насыщенном растворе Mg(OH)2, если ПР данного основания равно 3,2 × 10-11.
467. Найдите произведение растворимости Со(ОН)2, если рН насыщенного раствора гидроксида кобальта (II) равен 8,9.
468. В гидрометаллургии и аналитической практике в целях более полного выделения соединения из раствора используют избыток осадителя. Вычислите концентрацию ионов Ca2+ в насыщенном растворе карбоната кальция, если ПР(СаСО3) =
= 4,8 ×10-9, а концентрация осадителя равна 0,01 моль/л.
469. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
BaCO3 + Na2SO4 Û BaSO4 + Na2CO3?
470. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
CaCO3 + Na2SO4 Û CaSO4 + Na2CO3?
471. Пользуясь произведением растворимости гидроксида магния, определите рН его насыщенного раствора.
472. Вычислите рН насыщенного раствора гидроксида никеля (II).
473. Чему равен рН насыщенного раствора гидроксида алюминия?
474. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
PbCO3 + Na2SO4 Û PbSO4 + Na2CO3?
475. Учитывая величины произведения растворимости веществ, укажите, в каком направлении протекает реакция
Ag2CO3 + Na2SO4 Û Ag2SO4 + Na2CO3?
476. Сколько воды потребуется для растворения 1 г Ag2CO3при комнатной температуре?
477. Вычислите концентрацию ионов Ni2+ в насыщенном растворе Ni(OH)2,
478. Определите массу AgIO3, которая содержится в 3 дм3 его насыщенного раствора.
479. Вычислите концентрацию ионов Pb2+ в насыщенном растворе карбоната свинца, если концентрация осадителя (Na2CO3) равна 0,01 моль/л.
480. Вычислите концентрацию ионов Hg2+ в насыщенном растворе йодида ртути (II), если концентрация осадителя (KI) равна 0,015 моль/л.
Гидролиз солей
481. Составьте уравнение гидролиза солей в молекулярном и молекулярно-ионном виде: K2SO3, Fe2(SO4)3. Укажите рН среды для этих солей.
482. Составьте уравнение гидролиза солей в молекулярном и молекулярно-ионном виде: Al2S3, CH3COONa. Укажите рН среды для этих солей.
483. Какую реакцию среды будут иметь растворы приведенных солей? Подтвердите это соответствующими уравнениями гидролиза: а) NaNO2; б) CoCl2; в) Ba(NO2)2.
484. При смешивании растворов Al(HSO4)3 и K2S в осадок выпадает Al(OH)3. Укажите причину этого и составьте соответствующие молекулярные и ионно-молекулярные уравнения.
485. Какую реакцию среды (кислую, щелочную или нейтральную) должны иметь растворы следующих солей: NH4CN, K2CO3? Ответ подтвердите соответствующими молекулярными и молекулярно-ионными уравнениями.
486. Какую реакцию среды (кислую, щелочную или нейтральную) должны иметь растворы следующих солей: Al(NO3)3, ZnSO4, Li2S? Ответ подтвердите соответствующими молекулярными и молекулярно-ионными уравнениями.
487. Вычислите константу гидролиза хлорида аммония, определите степень гидролиза этой соли в 0,001 М растворе и рН раствора.
488. Определите степень гидролиза и рН 0,005Н раствора KCN, если Кгидролиза(KCN) = 4,9 · 10-10.
489. Вычислите константу гидролиза, степень гидролиза и рН 0,02 М раствора СН3СООNa.
490. Гидролиз раствора FeCl3 при нагревании идет ступенчато и заканчивается образованием осадка Fe(OH)3. Представьте уравнениями все три ступени этого процесса.
491. Составьте молекулярные и ионные уравнения гидролиза солей CaS, Na2SiO3. Укажите рН среды (> 7, < 7 или = 7).
492. Составьте молекулярные и ионные уравнения гидролиза солей CrCl3, Fe2(SO4)3. Укажите рН среды (> 7, < 7 или = 7).
493. При смешивании растворов CrCl3 и (NH4)2S гидролиз обеих солей доходит до конца. Составьте ионные и молекулярные уравнения реакции гидролиза обеих солей при их смешивании.
494. В какую сторону сместится равновесие гидролиза KCN, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнение гидролиза в молекулярном и ионном виде.
495. Водородный показатель 0,003 н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли.
496. Составьте ионное и молекулярное уравнения реакции гидролиза NH4CN и рассчитайте константу гидролиза соли.
497. Составьте ионное и молекулярное уравнения реакции гидролиза NH4ClO и рассчитайте константу гидролиза соли.
498. Составьте ионное и молекулярное уравнения реакции гидролиза CH3COONH4, и рассчитайте константу гидролиза соли.
499. Рассчитайте рН 0,5 М раствора хлорида алюминия, учитывая только 1-ю ступень гидролиза (Кгидролиза = 1,38 · 10-9).
500. Почему при введении в раствор FeCl3 раствора соды в осадок выпадает не карбонат железа, а его гидроксид? Напишите уравнения процессов.
501. Водный раствор цианида натрия применяют в металлургии золота и серебра. Как отразится на равновесии гидролиза цианида натрия прибавление: а) раствора щелочи; б) раствора кислоты; в) NH4Cl?
502. Составьте молекулярные и ионные уравнения реакций, протекающих при нейтрализации раствором карбоната натрия раствора AlCl3, который получают при солянокислом травлении металлов.
503. Составьте молекулярные и ионные уравнения реакций, протекающих при нейтрализации раствором карбоната натрия раствора CrCl3, который получают при солянокислом травлении металлов.
504. Укажите реакцию среды растворов, образующихся при разбавлении водой травильных растворов, содержащих Na3AlO3, Na2ZnO2, Na2SnO2. Ответ поясните.
505. Приведите три примера солей, в водных растворах которых рН < 7. Составьте молекулярные и ионные уравнения гидролиза этих солей.
506. Приведите три примера солей, в водных растворах которых рН > 7. Составьте молекулярные и ионные уравнения гидролиза этих солей.
507. Приведите три примера солей, в водных растворах которых рН = 7. Составьте молекулярные и ионные уравнения гидролиза этих солей.
508. Напишите уравнение гидролиза и вычислите константу и степень гидролиза 0,2М раствора Na2CO3 по первой ступени.
509. Составьте молекулярные и ионные уравнения гидролиза солей: Na3AsO4; CoSO4; AlCl3. Укажите рН среды для этих солей.
510. Напишите уравнение гидролиза в сокращенном ионном виде и вычислите степени гидролиза по катиону и аниону в 0,5М растворе (NH4)2S.
Дисперсные системы
511. Коллоидные частицы золя хлорида серебра, образовавшегося при сливании 0,002 М раствора хлорида хрома (III) и 300 мл 0,002 М раствора нитрата серебра, в электрическом поле двигаются к аноду. Определите минимально необходимый объем раствора хлорида хрома (III).
512. Установите, какой ион является потенциал определяющим для золя, образовавшегося при сливании 100 мл 0,004М раствора йодида магния и 100 мл 0,005 М раствора нитрата серебра.
513. Напишите формулу мицеллы золя As2S3, стабилизированного Н2S. Как заряжены частицы золя и к какому электроду (аноду или катоду) они двигаются в электрическом поле?
514. Составьте формулу мицеллы золя Аl(OH)3, стабилизированного AlCl3. Как заряжены частицы золя и к какому электроду (аноду или катоду) они двигаются в электрическом поле?
514. К какому электроду (аноду или катоду) будет двигаться коллоидная частица, полученная путем сливания 100 мл 0,030 %-ного раствора AgNO3 (плотность раствора равна 1,001 г/мл) и 100 мл 0,0022 М раствора KI. Ответ поясните расчетами.
515. Запишите реакцию образования золя сульфата бария, который возникает при сливании растворов хлорида бария и сульфата калия (в избытке). Укажите, какие ионы будут обладать наименьшим порогом коагуляции (приведите примеры).
516. Коллоидные частицы (гранулы) золя йодида серебра, образовавшегося при сливании 0,001 М раствора йодида алюминия и 150 мл 0,004 М раствора нитрата серебра, в электрическом поле двигаются к катоду. Определите величину объема (мл), которую не должен превышать раствор йодида алюминия.
517. Коллоидные частицы (гранулы) золя бромида серебра, образовавшегося при сливании 0,001 М раствора бромида магния и 100 мл 0,002 М раствора нитрата серебра, в электрическом поле двигаются к катоду. Определите величину объема (мл), которую не должен превышать раствор бромида магния.
518. Золь AgI получен при добавлении 8 мл водного раствора KI концентрацией 0,05 моль/л к 10 мл водного раствора AgNO3 концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя. Как заряжены частицы золя?
519. Золь сернокислого бария получен смешением равных объемов растворов Ва(NО3)2 и Н2SО4. Напишите формулу мицеллы. Одинаковы ли исходные концентрации растворов, если частицы золя перемещаются к аноду?
520. Для получения золя АgCl смешали 10·10-6 м3 0,02 н раствора КCl и 100·10-6 м3 0,05 н раствора AgNO3. Напишите формулу мицеллы этого золя и укажите направление движения частиц при электрофорезе.
521. Золь Сd(ОН)2 получен смешением равных объемов растворов СdCI2 и NaОН. Запишите формулу мицеллы золя. Могут ли быть одинаковыми исходные концентрации электролитов, если коллоидные частицы движутся к катоду?
522. Золь Аs2S3 получен пропусканием сероводорода через разбавленный водный раствор оксида мышьяка (Ш), стабилизатором золя является Н2S. Составьте уравнение реакции образования золя и формулу мицеллы. Каков знак заряда коллоидных частиц?
523. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и NaОН. Напишите формулу мицеллы золя. Могут ли быть одинаковыми исходные концентрации электролитов, если при электрофорезе частицы движутся к катоду?
524. Золь Fe(OH)3 получен методом гидролиза FeCl3. Напишите формулу мицеллы, если считать, что стабилизатором золя является раствор оксихлорида железа. Укажите заряд коолоидных частиц.
525. Составьте формулу мицеллы AgI, если в качестве стабилизатора взят нитрат серебра. Каков знак заряда коллоидных частиц?
526. Гидрозоль сернистой ртути получен пропусканием Н2S через водный раствор оксида ртути. Запишите уравнение реакции образования золя и формулу мицеллы, если стабилизатором является Н2S. Каков знак заряда коллоидных частиц?
527. Заряд частицы гидрозоля SiO2 возникает в результате диссоциации кремниевой кислоты, образующейся на поверхности коллоидных частиц при взаимодействии поверхностных молекул SiO2 c H2O. Составьте формулу мицеллы золя. К какому электроду двигается такая частица в электрическом поле.
528. Установите, какой ион является потенциалопределяющим для золя, образовавшегося при сливании 250 мл 0,002 М раствора хлорида хрома (III) и 300 мл 0,002 М раствора нитрата серебра.
529. Установите, какой ион является потенциалопределяющим для золя, образовавшегося при сливании 200 мл 0,001 М раствора йодида алюминия и 150 мл 0,004 М раствора нитрата серебра.
530. К какому электроду (аноду или катоду) будет двигаться коллоидная частица, полученная путем сливания 100 мл 0,030 %-ного раствора AgNO3 (плотность раствора равна 1,002 г/см3) и 100 мл 0,002 М раствора СаI2. Ответ поясните расчетами.
531. Составьте формулу мицеллы AgI, если в качестве стабилизатора взят йодид калия. Каков знак заряда коллоидных частиц?
532. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и KОН. Напишите формулу мицеллы золя. Одинаковы ли исходные концентрации электролитов, если при электрофорезе частицы движутся к аноду?
533. Запишите реакцию образования золя сульфата бария, который возникает при сливании растворов хлорида бария (избыток) и сульфата калия. Укажите, какие ионы будут обладать наименьшим порогом коагуляции (приведите пример).
534. Коллоидные частицы золя хлорида серебра, образовавшегося при сливании 300 мл 0,002 М раствора хлорида хрома (III) и 0,002 М раствора нитрата серебра, в электрическом поле двигаются к катоду. Определите минимально необходимый объем раствора нитрата серебра.
535. Золь кремниевой кислоты был получен при взаимодействии растворов силиката калия и соляной кислоты. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду.
536. Не больше скольки миллилитров 0,008 М раствора нитрата серебра надо прибавить к 0,025 л 0,016 М раствора йодида натрия, чтобы получить отрицательно заряженные частицы золя йодида серебра?
537. Золь гидроксида железа (III) получен смешиванием равных объемов 0,002 н. раствора гидроксида натрия и 0,003 н. раствора сульфата железа (III). Какой знак заряда имеют частицы золя? Составьте формулу мицеллы.
538. Какой объем 0,001 М раствора хлорида алюминия надо добавить к 0,02 л 0,003 М раствора H2S, чтобы не произошло образования золя сульфида мышьяка, а выпал осадок As2S3?
539. Не менее скольки миллилитров 0,0025 М раствора йодида калия надо прибавить к 0,035 л 0,003 н. раствора нитрата свинца (II), чтобы получить золь йодида свинца, для которого при электрофорезе противоионы двигались бы к аноду. Напишите формулу мицеллы золя.
540. Установите, какой ион является потенциалопределяющим для золя, образовавшегося при сливании 200 мл 0,002 М раствора нитрата свинца (II) и 300 мл 0,002 М раствора йодида калия.
Гальванические элементы
571. Составьте схемы двух гальванических элементов, в одном из которых медный электрод был бы катодом, а в другом – анодом. Приведите уравнения электродных и токообразующих процессов. Рассчитайте стандартные ЭДС этих элементов.
572. Вычислите потенциал железного электрода, погруженного в раствор, содержащий 0,0699 г дихлорида железа в 500 мл воды.
573. Какой должна быть активность ионов цинка в растворе, чтобы ЭДС гальванического элемента
Cu | Al | Al3+ || Zn2+ | Zn | Cu
при активности ионов алюминия 0,01 моль/л составила 0,947 В?
574. При какой активности ионов Pb2+ потенциал свинцового электрода составит 70 % от величины его стандартного потенциала?
575. Определите активность ионов Fe3+ в растворе, при которой потенциал железного электрода Fe3+/Fe при температуре 25 °C равен потенциалу водородного электрода в растворе с
рН = 2; Е°( Fe3+/ Fe) = 0,036 В.
576. Рассчитайте стандартную ЭДС и теоретическое время работы серебряно-цинкового элемента, в котором протекает токообразующая реакция
Ag2O + Zn → 2Ag + ZnO,
если при постоянном токе в 0,2 А израсходовано 13,8 г цинка; Е°(ZnO, H2O/Zn, 2OH–) = –1,246 В; Е°(Ag2O, H2O/2Ag, 2OH–) = = 0,344 В.
577. По уравнению токообразующей реакции
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb
составьте схему гальванического элемента. Напишите уравнения анодного и катодного процессов. Вычислите стандартную ЭДС этого элемента.
578. Составьте схему и напишите уравнения процессов, протекающих на его электродах при работе этого гальванического элемента, составленного из титана, погруженного в 0,1 М раствор сульфата титана (II), и никеля, погруженного в 0,01 М раствор сульфата никеля (II).
579. Определите значение электродного потенциала меди, погруженной в 0,0005 н раствор Cu(NO3)2.
580. Определите ЭДС концентрационного гальванического элемента при температуре 60 °C.
Ag | AgNO3(0,001M) || AgNO3 (0,1M) | Ag.
581. Вычислите потенциал свинцового электрода в насыщенном растворе PbBr2, если С(Br–) = 1 моль/л, а ПР(PbBr2) = 9,1 × × 10-6.
582. Вычислите потенциал водородного электрода, если С(Н+) в растворе равна 3,8 · 10-3 моль/л.
583. Вычислите потенциал серебряного электрода, погруженного в насыщенный раствор сульфида серебра. Во сколько раз надо изменить активность ионов Ag+ (увеличить или уменьшить), чтобы потенциал электрода стал равным нулю, если ПР(Ag2S) = = 6,3 · 10-50?
584. Гальваническая цепь составлена железом, погруженным в раствор его соли с концентрацией ионов Fe2+, равной 0,005 моль/л, и медью, погруженной в раствор ее соли. Какой концентрации должен быть раствор соли меди, чтобы ЭДС цепи стала равной нулю?
585. Составьте схему работы гальванического элемента, образованного железом и свинцом, которые погружены в 0,005 М растворы их солей. Рассчитайте ЭДС этого элемента и изменение величины энергии Гиббса.
586. Потенциал марганцевого электрода, помещенного в раствор его соли, составил –1,1 В. Вычислите активность ионов Mn2+.
587. Определите концентрацию ионов меди для концентрационной цепи
Cu| CuSO4 (0,1 г/л) || CuSO4 (х г/л)| Cu,
если ΔЕ = 0,059 В.
588. Вычислите ЭДС для концентрационных цепей.
а) Ag | AgNO3 (0,1 н) || AgNO3 (0,01 н) | Ag;
б) Zn| ZnSO4 (0,0001 г/л) || ZnSO4 (0,01 г/л)| Zn.
589. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Ni | NiSO4 (0,001 М) || CoSO4 (0,1 М) | Co.
590. Как изменится электродный потенциал цинка, если концентрация раствора сульфата цинка, в который погружена цинковая пластина, уменьшится от 0,1 н до 0,01 н?
591. Рассчитайте величину потенциала окислительно-восстановительного электрода Pt|Fe3+, Fe2+, если активные концентрации FeCl3 и FeCl2 равны соответственно 0,05 М и 0,85 М; T = 298 К.
592. Для измерения рН сока поджелудочной железы была составлена гальваническая цепь из водородного и каломельного (насыщенного) электродов. На приборе при 30 ºC ЭДС показала значение 707 мВ. Вычислите рН сока поджелудочной железы и приведите схему гальванической цепи. (Е°(Hg2Cl2, KClнасыщен/Hg =0,241 В)
593. В каком направлении пойдет ток в гальваническом элементе, состоящем из водородных электродов, находящихся в растворах с рН 2 и рН 13? Чему равна ЭДС этого элемента?
594. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрациями ионов Pb2+ и Mg2+ равными 0,01 моль/л. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
595. ЭДС гальванического элемента, образованного никелем, погруженным в раствор его соли с концентрацией ионов Ni2+ 10–4 моль/л, и серебром, погруженным в раствор его соли, равна 1,108 В. Определите концентрацию ионов Ag+ в растворе его соли.
596. Для питания различной аппаратуры используется сухой марганцево-цинковый элемент: (+)MnO2,C|NH4Cl|Zn (˗). Какова должна быть минимальная масса цинкового анода для получения 3,0 Вт·ч энергии при ЭДС элемента, равной 1,5 В. Составьте уравнение анодной реакции.
597. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого: Cd | CdSO4 (0,001 М) || CuSO4 (0,1 М) | Cu.
598. Определите, на сколько милливольт отличаются потенциалы кадмированного ножа космодесантника в растворах хлорида кадмия с концентрацией 0,01 М и 0,2 М.
599. Рассчитайте работу, совершаемую гальваническим элементом
(–) Cu | Cd| Сd2+(0,01М) || Мo3+ (0,01М)| Mo| Cu (+),
а также силу тока во внешней цепи, если за 10 мин в раствор перешло 1,124 г металла. Коэффициент выхода по току равен 0,9. Приведите уравнение токообразующего процесса.
600. Какие процессы происходят у электродов медного концентрационного гальванического элемента, если у одного из электродов концентрация ионов Cu2+ равна 1 моль/л, а у другого 10-3 моль/л? В каком направлении движутся электроны во внешней цепи? Вычислите ЭДС этого элемента.
Электролиз
601. Через две электролитические ячейки, соединённые последовательно, пропускался электрический ток, который выделил на катоде первой ячейки медь массой 19,5 г из раствора CuSO4. Найдите массу цинка, который выделится при этом на катоде второй ячейки, если его выход по току составляет 60 %.
602. При электролизе одного из соединений олова ток силой в 10 А за 3 мин выделил на электродах металл массой 0,554 г и хлор объёмом 209 мл (н.у.). Определите формулу этого соединения.
603. Вычислите время, в течение которого должен быть пропущен ток силой 0,5 А через раствор серебряной соли, чтобы покрыть металлическую пластинку слоем серебра толщиной 0,02 мм, если общая площадь поверхности пластинки 500 см2, а выход по току 95,5 % (плотность серебра 10,5 г/см3).
604. Деталь была оцинкована за 1 ч 40 мин. Электролит – раствор сульфата цинка. Вес металлического покрытия (т.е. Zn) составляет 7,8456 г. Выход по току – 77,2 %. Чему была равна сила тока?
605. Деталь подверглась марганцеванию. Электролит – раствор MnSО4. Сила тока – 5 А. Вычислите выход металлического покрытия (марганца) по току, если в течение 1 ч на поверхности детали выкристаллизовалось 3,078 г чистого марганца.
606. Электрический ток силой 6 А в течение 1 ч 14 мин 24 с осадил на катоде 8,14 г металла из химического соединения, в котором он двухвалентен. Чему равна атомная масса металла и какой это металл?
607. Ток силой 4 А пропускали через электролизер в течение 16 мин 5 с. За это время на катоде выделился свинец массой 4,14 г из расплава одного из его соединений. Было ли это соединение двух- или четырехвалентного свинца?
608. Сколько времени следует пропускать ток силой 5 А через раствор NaCl для получения 20 г NaOH? (Дайте полную схему электролиза раствора хлорида натрия с применением графитовых электродов.)
609. Никелевые электроды погружены в 1 М раствор NiSO4. В результате электролиза через 1 ч масса одного из электродов уменьшилась на 1,00 г. Чему равна сила тока? Напишите уравнение реакций.
610. Какую массу алюминия можно получить при электролизе расплава Al2O3, если в течение 1 ч пропускать ток силой 20 А при выходе по току 85 %? Напишите уравнение реакций.
611. Опишите процессы, протекающие на катоде и аноде при электролизе водного раствора сульфата никеля с концентрацией ионов никеля 0,1 моль/л при рН = 4 на графитовых электродах.
612. Деталь хромируется в водном растворе Cr2(SO4)3. Сила тока – 3 А. Определите продолжительность электролиза, если на поверхность детали необходимо нанести электрокристаллизацией 1,3 г хрома. Выход по току принять равным 40 %.
613. Для получения 1 м3 хлора при электролизе водного раствора хлорида магния было пропущено через раствор 2423 А · ч электричества. Вычислите выход по току. (Дайте полную схему электролиза раствора хлорида магния с применением графитовых электродов.)
614. Найдите толщину выделившегося при электролизе на железной проволоке слоя олова (плотность олова 7298 кг/м3), если длина проволоки 2 м, а её диаметр 0,0004 м. Ток силой 2,5 А в течение 30 мин пропускали через раствор SnCl2. Выход по току равен 93 %.
615. При электролизе раствора нитрата серебра в течение 50 мин при силе тока 3А на катоде выделилось 9,6 г серебра. Определите выход серебра в процентах от теоретического значения.
616. Через последовательно включенные в цепь постоянного тока растворы AgNO3 и CuSO4 пропускался ток силой в 5 А в течение 10 мин. Какая масса каждого металла выделится при этом на катодах?
617. При электролизе раствора соли трехвалентного металла при силе тока 2 А в течение 1 ч на катоде выделилось 2,57 г металла. Вычислите его атомную массу, если коэффициент выхода по току составил 0,9.
618. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла.
619. Определите процентное содержание индифферентных примесей в образце медного купороса, если после растворения его навески массой 0,4556 г в азотной кислоте и электролиза полученного раствора на платиновом катоде выделено 0,1145 г чистой меди.
620. Навеску сплава массой 0,5 г обработали и получили сульфатно-аммиачный раствор, из которого электролизом при постоянной силе тока 0,5 А на платиновом катоде полностью выделилось 0,0941 г никеля за 12 мин. Определите процентное содержание никеля в сплаве, относительную погрешность определения и выход по току.
621. Определите толщину слоя цинка, выделившегося в течение 30 мин на железном катоде площадью 800 см2 при электролизе раствора ZnCl2 силой тока, равной 2,5 А. Коэффициент выхода по току составил 0,8. Плотность цинка равна 7,15 г/см3.
622. При пропускании через раствор электролита 2 А · ч электричества на аноде окислилось 1,196 г сульфид-иона. Определите электрохимический и химический эквивалент серы.
623. Оцинкование детали проводили в растворе сульфата цинка в течение 1 ч 15 мин 32 с, вес покрытия составил 7,5467 г, выход по току 72,5 %. Чему была равна сила тока?
624. Определите время, теоретически необходимое для полного выделения на катоде кадмия из 20 см3 раствора сульфата кадмия концентрацией 0,0622 моль/дм3, если электролиз проводился при силе тока 0,1 А и выход по току составил 80 %.
625. При электролизе водного раствора NiSO4 на аноде выделилось 3,8 л кислорода, измеренного при температуре 27 °C и давлении 100 кПа. Сколько граммов никеля выделилось на катоде?
626. Железный предмет общей площадью 0,08 м2 помещен в качестве катода в раствор соли никеля. Какова толщина отложившегося слоя никеля? Плотность никеля – 8900 кг/м3. Ток силой 3,15 А пропускали в течение 42 мин.
627. При какой силе тока можно из водного раствора NaOH выделить 6 л кислорода в течение 3 ч? Газ измерен при температуре 17 °C и давлении 98 кПа.
628. Электролизом раствора сульфата цинка на катоде за время 786 с осаждено 0,12 г цинка. Какую силу тока поддерживали при электролизе, если выход по току составил 90 %?
629. Для выделения 1,75 г некоторого металла из раствора его соли потребовалось пропустить ток силой 1,8 А в течение 1,5 ч. Вычислите молярную массу эквивалента металла. Определите какой был взят металл, если валентность металла равна трем.
630. В водный раствор, содержащий по 1 моль/л ионов Al3+, Fe2+, Mg2+, погрузили платиновые электроды и начали медленно увеличивать напряжение. После начала выделения одного из металлов напряжение поддерживалось постоянным. Какой металл и в каком количестве выделился на катоде за 30 мин при силе тока, равной 2А?
Коррозия металлов
631. Вычислите ЭДС коррозионного элемента, наблюдаемого при контакте магния с железом в чистой воде, если наблюдается водородная деполяризация.
632. Предложите протектор для защиты изделия из алюминиевой бронзы от коррозии во внешней атмосфере. Приведите уравнения протекающих процессов.
633. Изделие из хрома покрыли цинком. Какое это покрытие – катодное или анодное? Почему? Составьте уравнения катодного и анодного процессов коррозии этого изделия при нарушении цельности покрытия во влажном воздухе и в растворе соляной кислоты. Какие продукты коррозии при этом образуются?
634. Как происходит атмосферная коррозия хромированного марганца при нарушении покрытия? Составьте уравнения катодного и анодного процессов.
635. Рассмотрите коррозию изделия из алюминиевой бронзы:
а) в дистиллированной воде; б) в сильно щелочной среде.
Приведите уравнения электродных процессов. Какие вещества являются продуктами коррозии?
636. Какой из металлов (Zn, Mg, Cr) целесообразно выбрать для протекторной защиты от атмосферной коррозии свинцовой оболочки кабеля? Ответ аргументируйте. Приведите уравнения электродных процессов. Каков состав продуктов коррозии?
637. Две железные пластинки, одна из которых частично покрыта оловом, другая медью, находятся во влажном воздухе. На какой из них быстрее появится ржавчина? Ответ обоснуйте. Приведите уравнения электродных процессов и состав продуктов коррозии.
638. Составьте уравнение электродных процессов, происходящих при коррозии луженого железа и луженой меди во влажной атмосфере в случае нарушения герметичности покрытий. Ответ аргументируйте.
639. Рассмотрите коррозию изделия из латуни (сплав Cu-Zn) в морской воде. Приведите уравнения электродных процессов и схему коррозионного микрогальванического элемента. Какие вещества являются продуктами коррозии?
640. В раствор соляной кислоты погружены две одинаковые никелевые пластинки, одна из которых частично покрыта цинком. В каком случае процесс коррозии никеля протекает интенсивнее? Ответ мотивируйте. Составьте уравнения соответствующих процессов.
641. Для транспортирования концентрированной серной кислоты применяют железные бочки, но после освобождения от кислоты бочки часто разрушаются вследствие коррозии. Чем это можно объяснить? Что является анодом, катодом? Составьте электронные уравнения соответствующих процессов.
642. Гальванический элемент
(–) Cr|Cr3+|H2SO4|(Pb) H2(+),
образовавшийся при коррозии хрома, спаянного со свинцом, дает ток силой 6 А. Какая масса хрома окислится и сколько литров водорода выделится за 55 с работы этого элемента?
643. Как происходит коррозия железа, покрытого:
а) никелем; б) цинком в кислотном растворе?
Составьте электронные уравнения анодного и катодного процессов при коррозии этих металлов.
644. Медь покрыта оловом. При нарушении оловянного покрытия работает гальванический элемент
(–)Sn |Sn2+ |HCl| (Cu)H2 (+),
который дает ток силой 7,5 А. Какая масса олова растворится и сколько литров водорода выделится на медном катоде за 25 мин?
645. Составьте электродные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
646. При коррозии железа, покрытого кадмием, в кислой среде работает гальванический элемент
(–)Fe|Fe2+(0,1M)|HCl(1н)|(Cd)H2 (+).
Как изменится ЭДС гальванического элемента, если концентрация иона Fe2+ возрастет до 0,15 моль/л.
647. Железо покрыто хромом. Какой из металлов будет корродировать в случае нарушения поверхностного слоя покрытия в атмосфере влажного воздуха? Составьте схему процессов, происходящих на электродах.
648. При коррозии бериллиевой пластины весом 350 г и поверхностью 165 мм, на воздухе прокорродировало 10 % от массы бериллия в течение трех суток. Вычислите объемный показатель коррозии, считая, что продуктом коррозии является оксид бериллия, а внешние условия нормальными.
649. Найдите объемный показатель коррозии, если в результате коррозии железного листа с размерами 10 × 25 × 2 мм выделилось 2,7 см3 водорода (н.у.) за 18 мин.
650. Найдите объем водорода, который выделится при коррозии железной пластинки в 0,5 М растворе серной кислоты, если в течение 1 ч масса пластинки уменьшилась на 0,01 г. Физические условия в лаборатории: Т = 22 °С, Р = 1,01 атм.
651. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения катодного и анодного процессов.
652. Цинк и медь корродируют в морской воде со скоростью 1 г/(м2 · сут). Определите скорость коррозии в мм/год, если
ρZn = 7130 кг/м3, ρCu = 8920 кг/м3.
653. Олово спаяно с серебром. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в щелочную среду? Рассчитайте ЭДС и энергию Гиббса образующегося гальванического элемента.
654. Стальное изделие имеет цинковое покрытие. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадет в нейтральную среду с рН = 7? Подсчитайте ЭДС коррозионного элемента для стандартного состояния. При каких значениях рН прекратится процесс выделения водорода?
655. Возможна ли электрохимическая коррозия олова в водном растворе при рН = 6 при контакте с воздухом? Напишите электронные уравнения анодного и катодного процессов. При каких значениях рН возможна коррозия с выделением водорода (Е°Sn/Sn2+ = –0,136 В)?
656. Вычислите ЭДС коррозионного элемента, наблюдаемого при контакте кобальта с оловом в 0,1 М растворе серной кислоты. Составьте электронные уравнения анодного и катодного процессов при работе такого коррозионного элемента.
657. Вычислите ЭДС коррозионного элемента, составленного из золотого электрода в 0,1 М растворе хлорида золота (III) и алюминиевого электрода в 0,02 н растворе хлорида алюминия.
658. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
659. Исходя из энергии Гиббса, определите, какие из приведенных металлов (Mg, Cu, Au) будут коррозировать во влажном воздухе по уравнению
Me + H2O + 1/2 O2 = Me(OH)2?
660. Найдите объем водорода, который выделится при коррозии железной пластинки в 0,01 М растворе серной кислоты, если в течение 10 мин масса пластинки уменьшилась на 0,003 г. Физические условия в лаборатории: Т = 25 °С, Р = 0,97 атм.
Жесткость воды
661. Определите массы реагентов, требуемых для полного умягчения воды, если природная вода имеет следующие показатели жесткости (ммоль·экв/л): ЖК=3,3; ЖНК=2,2. Объём воды 5 л. Солевой состав воды Са(НСО3)2 и MgCl2.
662. Рассчитайте общую жесткость воды (ммоль·экв/л), если в 250 мл воды содержится 14,2 мг гидрокарбоната магния, 8,12 мг хлорида кальция и 4,5 мг хлорида магния.
663. К 90 л жесткой воды прибавили 12,95 г гидроксида кальция. На сколько ммоль понизилась карбонатная жесткость этой воды?
664. Растворимость сульфата кальция в воде при 20°C равна 0,202 г на 100 г раствора. Плотность насыщенного раствора сульфата кальция равна 1000 кг/м3. Вычислите жесткость этого раствора.
665. Определите, чему равна карбонатная жесткость воды, если в 1 л ее содержится 0,292 г гидрокарбоната магния и 0,225 г гидрокарбоната кальция?
666. Вычислите временную жесткость воды, зная, что на реакцию с гидрокарбонатом кальция, содержащимся в 100 мл этой воды, потребовалось 5 мл 0,1 н. раствора соляной кислоты.
667. При кипячении 250 мл воды, содержащей гидрокарбонат кальция, выпал осадок массой 3,5 мг. Чему равна жесткость этой воды?
668. Сколько граммов гидроксида кальция необходимо прибавить к 1000 л воды, чтобы устранить ее временную жесткость, равную 2,86 ммоль·экв/л?
669. Образец воды объемом 1 л содержит 48,6 мг гидрокарбоната кальция и 29,6 мг сульфата магния. Какое количество катионов Ca2+ и Mg2+ содержится в этом образце воды? Определите, чему равна общая жесткость воды.
670. Анализ воды показал, что в ней содержится гидрокарбонат кальция массой 1386 мг, хлорид кальция массой 610 мг. Объём воды составил 5 л. Определите общую, карбонатную и некарбонатную жесткость воды, солесодержание (г/л).
671. Общая жесткость волжской воды равна 6,52 ммоль·экв/л, а временная 3,32 ммоль·экв/л. Какую массу гидроксида кальция и карбоната натрия необходимо взять, чтобы устранить жесткость 5 л воды?
672. Вычислите карбонатную жесткость воды, зная, что на реакцию с гидрокарбонатом кальция, содержащимся в воде объемом 200 мл, потребовалось 25 мл 0,1 н. раствора соляной кислоты.
673. Жесткость некоторого образца воды обусловливается только гидрокарбонатом железа. При кипячении 0,25 л воды в осадок выпадает 4 мг карбоната железа (II). Определите жесткость воды.
674. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавили 8,2 г гидроксида кальция и 4,3 г карбоната натрия. Рассчитайте временную и постоянную жесткость воды.
675. На умягчение 10 л воды израсходовано Ca(OH)2 массой 3,7 г и Na2CO3 массой 1,06 г. Рассчитайте общую жесткость ЖОб исходной воды. Составьте уравнения процессов умягчения.
676. При термическом умягчении 10 л воды, содержащей гидрокарбонат кальция, образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жесткость воды ЖОб составляла 5,5 ммоль·экв/л. Составьте уравнения процессов умягчения.
677. В 4 м3 воды содержатся Ca(HCO3)2 массой 648 г и CaCl2 массой 1335 г. Определите жесткость, солесодержание и рН воды.
678. Определите, сколько мл 0,1 н. раствора трилона Б и 0,05 н. раствора HCl израсходовано при определении жесткости воды методом комплексонометрии, если объем пробы воды равен 100 мл. Результаты анализа: общая жесткость ЖОб = 2,5 ммоль·экв/л, карбонатная жесткость ЖК = 2 ммоль·экв/л.
679. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей следующие величины жесткости: ЖК = 4ммоль·экв/л, ЖОб = 5 ммоль·экв/л. Составьте уравнения процессов умягчения.
680. На умягчение 150 л воды израсходовано Ca(OH)2 массой 5,57 г и Na2CO3 массой 26,6 г. Рассчитайте общую жесткость ЖОб исходной воды. Составьте уравнения процессов умягчения.
681. При термическом умягчении 20 л воды, содержащей гидрокарбонат магния, образовался осадок массой 2 г. Определите остаточную ЖНК, если исходная общая жесткость воды ЖОб составляла 3,5 ммоль·экв/л. Составьте уравнения процессов умягчения.
682. Определите, сколько соды нужно для смягчения 10 л воды, содержащей 15 мг-экв/л ионов кальция? Составьте уравнения процессов умягчения.
683. Минеральная вода “Нарзан” содержит 0,3894 г/л кальция и 0,0884 г/л магния. Определите общую жесткость этой воды?
684. В 2 л воды содержится 3 г бикарбоната кальция, 0,29 г бикарбоната магния и 1,4 г сульфата кальция. Сколько натриевого мыла (соли стеариновой кислоты) будет перерасходовано за счет жесткости при использовании 1000 л воды? Образование кальциевого (или магниевого) мыла протекает по реакции:
2С17Н35СООNa+Ca(HCO3)2 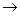 (С17Н35СОО)2Са+2NaHCO3
(С17Н35СОО)2Са+2NaHCO3
685. Общая жесткость воды, обусловленная присутствием в ней ионов Ca2+, HCO3˗, Cl-, составляет 10 ммоль·экв/л. Рассчитайте их концентрацию в г/л, если карбонатная жесткость воды равна 2 ммоль·экв/л.
686. Какой объем воды можно умягчить 10 м3 катионита с рабочей обменной емкостью, равной 220 ммоль·экв/л, если жесткость воды составляет 6,1 ммоль·экв/л.
687. Вычислите общую, карбонатную и некарбонатную жесткость воды, если на титрование двух ее проб по 100 мл каждая израсходовано на первую 8,2 мл 0,05 н раствора трилона Б, на вторую 2,8 мл 0,1 н раствора HCl.
688. Через ионообменный фильтр пропущено 200 л воды, при этом ее жесткость, обусловленная присутствием в ней ионов Ca2+, уменьшилась на 2,5 ммоль·экв/л и составила 0,2 ммоль·экв/л. Рассчитайте начальную жесткость воды, а также массу ионов кальция, задержанных фильтром.
689. При перегонке 2 л воды ее масса уменьшилась на 201,7 мг. Чему равна ее жесткость, если она обусловлена наличием в ней гидрокарбоната кальция? Приведите уравнение процесса, протекающего при перегонке.
690. Вычислите общую, карбонатную и некарбонатную жесткость воды, в 10 л которой содержится 0,41 г Ca(HCO3)2 и 0,91 г MgSO4. Составьте уравнения процессов умягчения.
Элементы органической химии
691. При взаимодействии 1,04 г смеси формальдегида и ацетальдегида с избытком аммиачного раствора оксида серебра образовалось 10,8 г металла. Какой была масса формальдегида в смеси?
692. Установите формулу соединения, при сжигании 2,40 г которого было получено 1,44 г воды, 896 мл углекислого газа и 1,12 г азота.
693. При взаимодействии 22 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
694. При сгорании вторичного амина симметричного строения выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота. Установите молекулярную формулу этого амина.
695. Некоторый сложный эфир массой 7,4 г подвергнут щелочному гидролизу. При этом получено 9,8 г калиевой соли предельной одноосновной кислоты и 3,2 г спирта. Установите молекулярную формулу эфира.
696. При полном сгорании углеводорода образовалось 27 г воды и 33,6 л диоксида углерода (н.у.). Относительная плотность углеводорода по аргону равна 1,05. Установите его молекулярную формулу.
697. При полном сжигании вещества, не содержащего кислорода, образуется азот и вода. Относительная плотность паров этого вещества по водороду равна 16. Объём необходимого на сжигание кислорода равен объёму выделившегося азота. Определите общую формулу соединения и истинную формулу вещества.
698. При взаимодействии 25,5 г предельной одноосновной кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
699. При сгорании 0,45 г газообразного органического вещества выделилось 0,448 л (н.у.) углекислого газа, 0,63 г воды и 0,112 л (н.у.) азота. Плотность исходного газообразного вещества по азоту 1,607. Установите молекулярную формулу этого вещества.
700. При пропускании смеси пропана и ацетилена через раствор бромной воды масса раствора увеличилась на 1,3 г. При сгорании такой же смеси выделилось 14 л (н.у.) оксида углерода (IV). Определить массовую долю пропана в смеси.
701. Определите молекулярную формулу ацетиленового углеводорода, если молярная масса продукта его реакции с избытком бромоводорода в 4 раза больше, чем молярная масса исходного углеводорода.
702. При взаимодействии одного и того же количества алкена с галогенами образуется соответственно 11,3 г дихлорпроизводного или 20,2 г дибромпроизводного. Определите молекулярную формулу алкена, запишите его название и структурную формулу.
703. При взаимодействии первичного одноатомного спирта, содержащего 60 % углерода и 13,3 % водорода, с органической кислотой образовалось вещество, плотность паров которого по водороду равна 58. Определите молекулярную формулу каждого из веществ, участвующих в реакции, и дайте им названия.
704. Масса неизвестного объёма воздуха равна 0,123 г, а масса такого же объёма газообразного алкана 0,246 г (при одинаковых условиях). Определите молекулярную формулу алкана.
705. Предельную одноосновную карбоновую кислоту массой 11 г растворили в воде. Для нейтрализации полученного раствора потребовалось 25 мл раствора гидроксида натрия, молярная концентрация которого 5 моль/л. Определите формулу кислоты.
706. Установите молекулярную формулу алкена, не имеющего геометрических изомеров, если известно, что 1,5 г его способны присоединить 0,6 л (н.у.) водорода. Запишите названия алкенов, удовлетворяющих условию задачи.
707. При сгорании в кислороде образца предельного одноатомного спирта количеством вещества 2,5 моль образовалось 224 л углекислого газа. Установите формулу спирта.
708. В результате реакции предельного двухатомного спирта массой 30,4 г с избытком металлического натрия получено 8,96 л (н.у.) газа. Определите молекулярную формулу исходного спирта.
709. Органическое вещество массой 1,875 г занимает объём 1 л (н.у.). При сжигании 4,2 г этого вещества образуется 13,2 г диоксида углерода и 5,4 г воды. Определим молекулярную формулу вещества.
710. При взаимодействии 1,48 г предельного одноатомного спирта с металлическим натрием выделился водород в количестве, достаточном для гидрирования 224 мл этилена (н.у.). Определите молекулярную формулу спирта.
711. Образец алкена поглотили избытком раствора брома в ССl4. При этом массовая доля углерода в исходном алкене оказалась в 2,9 раза больше, чем в дибромалкане. Установите брутто-формулу исходного соединения.
712. Определите объем (н.у.) метиламина, который способен прореагировать с 500 г 9,8 %-ного раствора серной кислоты с образованием средней соли.
713. К смеси метанола и этанола массой 50 г прибавили избыток натрия, при этом выделилось 12,6 л водорода (н.у.). Определите массы спиртов в исходной смеси.
714. Напишите структурную формулу предельного амина, если известно, что при сгорании 2,36 г его образовалось 5,28 г углекислого газа и 0,448 л азота (н.у.). Относительная плотность его паров по водороду равна 29,5.
715. Какой объём 96 %-ного этилового спирта (плотностью 800 кг/м3) потребуется для этерификации 1,5 г аминоуксусной кислоты, если спирт в реакцию необходимо брать с двукратным избытком?
716. Вычислите, какой объём воздуха (н.у.) потребуется для сжигания 268,8 л метиламина. Хватит ли полученного при этом азота для получения 170 г аммиака? Ответ подтвердите расчетом.
717. К раствору анилина массой 500 г добавили избыток брома. Масса выпавшего осадка составила 3,3 г. Вычислите массовую долю (в %) анилина в исходном растворе.
718. При нагревании 1,36 г технического ацетата натрия с избытком разбавленной серной кислоты получили 0,6 г уксусной кислоты. Вычислите массовую долю (в %) примесей в техническом образце ацетата натрия.
719. Вычислите, сколько литров кислорода (н.у.) потребуется для полного сгорания 25 г этилового спирта. Какой объём 5,5 %-ного раствора гидроксида калия (плотность 1,05 г/мл) можно нейтрализовать при этом углекислым газом, считая, что образуется средняя соль?
720. При действии натрия на 13,8 г смеси этилового спирта и одноосновной органической кислоты выделяется 3,36 л газа, а при действии на ту же смесь насыщенного раствора питьевой соды – 1,12 л газа. Определите массовую долю (в %) каждого компонента в смеси и строение органической кислоты.
П р и л о ж е н и е 1
Константы диссоциации некоторых электролитов в водных растворах (при температуре 298 К)
| Электролит | КД | Электролит | КД |
| HNO2 | K = 4,6·10-4 | NH4OH | K =1,8·10-5 |
| HAlO2 | K = 6·10-13 | H2O | K =1,8·10-16 |
| H3BO3 | К1 = 5,8·10-10 К2 = 1,8·10-13 К3 = 1,6·10-14 | Al(OH)3 | К1 = 7,41 ·10-9 К2 = 2,14 ·10-9 К3 = 1,38 ·10-9 |
| HBrO | K = 2,1 ·10-9 | Fe(OH)2 | К1 = 5,5 ·10-8 К2 = 1,2 ·10-2 |
| H2SiO3 | К1 = 2,2·10-10 К2 = 1,6·10-12 | Fe(OH)3 | К1 = 4,79 ·10-11 К2 = 1,82·10-11 К3 = 1,48 ·10-12 |
| HCOOH | K =1,8·10-4 | Cu(OH)2 | К1 = 2,19 ·10-7 К2 = 6,61 ·10-8 |
| H2Se | К1 = 1,7·10-4 К2 = 1·10-11 | Ni(OH)2 | К2 = 2,5·10-5 |
| H2SO3 | К1 = 1,7·10-2 К2 = 6,3·10-8 | AgOH | K =1,1 ·10-4 |
| H2S | К1 = 5,7·10-8 К2 = 1,2·10-15 | Pb(OH)2 | К1 = 9,6·10-4 К2 = 3 ·10-8 |
| H2TeO3 | К1 = 3 ·10-3 К2 = 2 ·10-8 | Cr(OH)3 | К2 = 1,02·10-10 |
| H2Te | К1 = 1 ·10-3 К2 = 1 ·10-11 | Zn(OH)2 | К1 = 4,4 ·10-5 К2 = 1,5 ·10-9 |
| H2CO3 | К1 = 4,5 ·10-7 К2 = 4,8 ·10-11 | Cd(OH)2 | К1 = 8,13 ·10-4 К2 = 4,17 ·10-7 |
| CH3COOH | K =1,8 ·10-5 | Mn(OH)2 | К2 = 5 ·10-4 |
| HClO | K =5 ·10-8 | Со(ОН)2 | К1 = 8,32 ·10-5 К2 = 8,32 ·10-6 |
| H3PO4 | К1 = 7,5 ·10-3 К2 = 6,3 ·10-8 К3 = 1,3 ·10-12 | Sc(OH)3 | К1 = 3,16 ·10-8 К2 = 5,01 ·10-9 К3 = 4,07 ·10-10 |
| HF | K =6,6 ·10-4 | Th(OH)4 | К4 = 2 ·10-10 |
| HCN | K =7,9 ·10-2 | V(OH)3 | К3 = 8,3 ·10-12 |
| H2C2O4 | К1 = 5,4 ·10-2 К2 = 5,4·10-5 | Ga(OH)3 | К2 = 1,6 ·10-11 К3 = 4 ·10-12 |
| HClO | K1= 3,98 ×10-8 | Sn(OH)2 | К1 = 3,47 ·10-10 К2 = 1,26 ·10-12 |
| H2CrO4 | К1 = 1,8 ·10-1 К2 = 3,24·10-7 | Sn(OH)4 | К1 = 1,66 ·10-13 К2 = 2,14 ·10-14 |
П р и л о ж е н и е 2
Криоскопические ( K ) и эбулиоскопические (Е) константы некоторых растворителей
| Растворитель | К | Е | Растворитель | К | Е |
| Вода | 1,86 | 0,52 | Этиловый спирт | -- | 1,16 |
| Бензол | 5,10 | 2,57 | Ацетон | 2,40 | 1,50 |
| Анилин | 5,87 | 3,69 | Хлороформ | 4,90 | 3,89 |
| Тетрахлорид углерода | 2,98 | 5,02 | Фенол | 7,3 | 3,6 |
| Камфора | 40 | 6,09 | Нитробензол | 6,9 | 5,27 |
П р и л о ж е н и е 3
П р и л о ж е н и е 4
Произведения растворимости малорастворимых электролитов при 25 ° С
| Вещество | ПР | Вещество | ПР | Вещество | ПР |
| Ac(OH)3 | 2,10 ×10-19 | Cd3(AsO4)2 | 2,20 ×10-33 | PbI2 | 8,00 × 10-9 |
| Ag3AsO3 | 4,50 ×10-19 | CdCO3 | 1,00 ×10-12 | PbBr2 | 9,10 ×10-6 |
| AgBr | 6,00 ×10-13 | CdF2 | 6,44 ×10-3 | Pb3(PO4)2 | 7,90 ×10-43 |
| AgBrO3 | 5,38 ×10-5 | Cd(IO3)2 | 2,50 ×10-8 | PbC2O4 | 7,30 ×10-11 |
| AgCH3COO | 1,94 ×10-3 | CdS | 6,50 ×10-28 | PbMoO4 | 8,50 ×10-16 |
| AgCN | 5,97 ×10-17 | Cd(OH)2 | 7,20 ×10-15 | Pd(OH)2 | 1,20 ×10-29 |
| Ag2C2O4 | 5,40 ×10-12 | Cd(CN)2 | 1,00 ×10-8 | PdS | 7,50 ×10-48 |
| Ag2Cr2O7 | 2,00 ×10-7 | Cd3(PO4)2 | 2,53 ×10-33 | PtBr4 | 3,00 ×10-41 |
| Ag2Cr2O4 | 1,12 ×10-12 | Co3(AsO4)2 | 6,80 ×10-29 | Pt(OH)2 | 1,00 ×10-25 |
| Ag2O | 2,00 ×10-8 | CoCO3 | 2,80 ×10-10 | PtS | 1,20 ×10-61 |
| Ag2CO3 | 8,46 ×10-12 | Co3(PO4)2 | 2,05 ×10-35 | Sb2S3 | 2,20 ×10-90 |
| AgCl | 1,80 ×10-10 | CsClO4 | 3,95 ×10-3 | ScAsO4 | 1,90 ×10-27 |
| AgI | 1,10 ×10-16 | CsIO3 | 1,00 ×10-2 | Sc(OH)3 | 8,70 ×10-28 |
| AgIO3 | 3,17 ×10-8 | CsIO4 | 5,16 ×10-6 | Sn(OH)2 | 3,70 ×10-15 |
| Ag3PO4 | 1,80 ×10-18 | CsMnO4 | 9,10 ×10-5 | SnS | 3,00 ×10-28 |
| Ag2S | 5,70 ×10-51 | Ce(OH)3 | 6,40 ×10-22 | SnI2 | 8,30 ×10-6 |
| Ag2SO3 | 1,50 ×10-14 | CuC2O4 | 2,90 ×10-8 | SnS2 | 2,30 ×10-58 |
| Ag2SO4 | 1,20 ×10-5 | Cu(IO3)2 | 1,40 ×10-7 | Zn3(PO4)2 | 9,10 ×10-33 |
| AgSCN | 1,03 ×10-12 | Cu3(AsO4)2 | 7,60 ×10-36 | Zn(CN)2 | 2,60 ×10-13 |
| Ag2Se | 2,50 ×10-59 | CuCO3 | 2,36 ×10-10 | ZnCO3 | 6,00 ×10-11 |
| Ag2Te | 4,70 ×10-52 | Cu(OH)2 | 2,20 ×10-20 | Zn(OH)2 | 1,00 ×10-17 |
| Ag2SO4 | 7,70 ×10-5 | CuS | 6,00 ×10-36 | ZnS | 1,60 ×10-24 |
| Am(OH)3 | 2,70 ×10-20 | Fe(OH)2 | 1,00 ×10-15 | ZnC2O4 | 2,00 ×10-8 |
| Am(OH)4 | 1,00 ×10-56 | Fe(OH)3 | 3,80 ×10-38 | SrWO4 | 7,10 ×10-9 |
| AuBr | 5,00 ×10-17 | FeS | 3,40 ×10-17 | SrCO3 | 9,42 ×10-10 |
| AuCl | 1,80 ×10-12 | FePO4 | 1,10 ×10-26 | SrSO4 | 2,80 ×10-7 |
| AuI | 1,60 ×10-23 | FeSe | 1,80 ×10-20 | SrC2O4 | 5,60 ×10-8 |
| AuI3 | 1,00 ×10-46 | FeCO3 | 2,90 ×10-11 | Sr3(PO4)2 | 1,00 ×10-31 |
| Au2O3 | 8,50 ×10-46 | FeC2O4 | 2,10 ×10-7 | Sr(OH)2 | 3,20 ×10-4 |
| Al(OH)3 | 1,90 ×10-33 | MgCO3 | 7,90 ×10-6 | SrMoO4 | 1,60 ×10-7 |
| BaCO3 | 7,00 ×10-9 | MgS | 2,00 ×10-15 | SrCrO4 | 2,70 ×10-5 |
| BaC2O4 | 1,10 ×10-7 | MgC2O4 | 8,60 ×10-5 | SrF2 | 2,50 ×10-9 |
| Ba3(PO4)2 | 6,00 ×10-39 | MgF2 | 6,40 ×10-9 | Sr3(AsO4)2 | 1,30 ×10-18 |
| BaCrO4 | 1,60 ×10-10 | MgSO3 | 3,00 ×10-3 | SrSeO4 | 2,50 ×10-5 |
| BaF2 | 1,84 ×10-7 | MgSeO3 | 4,40 ×10-6 | TlBr | 4,30 ×10-6 |
| BaSO3 | 5,00 ×10-10 | Mg3(PO4)2 | 3,90 ×10-26 | Tl2CO3 | 4,00 ×10-3 |
| BaSO4 | 1,08 ×10-10 | MgWO4 | 3,60 ×10-7 | Tl2C2O4 | 2,00 ×10-4 |
| Ba(IO3)2 | 4,01 ×10-9 | Mg(IO3)2 | 3,00 ×10-13 | TlCl | 1,90 ×10-4 |
| BaMoO4 | 3,54 ×10-8 | Mg(OH)2 | 5,50 ×10-12 | Tl2CrO4 | 1,00 ×10-12 |
| Ba(NO3)2 | 4,64 ×10-3 | MnS | 2,50 ×10-10 | TlI | 6,60 ×10-8 |
| BaSeO4 | 3,40 ×10-8 | MnSO3 | 2,60 ×10-7 | Tl3PO4 | 6,70 ×10-8 |
| Ba(BrO3)2 | 2,43 ×10-4 | MnCO3 | 5,05 ×10-10 | Tl2SO4 | 1,50 ×10-4 |
| BiAsO4 | 4,43 ×10-10 | Mn(OH)2 | 2,30 ×10-13 | Tl2SeO4 | 1,00 ×10-4 |
| BiI3 | 7,71 ×10-19 | MnC2O4 | 8,60 ×10-5 | RbClO4 | 3,00 ×10-3 |
| BiClO | 3,40 ×10-36 | Ni(CN)2 | 3,00 ×10-23 | Pr(OH)3 | 3,39 ×10-24 |
| Bi(OH)3 | 3,00 ×10-36 | NiCO3 | 1,30 ×10-7 | Hg2Br2 | 7,90 ×10-23 |
| Bi2S3 | 8,90 ×10-10 | NiC2O4 | 4,00 ×10-10 | Hg2Cl2 | 1,50 ×10-18 |
| CaCO3 | 5,00 ×10-9 | Ni(OH)2 | 1,60 ×10-14 | Hg2I2 | 5,40 ×10-29 |
| Ca3(PO4)2 | 2,07 ×10-33 | NiS | 9,30 ×10-22 | Hg2SO4 | 6,20 ×10-7 |
| CaSO4 | 4,93 ×10-5 | NiSeO3 | 2,50 ×10-6 | HgS | 1,6×10-52 |
| CaC2O4 | 2,00 ×10-9 | PbCl2 | 2,0×10-5 | HgI2 | 2,8×10-29 |
| CaF2 | 4,00 ×10-11 | PbCrO4 | 1,8×10-14 | Hg2(SCN)2 | 3,20 ×10-20 |
| Ca(OH)2 | 5,02 ×10-6 | PbCO3 | 1,5×10-13 | HgBr2 | 6,20 ×10-20 |
| Ca3(AsO4)2 | 6,80 ×10-19 | PbS | 1,0×10-27 | Hg2C2O4 | 1,75 ×10-13 |
| CaWO4 | 1,60 ×10-9 | PbSO4 | 1,6×10-8 | Hg2CO3 | 3,60 ×10-17 |
П р и л о ж е н и е 5
Стандартные электродные потенциалы в водных растворах
| Электрод | Е0, В | Электрод | Е0, В |
| Li+/Li | – 3,045 | Tl +/Tl | – 0,336 |
| Rb+/Rb | – 2,925 | Co2+/Co | – 0,277 |
| K+/K | – 2,924 | Ni2+/Ni | – 0,257 |
| Cs+/Cs | – 2,923 | Mo3+/Mo | – 0,200 |
| Ba2+/Ba | – 2,912 | Sn2+/Sn | – 0,136 |
| Fr+/Fr | – 2,900 | Pb2+/Pb | – 0,126 |
| Sr2+/Sr | – 2,868 | Fe3+/Fe | – 0,036 |
| Ra2+/Ra | – 2,800 | 2H+/H2 | 0,000 |
| Ca2+/Ca | – 2,866 | Ge4+/Ge | +0,124 |
| La3+/La | – 2,379 | Ge2+/Ge | +0,240 |
| Y3+/Y | – 2,372 | Re3+/Re | +0,300 |
| Na+/Na | – 2,714 | Bi3+/Bi | + 0,308 |
| Mg2+/Mg | – 2,363 | Cu2+/Cu | + 0,342 |
| Be2+/Be | – 1,847 | Tc2+/Tc | +0,400 |
| Al3+/Al | – 1,662 | Ru2+/Ru | +0,455 |
| Ti 2+/Ti | – 1,628 | Cu+/Cu | + 0,521 |
| Zr4+/Zr | – 1,580 | Rh2+/Rh | +0,600 |
| Hf4+/Hf | – 1,550 | Tl 3+/Tl | + 0,741 |
| Ti 3+/Ti | – 1,370 | Rh3+/Rh | +0,758 |
| V2+/ V | – 1,186 | Po4+/Po | +0,760 |
| Mn 2+/ Mn | – 1,180 | Hg 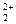 /Hg /Hg
| +0,797 |
| Cr 2+/Cr | – 0,913 | Ag+/Ag | + 0,799 |
| Zn2+/Zn | – 0,763 | Hg 2+/Hg | + 0,851 |
| Cr3+/Cr | – 0,744 | Pd2+/Pd | +0,951 |
| Ta 3+/Ta | – 0,600 | Ir3+/Ir | +1,156 |
| Ga3+/Ga | – 0,549 | Pt2+/Pt | + 1,190 |
| Fe2+/Fe | – 0,440 | Au3+/Au | + 1,498 |
| Cd2+/Cd | – 0,403 | Au+/Au | + 1,691 |
| In3+/In | – 0,338 |
П р и л о ж е н и е 6
Варианты контрольных работ
| № варианта | Номера заданий относящихся к данной работе | |||||||||||||
| 1 | 301 | 331 | 361 | 391 | 421 | 451 | 481 | 511 | 541 | 571 | 601 | 631 | 661 | 691 |
| 2 | 302 | 332 | 362 | 392 | 422 | 452 | 482 | 512 | 542 | 572 | 602 | 632 | 662 | 692 |
| 3 | 303 | 333 | 363 | 393 | 423 | 453 | 483 | 513 | 543 | 573 | 603 | 633 | 663 | 693 |
| 4 | 304 | 334 | 364 | 394 | 424 | 454 | 484 | 514 | 544 | 574 | 604 | 634 | 664 | 694 |
| 5 | 305 | 335 | 365 | 395 | 425 | 455 | 485 | 515 | 545 | 575 | 605 | 635 | 665 | 695 |
| 6 | 306 | 336 | 366 | 396 | 426 | 456 | 486 | 516 | 546 | 576 | 606 | 636 | 666 | 696 |
| 7 | 307 | 337 | 367 | 397 | 427 | 457 | 487 | 517 | 547 | 577 | 607 | 637 | 667 | 697 |
| 8 | 308 | 338 | 368 | 398 | 428 | 458 | 488 | 518 | 548 | 578 | 608 | 638 | 668 | 698 |
| 9 | 309 | 339 | 369 | 399 | 429 | 459 | 489 | 519 | 549 | 579 | 609 | 639 | 669 | 699 |
| 10 | 310 | 340 | 370 | 400 | 430 | 460 | 490 | 520 | 550 | 580 | 610 | 640 | 670 | 700 |
| 11 | 311 | 341 | 371 | 401 | 431 | 461 | 491 | 521 | 551 | 581 | 611 | 641 | 671 | 701 |
| 12 | 312 | 342 | 372 | 402 | 432 | 462 | 492 | 522 | 552 | 582 | 612 | 642 | 672 | 702 |
| 13 | 313 | 343 | 373 | 403 | 433 | 463 | 493 | 523 | 553 | 583 | 613 | 643 | 673 | 703 |
| 14 | 314 | 344 | 374 | 404 | 434 | 464 | 494 | 524 | 554 | 584 | 614 | 644 | 674 | 704 |
| 15 | 315 | 345 | 375 | 405 | 435 | 465 | 495 | 525 | 555 | 585 | 615 | 645 | 675 | 705 |
| 16 | 316 | 346 | 376 | 406 | 436 | 466 | 496 | 526 | 556 | 586 | 616 | 646 | 676 | 706 |
| 17 | 317 | 347 | 377 | 407 | 437 | 467 | 497 | 527 | 557 | 587 | 617 | 647 | 677 | 707 |
| 18 | 318 | 348 | 378 | 408 | 438 | 468 | 498 | 528 | 558 | 588 | 618 | 648 | 678 | 708 |
| 19 | 319 | 349 | 379 | 409 | 439 | 469 | 499 | 529 | 559 | 589 | 619 | 649 | 679 | 709 |
| 20 | 320 | 350 | 380 | 410 | 440 | 470 | 500 | 530 | 560 | 590 | 620 | 650 | 680 | 710 |
| 21 | 321 | 351 | 381 | 411 | 441 | 471 | 501 | 531 | 561 | 591 | 621 | 651 | 681 | 711 |
| 22 | 322 | 352 | 382 | 412 | 442 | 472 | 502 | 532 | 562 | 592 | 622 | 652 | 682 | 712 |
| 23 | 323 | 353 | 383 | 413 | 443 | 473 | 503 | 533 | 563 | 593 | 623 | 653 | 683 | 713 |
| 24 | 324 | 354 | 384 | 414 | 444 | 474 | 504 | 534 | 564 | 594 | 624 | 654 | 684 | 714 |
| 25 | 325 | 355 | 385 | 415 | 445 | 475 | 505 | 535 | 565 | 595 | 625 | 655 | 685 | 715 |
| 26 | 326 | 356 | 386 | 416 | 446 | 476 | 506 | 536 | 566 | 596 | 626 | 656 | 686 | 716 |
| 27 | 327 | 357 | 387 | 417 | 447 | 477 | 507 | 537 | 567 | 597 | 627 | 657 | 687 | 717 |
| 28 | 328 | 358 | 388 | 418 | 448 | 478 | 508 | 538 | 568 | 598 | 628 | 658 | 688 | 718 |
| 29 | 329 | 359 | 389 | 419 | 449 | 479 | 509 | 539 | 569 | 599 | 629 | 659 | 689 | 719 |
| 30 | 330 | 360 | 390 | 420 | 450 | 480 | 510 | 540 | 570 | 600 | 630 | 660 | 690 | 720 |
| 31 | 327 | 359 | 361 | 394 | 425 | 461 | 507 | 538 | 554 | 572 | 623 | 650 | 681 | 692 |
| 32 | 301 | 358 | 362 | 395 | 424 | 462 | 506 | 518 | 555 | 574 | 625 | 640 | 672 | 698 |
| 33 | 329 | 340 | 369 | 396 | 423 | 463 | 505 | 519 | 556 | 576 | 627 | 631 | 663 | 699 |
| 34 | 328 | 359 | 380 | 397 | 422 | 473 | 504 | 520 | 548 | 578 | 629 | 641 | 687 | 710 |
| 35 | 327 | 358 | 389 | 420 | 421 | 472 | 483 | 528 | 543 | 580 | 619 | 651 | 689 | 711 |
| 36 | 326 | 357 | 388 | 419 | 450 | 471 | 482 | 519 | 547 | 582 | 617 | 632 | 690 | 712 |
| 37 | 325 | 356 | 387 | 418 | 449 | 460 | 481 | 520 | 549 | 584 | 615 | 642 | 663 | 713 |
| 38 | 324 | 355 | 386 | 417 | 448 | 479 | 500 | 521 | 550 | 586 | 614 | 652 | 665 | 714 |
| 39 | 323 | 354 | 385 | 416 | 447 | 478 | 509 | 522 | 553 | 588 | 613 | 633 | 667 | 715 |
| 40 | 322 | 353 | 384 | 415 | 446 | 477 | 508 | 523 | 555 | 590 | 601 | 644 | 669 | 716 |
| 41 | 321 | 352 | 383 | 414 | 445 | 476 | 507 | 524 | 557 | 592 | 602 | 655 | 662 | 717 |
| 42 | 320 | 351 | 382 | 413 | 444 | 475 | 506 | 525 | 559 | 594 | 603 | 636 | 661 | 718 |
| 43 | 319 | 350 | 381 | 412 | 443 | 474 | 505 | 526 | 560 | 596 | 604 | 646 | 662 | 719 |
| 44 | 318 | 349 | 380 | 411 | 442 | 473 | 504 | 527 | 562 | 598 | 605 | 656 | 663 | 720 |
| 45 | 317 | 348 | 379 | 410 | 441 | 472 | 503 | 528 | 564 | 600 | 606 | 631 | 664 | 695 |
| 46 | 316 | 347 | 378 | 409 | 440 | 471 | 487 | 529 | 541 | 571 | 607 | 632 | 665 | 697 |
| 47 | 315 | 346 | 376 | 408 | 439 | 470 | 488 | 518 | 542 | 573 | 608 | 633 | 666 | 694 |
| 48 | 314 | 345 | 375 | 407 | 438 | 469 | 489 | 530 | 543 | 575 | 609 | 634 | 667 | 692 |
| 49 | 313 | 344 | 374 | 406 | 437 | 468 | 490 | 531 | 544 | 577 | 610 | 635 | 668 | 701 |
| 50 | 312 | 343 | 373 | 405 | 436 | 467 | 491 | 532 | 545 | 579 | 611 | 636 | 669 | 702 |
| 51 | 311 | 342 | 372 | 404 | 435 | 466 | 492 | 533 | 546 | 600 | 612 | 637 | 670 | 703 |
| 52 | 310 | 341 | 371 | 403 | 434 | 465 | 493 | 534 | 547 | 581 | 613 | 638 | 671 | 704 |
| 53 | 309 | 340 | 370 | 402 | 433 | 464 | 494 | 535 | 548 | 583 | 614 | 639 | 672 | 705 |
| 54 | 308 | 339 | 369 | 401 | 432 | 463 | 495 | 536 | 549 | 585 | 615 | 640 | 673 | 706 |
| 55 | 307 | 338 | 368 | 400 | 431 | 462 | 496 | 537 | 550 | 587 | 616 | 641 | 674 | 707 |
| 56 | 306 | 337 | 367 | 399 | 430 | 461 | 497 | 538 | 551 | 589 | 617 | 642 | 675 | 708 |
| 57 | 305 | 336 | 366 | 398 | 429 | 460 | 498 | 539 | 552 | 591 | 618 | 643 | 676 | 709 |
| 58 | 304 | 335 | 365 | 397 | 428 | 459 | 499 | 540 | 553 | 593 | 619 | 644 | 677 | 690 |
| 59 | 303 | 334 | 364 | 396 | 427 | 458 | 500 | 511 | 554 | 595 | 620 | 645 | 678 | 691 |
| 60 | 302 | 333 | 363 | 395 | 426 | 457 | 501 | 512 | 555 | 597 | 621 | 646 | 679 | 692 |
| 61 | 301 | 332 | 393 | 394 | 425 | 456 | 502 | 513 | 556 | 599 | 622 | 647 | 680 | 693 |
| 62 | 303 | 331 | 392 | 394 | 435 | 460 | 503 | 514 | 557 | 571 | 623 | 648 | 681 | 694 |
| 63 | 306 | 334 | 391 | 395 | 434 | 461 | 504 | 515 | 558 | 572 | 624 | 649 | 682 | 695 |
| 64 | 309 | 335 | 381 | 396 | 423 | 462 | 505 | 516 | 559 | 573 | 625 | 650 | 683 | 696 |
| 65 | 308 | 336 | 371 | 397 | 422 | 463 | 506 | 517 | 560 | 574 | 626 | 651 | 684 | 697 |
| 66 | 304 | 337 | 372 | 398 | 421 | 464 | 507 | 518 | 561 | 575 | 627 | 652 | 685 | 698 |
| 67 | 305 | 338 | 382 | 399 | 450 | 465 | 508 | 519 | 562 | 576 | 628 | 653 | 686 | 699 |
| 68 | 316 | 339 | 390 | 400 | 449 | 466 | 509 | 521 | 563 | 577 | 629 | 654 | 687 | 700 |
| 69 | 310 | 340 | 366 | 401 | 448 | 467 | 510 | 522 | 564 | 578 | 630 | 655 | 688 | 691 |
| 70 | 315 | 341 | 368 | 402 | 447 | 468 | 501 | 523 | 565 | 600 | 601 | 656 | 689 | 692 |
| 71 | 311 | 342 | 369 | 403 | 446 | 469 | 491 | 524 | 566 | 599 | 602 | 657 | 690 | 693 |
| 72 | 314 | 343 | 371 | 404 | 445 | 470 | 493 | 525 | 567 | 598 | 603 | 658 | 681 | 694 |
| 73 | 312 | 344 | 374 | 405 | 444 | 471 | 495 | 526 | 568 | 597 | 604 | 659 | 672 | 695 |
| 74 | 313 | 345 | 375 | 406 | 443 | 472 | 486 | 527 | 569 | 596 | 605 | 660 | 663 | 696 |
| 75 | 325 | 346 | 376 | 407 | 442 | 473 | 506 | 528 | 570 | 595 | 606 | 631 | 661 | 697 |
| 76 | 324 | 347 | 378 | 408 | 441 | 474 | 507 | 529 | 541 | 594 | 607 | 637 | 668 | 698 |
| 77 | 323 | 348 | 382 | 409 | 440 | 475 | 488 | 530 | 558 | 593 | 608 | 638 | 669 | 699 |
| 78 | 322 | 349 | 383 | 410 | 439 | 476 | 489 | 531 | 559 | 592 | 609 | 639 | 670 | 700 |
| 79 | 321 | 350 | 384 | 411 | 438 | 477 | 490 | 532 | 560 | 591 | 610 | 640 | 671 | 701 |
| 80 | 320 | 351 | 385 | 412 | 437 | 478 | 491 | 533 | 561 | 590 | 611 | 641 | 672 | 702 |
| 81 | 319 | 352 | 387 | 413 | 436 | 479 | 492 | 534 | 562 | 589 | 612 | 642 | 673 | 703 |
| 82 | 318 | 353 | 389 | 414 | 435 | 480 | 493 | 535 | 563 | 588 | 613 | 643 | 674 | 704 |
| 83 | 317 | 354 | 381 | 415 | 434 | 463 | 494 | 536 | 564 | 587 | 614 | 644 | 675 | 705 |
| 84 | 316 | 355 | 383 | 416 | 433 | 472 | 495 | 537 | 565 | 586 | 615 | 645 | 676 | 706 |
| 85 | 315 | 356 | 385 | 417 | 432 | 466 | 496 | 538 | 566 | 585 | 616 | 646 | 677 | 707 |
| 86 | 314 | 357 | 377 | 418 | 431 | 474 | 497 | 539 | 567 | 584 | 617 | 647 | 678 | 708 |
| 87 | 313 | 358 | 379 | 419 | 430 | 475 | 498 | 540 | 568 | 583 | 618 | 648 | 679 | 709 |
| 88 | 312 | 359 | 370 | 420 | 429 | 456 | 499 | 511 | 569 | 582 | 619 | 649 | 680 | 710 |
| 89 | 311 | 360 | 368 | 421 | 428 | 459 | 500 | 512 | 570 | 581 | 620 | 650 | 681 | 711 |
| 90 | 310 | 336 | 366 | 422 | 427 | 457 | 501 | 513 | 542 | 580 | 621 | 651 | 682 | 712 |
| 91 | 331 | 345 | 364 | 423 | 426 | 458 | 502 | 514 | 543 | 579 | 622 | 652 | 683 | 713 |
| 92 | 328 | 332 | 382 | 424 | 425 | 459 | 503 | 515 | 544 | 578 | 623 | 653 | 684 | 714 |
| 93 | 326 | 334 | 390 | 423 | 427 | 460 | 504 | 516 | 545 | 577 | 624 | 654 | 685 | 715 |
| 94 | 325 | 338 | 378 | 422 | 423 | 461 | 505 | 517 | 547 | 576 | 625 | 655 | 686 | 716 |
| 95 | 324 | 340 | 386 | 421 | 436 | 462 | 506 | 518 | 549 | 575 | 626 | 656 | 687 | 717 |
| 96 | 329 | 342 | 384 | 394 | 448 | 463 | 507 | 519 | 550 | 574 | 627 | 657 | 688 | 718 |
| 97 | 327 | 344 | 372 | 400 | 449 | 464 | 508 | 520 | 551 | 573 | 628 | 658 | 689 | 719 |
| 98 | 330 | 346 | 390 | 409 | 450 | 465 | 509 | 521 | 552 | 572 | 629 | 659 | 662 | 720 |
| 99 | 324 | 348 | 365 | 410 | 441 | 466 | 510 | 522 | 553 | 571 | 630 | 660 | 690 | 691 |
Список литературы
1. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособие. – М.: Интеграл-Пресс, 2001.
2. Задачи и упражнения по общей химии: Учеб. пособие / Под ред. Н.В. Коровина. – М.: Высш. шк., 2003.
3. Задачи по общей и неорганической химии: Учеб. пособие для студ. высш. учеб. заведений / Под ред. Р.А. Лидина. – М.: ВЛАДОС, 2004.
4. Задачник по общей химии для металлургов / Под ред. Б.Г. Коршунова. – М.: Высш. шк., 1977.
5. Литвинова Т.Н. Сборник задач по общей химии: Учеб. пособие. – М., 2007.
6. Михилев Л.А., Пасет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии: Учеб. пособие. – СПб.: Химия, 1995.
7. Морачевский А.Г., Патров Б.В., Сладков И.Б. Сборник примеров и задач по физической химии. – Л.: ЛПИ им. М.И. Калинина, 1974.
8. Романцева Л.М., Лещинская З.И., Суханова В.А. Сборник задач и упражнений по общей химии: Учеб. пособие. – М.: Высш. шк., 1991.
9. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004.
10. Котенко Г.А., Ульянова О.В. Программа и контрольные задания по дисциплине «Поверхностные явления и дисперсные системы» для студентов заочной формы обучения: Учеб.-метод. пособие. – Череповец: ЧГУ, 2005.
11. Калько О.А., Кузнецова Ю.С., Кунина Н.В. Неорганическая химия. Сборник задач, часть 2: Учеб.-метод. пособие. – Череповец: ЧГУ, 2010.
12. Калько О.А., Кузнецова Ю.С., Ульянова О.В. Химия: Растворы. Дисперсные системы: Учеб. пособие. — Череповец: ФГБОУ ВПО ЧГУ, 2014.
13. Краткий справочник физико-химических величин / Под ред. А.А. Равделя и А.М. Пономаревой – СПб.: «Иван Федоров», 2008.
Оглавление
Введение .......................................................................................... 3
Способы выражения состава растворов ....................................... 3
Коллигативные свойства растворов неэлектролитов ..................... 6
Коллигативные свойства растворов электролитов ...................... 10
Свойства растворов слабых и сильных электролитов .................. 13
Ионное произведение воды. рН растворов ................................... 16
Произведение растворимости ........................................................ 19
Гидролиз солей ............................................................................... 22
Дисперсные системы ....................................................................... 25
Окислительно-восстановительные реакции ................................... 28
Гальванические элементы ............................................................... 32
Электролиз ...................................................................................... 36
Коррозия металлов ........................................................................ 39
Жесткость воды ............................................................................... 43
Элементы органической химии ...................................................... 46
Приложения .................................................................................... 50
Список литературы ........................................................................ 62
ФГБОУ ВО
«ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Инженерно-технический институт

Дата: 2019-02-25, просмотров: 587.