●Закон Бойля-Мариотта
 при
при  ,
,
где p – давление; V – объем; Т – термодинамическая температура; m – масса газа.
● Закон Гей-Люссака и закон Шарля
 , или
, или  при
при  ;
;
 , или
, или  при
при  ,
,
где t – температура по шкале Цельсия;  и
и 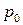 - соответственно объем и давление при 00 С; коэффициент
- соответственно объем и давление при 00 С; коэффициент  ; индексы 1 и 2 относятся к произвольным состояниям.
; индексы 1 и 2 относятся к произвольным состояниям.
● Закон Дальтона для давления смеси n идеальных газов
 ,
,
где  - парциальное давление i – го компонента смеси.
- парциальное давление i – го компонента смеси.
● Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
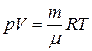 ,
,
где  – газовая постоянная, μ – молярная масса газа.
– газовая постоянная, μ – молярная масса газа.
● Зависимость давления газа от концентрации n молекул и температуры Т
 ,
,
где  – постоянная Больцмана ( k=R/Na ,
– постоянная Больцмана ( k=R/Na ,  – постоянная Авогадро).
– постоянная Авогадро).
● Основное уравнение молекулярно-кинетической теории идеальных газов
 ,
,
или
 ,
,
или
 ,
,
где  - средняя квадратичная скорость молекул; Е- суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул;
- средняя квадратичная скорость молекул; Е- суммарная кинетическая энергия поступательного движения всех молекул газа; n- концентрация молекул;  - масса одной молекулы;
- масса одной молекулы; 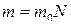 - масса газа; N- число молекул в объеме газа V.
- масса газа; N- число молекул в объеме газа V.
● Скорость молекул:
наиболее вероятная
 ;
;
средняя квадратичная
 ;
;
средняя арифметическая
 .
.
● Средняя кинетическая энергия поступательного движения молекулы идеального газа
 .
.
● Закон Максвелла для распределения молекул идеального газа по скоростям
 ,
,
где функция  (
(  ) распределения молекул по скоростям определяет относительное число молекул
) распределения молекул по скоростям определяет относительное число молекул  из общего числа N молекул, скорости которых лежат в интервале от
из общего числа N молекул, скорости которых лежат в интервале от  до
до  .
.
● Закон Максвелла для распределения молекул идеального газа по энергиям теплового движения
 ,
,
где функция f(ε) распределения молекул по энергиям теплового движения определяет относительное число молекул 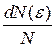 из общего числа N молекул, которые имеют кинетические энергии
из общего числа N молекул, которые имеют кинетические энергии  , заключенные в интервале от ε до ε+dε.
, заключенные в интервале от ε до ε+dε.
● Барометрическая формула
 ,
,
где  и
и 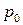 – давление газа на высоте h и h0.
– давление газа на высоте h и h0.
● Распределение Больцмана во внешнем потенциальном поле
 ,
,
где n и n0 – концентрация молекул на высоте h и h0 .
● Среднее число соударений, испытываемых молекулой газа за 1 секунду,
 ,
,
где d –эффективный диаметр молекулы; n – концентрация молекул;  - средняя арифметическая скорость молекул.
- средняя арифметическая скорость молекул.
● Средняя длина свободного пробега молекул газа
 .
.
● закон теплопроводности Фурье
 ,
,
где Q теплота, прошедшая посредством теплопроводности через площадь S за время t;  - градиент температуры; λ- теплопроводность:
- градиент температуры; λ- теплопроводность:
 ,
,
где сv – удельная теплоемкость газа при постоянном объеме; ρ- плотность газа.
● Закон диффузии Фика
 ,
,
где М – масса вещества, переносимая посредством диффузии через площадь S за время t;  - градиент плотности, D – диффузия:
- градиент плотности, D – диффузия:
 .
.
● Закон Ньютона для внутреннего трения (вязкости)
 ,
,
где F – сила внутреннего трения между движущимися слоями площадью S;
 - градиент скорости; η – динамическая вязкость:
- градиент скорости; η – динамическая вязкость:
 .
.
Основы термодинамики
● Средняя кинетическая энергия поступательного движения, приходящаяся на одну степень свободы молекулы,
 .
.
● Средняя энергия молекулы
 ,
,
где  - число степеней свободы.
- число степеней свободы.
● Внутренняя энергия газа
 ,
,
где  – количества вещества; m – масса газа; μ – молярная масса газа.
– количества вещества; m – масса газа; μ – молярная масса газа.
● Первое начало термодинамики
 ,
,
где Q – количество теплоты, сообщенное системе или отданное ею;  - изменение её внутренней энергии; А – работа системы против внешних сил.
- изменение её внутренней энергии; А – работа системы против внешних сил.
● Первое начало термодинамики для малого изменения системы
 .
.
● Молярные теплоемкости газа при постоянном объеме и постоянном давлении
 ,
,  .
.
● Уравнение Р. Майера, для 1 моля идеального газа
 .
.
● Изменение внутренней энергии идеального газа
 .
.
● Работа, совершаемая газом при изменении его объема,
 .
.
● Полная работа при изменении объема газа
 ,
,
где V1 и V2 – соответственно начальный и конечный объемы газа.
● Работа газа:
при изобарном процессе
 , или
, или  ;
;
при изотермическом процессе
 , или
, или  .
.
● Уравнение адиабатического процесса (уравнение Пуассона)

где  - показатель адиабаты.
- показатель адиабаты.
● Работа в случае адиабатического процесса
 или
или  ,
,
где T1 , T2 и V1, V2 – соответственно начальные и конечные температура и объем газа.
● Термический коэффициент полезного действия для кругового процесса (цикла)
 ,
,
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой; А – работа, совершаемая за цикл.
● Термический коэффициент полезного действия цикла Карно
 ,
,
где T1 – температура нагревателя; T2 – температура холодильника.
● Изменение энтропии при равновесном переходе из состояния 1 в состояние 2, в переменных Р V
 .
.
Дата: 2018-12-28, просмотров: 654.