Ионы
Ионная сила раствора, μ
Контрольные вопросы и задания по теме занятия
1. Что такое сильные и слабые электролиты? Что называют электролитической диссоциацией? В чем сущность теории Аррениуса, понятия о степени диссоциации?
2. Что называют общей концентрацией ионов в раствор? Что называют активностью ионов и электролитов? Что называют коэффициентом активности?
3. Что такое ионная сила раствора? В чем заключается расчет ионной силы раствора для электролитов типа КА, КА2, К3А?
4. В чем заключается влияние ионной силы раствора на коэффициенты активности и рН водных растворов электролитов?
5. Что называют химическим равновесием? В чем заключается принцип Ле-Шателье?
6. Что называют константой химического равновесия? В чем отличия концентрационной и термодинамической констант?
7. В чем сущность аналитических реакций катионов II аналитической группы?
8. В чем сущность систематического анализа смеси катионов II аналитической группы?
Основная литература:
1. Аналитическая химия (аналитика). Общие теоретические основы. Качественный анализ. [Текст]: учеб. для вузов / Ю.Я. Харитонов [и др.]. - М.: Высш. шк., 2008. – 54 – 68 с.
Дополнительная литература:
1. Аналитическая химия [Текст] / Г. Кристиан [и др.]. - М.: БИНОМ. Лаборатория знаний, 2008. – 299 – 305 с.
Тема 5
Гетерогенные равновесия в системе осадок - насыщенный раствор малорастворимого электролита и их роль в аналитической химии
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Лабораторная работа № 3 “Качественные реакции катионов III аналитической группы: Ca 2+ , Sr 2+ , Ba 2+ . Анализ смеси катионов III группы”
5. Подведение итогов занятия
УЧЕБНЫЕ ЭЛЕМЕНЫ ТЕМЫ
Под растворимостью обычно подразумевают концентрацию насыщенного раствора данного вещества при определенной температуре. Используют различные способы выражения растворимости, например, массовую растворимость вещества с m , молярную растворимость вещества S и др.
Растворимость

массовая (сm) молярная (S)
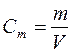
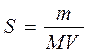
Массовая растворимость вещества с m – это масса растворенного вещества в граммах, содержащаяся в одном литре его насыщенного раствора:
c = m / V
где m – масса растворенного вещества, г;
V – объем насыщенного раствора, л.
Массовая растворимость вещества выражается в [г/л].
Молярная растворимость вещества S – это количество растворенного вещества (т.е. число молей этого вещества), содержащееся в одном литре его насыщенного раствора:
S = m /( MV )
Где m – масса растворенного вещества, г;
М – молярная масса растворенного вещества в г/моль;
V – объем насыщенного раствора, л. молярная растворимость вещества выражается в [моль/л].
Произведение растворимости малорастворимого сильного электролита – это величина, равная произведению равновесных активностей (или равновесных концентраций) ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам. Применимо к сильным электролитам, у которых молярная растворимость S < 10-2 моль/л. Обозначается символами ПР, L , Ks 0 и т.д. мы в дальнейшем будем обозначать произведение растворимости символом Ks 0.
Произведение растворимости
Ks0 = const при постоянной температуре
BaSO4(тв) ↔ Ba2+(р-р) + SO42-(р-р)
Рассмотрим гетерогенное равновесие в водной среде.
Для данного химического равновесия можно написать выражение истинной термодинамической константы химического равновесия.
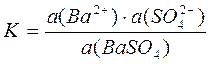
При постоянной температуре константа химического равновесия постоянная величина (K=const)
Активность чистого твердого вещества принимается постоянной и равной единице.
a(BaSO4) = const = 1 → K·a(BaSO4) = const
(как произведение двух постоянных величин)
Ks0(BaSO4) = a(Ba2+)·a(SO42-) = const
В чистой воде растворимость BaSO4 мала, поэтому
f(Ba2+) ≈ 1; f(SO42-) ≈ 1
Поэтому мы можем записать:
Ks0 = [Ba2+]·[SO42-]
Связь произведения растворимости с молярной растворимостью сильного электролита.
Например:
а) Произведение растворимости сульфата бария для водных растворов.
В гетерогенной системе, состоящей из находящихся в равновесии осадка сульфата бария и его насыщенного раствора, устанавливается гетерогенное равновесие
BaSO 4 = Ba 2+ + SO 2- 4 (в растворе)
Сульфат бария – сильный электролит. В водном растворе он полностью распадается на ионы. Непродиссоциировавшие молекулы BaSO4 в водном растворе не существуют. По определению:
Ks0(BaSO4) = a(Ba2+)a(SO2-4) = [Ba2+][SO2-4]f(Ba2+)f(SO2-4).
Так как растворимость сульфата бария в воде мала (S ~ 10-5 моль/л), то концентрация ионов бария и сульфат-ионов ничтожно мала → их коэффициенты активности практически равны единице. Тогда K0s(BaSO4) = [Ba2+][SO2-4]. При комнатной температуре K0s (BaSO4) = 1,1*10-10.
Если молярная растворимость S(BaSO4) = S, Ks0 = [Ba2+][SO2-4] = S*S = =S2.
б) Произведение растворимости ортофосфата бария Ba 3 ( PO 4 )2 для водных растворов.
Ba 3 ( PO 4 )2(т) = 3 Ba 2+ + 2 PO 3- 4 (в растворе)
Ks0[Ba3(PO4)2] = a(Ba2+)3a(PO3-4)2 = [Ba2+]3[PO3-4]2f(Ba2+)3f(PO3-4)2.
При малых концентрациях ионов f(Ba2+) ≈ 1, f(PO3-4) ≈ 1. Тогда Ks0 = =[Ba2+]3[PO3-4]2. Эта величина равна 6*10-39 при комнатной температуре.
Если S(Ba3(PO4)2) = S,
то Ks0 = [Ba2+]3[PO3-4] = (3S)3*(2S)2 = 27S3*4S2 = 108S5.
Условие образования осадков малорастворимых сильных электролитов.
Рассмотрим электролит условного состава КnAm.
Для электролитов вводят понятие:
Ионное произведение – это произведение концентрации катионов на концентрацию анионов какого-либо электролита, возведенное в степень их стехиометрических коэффициентов.
Для электролита КnAm, состоящего из n катионов Кm+ и m An- ионное произведение больше ПР, т.е:
Cn ( Km + )· Cm ( An - ) > Ks 0 , KnAm условие образования осадка (1)
Осадок будет выпадать до тех пор, пока концентрации ионов станут равными их концентрации в насыщенном растворе, то есть, до тех пор, пока ионное произведение не станет равным Ks.
Например:
а) Ks0(AgCNS) = 1,1*10-12. Осадок выпадает, если C(Ag+)*C(SCN-) > 1,1*10-12.
б) Ks0(Ca3(PO4)2) = 2,0 10-29 . Осадок выпадает, если C3(Ca2+)*C2(PO43-) > 2,0*10-29.
Если ионное произведение < Ks, то осадок не выпадает.
Дата: 2019-02-02, просмотров: 491.