| Тип гибридизации | Расположение гибридных АО | Угол между связями | Коли- чество Ё | Геометрическая форма и состав молекулы | Пример |
| sp | Линейное | 180° | 0 | Линейная АВ2 | BeCl2 |
| sd | Линейное | 90° | 0 | Угловая АВ2 | SrCl2 |
| sp2 или sd2 | Треугольное | 120° Уменьшается | 0 1 | Треугольник АВ3 Угловая АВ2Ё | BF3 SnCl2 |
| sp3 или sd3 | Тетраэд-рическое | 109°28/ Уменьшается Уменьшается | 0 1 2 | Тетраэдр АВ4 Тригональная пирамида АВ3Ё Угловая АВ2Ё2 | CH4 NF3 H2O |
| sp3d | Тригональнобипирамидальное | 90 и 120° – 180 и 90° 180° | 0 1 2 3 | Тригональная бипирамида АВ5 Неправильный тетраэдр АВ4Ё Т-образная АВ3Ё2 Линейная АВ2Ё3 | PCl5 SF4 ClF3 XeF2 |
| sp3d2 | Октаэдри-ческое | 90° 90° 90° | 0 1 2 | Октаэдр АВ6 Тригональная бипирамида АВ5Ё Квадрат АВ4Ё2 | SF6
SbF 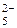 XeF4
XeF4
|
| sp3d3 или sp3d2f | Пентагональнобипирамидальное | – – | 0 1 | Пентагональная бипирамида АВ7 Неправильный октаэдр АВ6Ё | IF7 XeF6 |
При образовании КС между атомами одинаковой химической природы (например, в молекулах Н2, Cl2, О2) общее электронное облако располагается в пространстве между ядрами симметрично. Такую КС называют неполярной. Если же связь образуют атомы разных элементов, то общие электроны смещаются в сторону атома с большим значением ЭО и такую КС называют полярной. Смещение электронной плотности в область более электроотрицательного элемента приводит к возникновению в его околоядерном пространстве эффективного отрицательного заряда q–, и, наоборот, недостаток электронной плотности у взаимодействующего с ним атома ведет к появлению эффективного положительного заряда q+. Такая система представляет собой электрический диполь, поэтому мерой полярности КС является величина электрического момента диполя (ЭМД) связи mА–В,
Кл · м, которую можно оценить по формуле
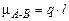 , (16)
, (16)
где l – длина диполя. При оценочных расчетах длину диполя можно принимать равной длине связи.
ЭМД можно также выражать в дебаях (D): 1 D =
= 3,33 × 10-30 Кл × м.
Полярную КС характеризуют при помощи степени ионности (СИ) и степени ковалентности (СК) связи, которые в сумме составляют 100 % (СИ + СК = 100 %). СИ показывает долю (%) смещенности общей электронной пары в область атома с большим значением ЭО. Ее можно оценить по формуле
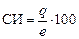 % , (17)
% , (17)
где е – заряд электрона (е = 1,602 × 10-19 Кл).
Из уравнения (17) следует, что с увеличением DЭО взаимодействующих атомов СИ связи увеличивается, а СК связи уменьшается. Количественная связь между СИ и DЭО приведена на рис. 1.
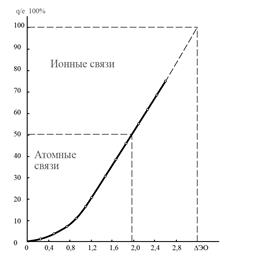
Рис. 1. Зависимость СИ от ΔЭО
mА–В – величина векторная, направленная от положительного полюса диполя к отрицательному. Например, в молекуле HF mН®F будет направлен от атома водорода к атому фтора, так как ЭО(F) >
> ЭО(Н) (см. табл. 4).
Молекулы с полярными КС, в зависимости от распределения суммарной электронной плотности всех связей в молекуле, могут быть полярными и неполярными. Молекула считается неполярной, если ЭМД молекулы m 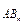 , который определяется путем геометрического сложения ЭМД всех ее связей, равен нулю.
, который определяется путем геометрического сложения ЭМД всех ее связей, равен нулю.
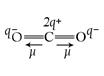
Например, в молекуле СО2 (см. рис. 2, б), которая имеет симметричное линейное строение, ЭМД отдельных связей направлены в противоположные стороны и при их геометрическом сложении полностью компенсируют друг друга. Поэтому m 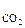 = 0 и молекула СО2 является неполярной.
= 0 и молекула СО2 является неполярной.
В полярной молекуле m 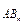 > 0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m
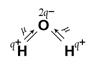
> 0, то есть геометрическое сложение векторов ЭМД связей дает конечный вектор m 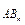 . Например, в угловой молекуле Н2О (см. рис. 2, а) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации (m
. Например, в угловой молекуле Н2О (см. рис. 2, а) полярные связи располагаются под углом 104,5°. При геометрическом сложении ЭМД связей не происходит их взаимной компенсации (m 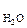 > 0, молекула полярная).
> 0, молекула полярная).
а) б)
Рис. 2. Векторное сложение ЭМД на примере молекул Н2О и СО2
В табл. 6 приведены предполагаемые полярности молекул различной геометрической формы.
По методу молекулярных орбиталей (ММО) молекула рассматривается как единое целое – ядра атомов составляют каркас молекулы, а электроны атомов становятся общими для всей молекулы и располагаются на молекулярных орбиталях (МО). Метод основан на следующих положениях:
1. МО образуются путем линейной комбинации АО, т. е. путем сложения или вычитания исходных АО – метод линейной комбинации АО (ЛКАО).
По методу ЛКАО, если МО образуется в результате сложения АО, её энергия будет ниже, чем энергия исходных АО. Такая орбиталь называется связывающей МО (обозначается s, p или d в зависимости от типа перекрывания электронных облаков). В случае вычитания АО возникающая МО имеет более высокое значение энергии, чем исходная АО, и называется разрыхляющей (обозначается s*, p* или d*). Электрон, находящийся на связывающей МО, обеспечивает связь между атомами, а электрон, находящийся на разрыхляющей МО, ослабляет связь между атомами;
2. При заполнении электронами МО выполняются принцип Паули и правило Гунда;
3. Число МО равно числу взаимодействующих АО реагирующих атомов. Например, при взаимодействии двух АО со стороны каждого атома в молекуле типа А2 образуется четыре МО, из которых две – связывающие и две – разрыхляющие;
4. По возрастанию энергий МО двухатомных молекул первого периода и начала второго периода (до N2 включительно) можно расположить в следующий ряд: σ 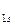 < σ
< σ 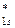 < σ
< σ 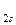 < σ
< σ 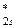 < π
< π 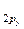 =
=
= π 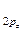 < σ
< σ 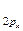 < π
< π 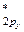 = π
= π 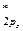 < σ
< σ 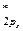 .
.
МО двухатомных молекул конца второго периода (от О2 и далее) по возрастанию энергий располагаются в несколько иной ряд:
σ 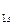 < σ
< σ 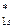 < σ
< σ 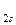 < σ
< σ 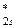 < σ
< σ 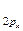 < π
< π 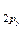 = π
= π 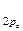 < π
< π 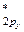 = π
= π 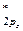 < σ
< σ 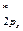 .
.
Таблица 6
Дата: 2018-12-28, просмотров: 374.