| Значение l | 0 | 1 | 2 | 3 |
| Форма электронного облака | 
| 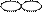
| 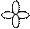
| 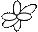
|
| Подуровень | s | p | d | f |
| Число АО | 1 | 3 | 5 | 7 |
| Графическая схема подуровня | 
| 
| 
| 
|
| Значения ml | 0 | –1, 0,+1 | –2,–1,0,+1,+2 | –3,–2,–1, +1,+2,+3 |
Электроны в атоме заполняют АО в соответствии со следующими принципами и правилами:
1. Принцип минимальной энергии: электроны в атоме стремятся занять в первую очередь те АО, которым соответствует наименьшее значение энергии электрона.
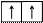 2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными), а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).
2. Правило Хунда (Гунда): в пределах одного подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Это означает, что в первую очередь электроны заполняют все свободные АО подуровня по одному, имея при этом одинаково направленные спины (их называют параллельными), а затем происходит заполнение этих АО вторыми (парными) электронами (их называют антипараллельными).

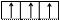

 3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms
3. Принцип Паули: на одной АО может находиться не более двух электронов, отличающихся друг от друга значением ms
( ). Таким образом, максимальное число электронов на любом s-подуровне равно 2 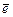 (в электронной формуле соответствует записи ns2), p-подуровне – 6
(в электронной формуле соответствует записи ns2), p-подуровне – 6  (np6), d-подуровне – 10
(np6), d-подуровне – 10 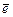 [(n – 1)´ ´d10], f-подуровне – 14
[(n – 1)´ ´d10], f-подуровне – 14  [(n – 2)f 14].
[(n – 2)f 14].
4. Правило Клечковского: с ростом атомного номера элемента электроны размещаются на АО последовательно по мере возрастания суммы (n + l); при одинаковых значениях этой суммы раньше заполняется АО с меньшим значением числа n .
Например: 4s-орбиталь заполняется электронами раньше, чем 3d, потому что для 4s сумма (n + l) равна (4 + 0) = 4, а для 3d она равна (3 + 2) = 5.
По правилу Клечковского заполнение энергетических уровней в основном соответствует следующему ряду: 1s , 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p и т.д.
У некоторых элементов ПС заполнение АО электронами происходит с нарушением правила Клечковского. Например: в соответствии с данным правилом электронная формула 29Cu должна заканчиваться …4s23d 9, а на самом деле она имеет вид …4s13d10. Таким образом, один электрон с внешнего 4s подуровня перешел («провалился») на внутренний 3d подуровень и завершил его формирование (число электронов достигло максимума – 10  ). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
). Этот и другие подобные факты связаны с тем, что полностью и наполовину заполненным подуровням соответствуют более выгодные с точки зрения энергии электронные конфигурации (они легче возникают и их сложнее разрушить).
При отрыве электронов от атома он превращается в положительно заряженный ион – катион, заряд которого равен числу отнятых электронов. Присоединение же электронов к атому приводит к образованию отрицательного иона – аниона, заряд которого равен количеству принятых электронов. При образовании катионов электроны в первую очередь покидают внешний энергетический уровень, а при образовании анионов размещаются на уровнях с соблюдением правила Клечковского.
Электроны внешнего энергетического уровня и отдельных подуровней второго (а для лантаноидов и актиноидов – третьего) от конца электронного слоя, на которых количество электронов не достигло максимального значения, называются валентными.
Элементы, в атомах которых валентными являются только s-орбитали, относятся к семейству s-элементов; элементы, в которых кроме s-орбиталей валентными являются также и p-орбитали, относятся к семейству p-элементов и т.д.
Способность атомов терять или присоединять электроны определяет химическую активность соответствующего элемента. Эту способность характеризуют при помощи следующих основных свойств атомов:
1. Энергия ионизации I – энергия, необходимая для удаления
1 моль электронов от 1 моль атомов какого-либо элемента. Ее измеряют в кДж/моль или в электрон-вольтах (1 эВ = 1,6 ´
´ 10-19 Дж). Отрыву первого электрона от нейтрального атома соответствует первая энергия ионизации I1, отрыву второго, третьего и т. д. электронов соответствует вторая I2, третья I3 и
т. д. энергии ионизации. При переходе от I1 к I2, I3 и т.д. энергия ионизации увеличивается. Наименьшее напряжение электрического поля, при котором происходит отрыв электрона, называется потенциалом ионизации. Его численное значение равно энергии ионизации (в эВ).
Энергия ионизации характеризует восстановительную способность элемента. Чем меньше значение I, тем более сильным восстановителем является атом. В периодах с увеличением порядкового номера элемента (слева направо) I1 имеет общую тенденцию к росту. Однако у электронных конфигураций, имеющих полностью или наполовину сформированные валентные подуровни, проявляются локальные максимумы значений I1.
Например, во втором периоде при переходе от N7: 1s22s22p3 к О8:1s22s22p4 порядковый номер увеличивается, а первая энергия ионизации уменьшается от 14,53 эВ у азота до 13,61 эВ у кислорода.
В общем случае локальные максимумы значений I1 следует ожидать у атомов, чья электронная формула заканчивается …ns2, …np3, …np6, …(n – 1) d 5, …, (n – 1) d 10 и т. д.
Общие тенденции изменения значения I1 и некоторых других свойств атомов в периодах и группах приведены в табл. 3.
Таблица 3
Зависимость некоторых свойств элементов и их соединений от Z
| Свойства | Изменение свойств элементов с ростом Z | |
| В периодах (слева направо) | В главных подгруппах (сверху вниз) | |
| Первая энергия ионизации I1* | Увеличивается | Уменьшается |
| Сродство к электрону F * | ||
| Относительная ЭО | ||
| Орбитальный радиус r | Уменьшается | Увеличивается |
| Окислительные | Усиливаются | Ослабевают |
| Неметаллические | ||
| Кислотный характер соединений | ||
| Восстановительные | Ослабевают | Усиливаются |
| Металлические | ||
| Основной характер соединений | ||
| Плотность простых веществ | Увеличивается | Возрастает по схеме I IV ® VIII |
| Температуры кипения металлов | – | Уменьшается |
| Способность к комплексообразованию (для d-элементов) | Усиливается | Усиливается в побочных подгруппах |
| Растворимость гидроксидов | От типичных металлов к амфотерным элементам убывает | |
 |
* Изменение свойства в периодах не монотонное, имеются локальные максимумы.
2. Сродство к электрону F (Дж/моль или эВ) – это энергия, которая выделяется при присоединении 1 моль электронов к
1 моль атомов. Данное свойство атома характеризует его окислительную способность: чем больше значение F , тем сильнее выражены окислительные свойства атома. В группах с увеличением порядкового номера элемента энергия сродства к электрону уменьшается, а в периодах – возрастает, но не монотонно. Локальные максимумы значений F смещены на один элемент влево по сравнению с энергией ионизации атома. Наибольшими значениями F обладают элементы VII (А) группы, а у большинства металлов и у благородных газов сродство к электрону невелико или отрицательно.
3. Электроотрицательность (ЭО) характеризует способность атомов притягивать к себе электроны. Эта величина имеет условный характер, так как способность атома притягивать электроны зависит от типа соединения и валентного состояния элемента.
По относительной шкале электроотрицательностей Л. Полинга абсолютная ЭО атома лития принята равной 1, а ЭО остальных атомов отнесены к значению абсолютной ЭО(Li). По этой шкале максимальным значением ЭО, равным четырем, обладает атом фтора. Значения относительной ЭО некоторых элементов приведены в табл. 4. Общая тенденция изменения относительной ЭО атомов в периодах и группах ПС приведена в табл. 3.
Так как движение электрона имеет волновой характер, то невозможно оценить абсолютные размеры атомов. Поэтому на практике пользуются их условными размерами: орбитальным радиусом и эффективным радиусом.
Орбитальный радиус r – это теоретически рассчитанное расстояние от ядра до главного максимума электронной плотности внешней АО. Эффективные радиусы rэф атомов оценивают по экспериментальным данным как ½ расстояния между центрами смежных атомов в кристалле. Эффективные радиусы rэф затруднительно сравнивать между собой, так как на их значения оказывают влияние различные факторы (структура вещества, характер связи, СО элемента и т. д.). Периодичность изменения орбитальных радиусов атомов приведена в табл. 3.
При образовании катиона радиус r частицы уменьшается по сравнению с размером атома, причем чем больше заряд катиона, тем меньше радиус. В случае образования аниона орбитальный радиус частицы возрастает тем больше, чем выше отрицательный заряд иона.
Таблица 4
Дата: 2018-12-28, просмотров: 423.