ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общематематических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ)
Часть 1
Учебно-методическое пособие
Череповец
2005
Примеры решения задач по дисциплине «Общая и неорганическая химия» (для студентов заочной формы обучения). Ч. 1: Учеб.-метод. пособие. - Череповец: ГОУ ВПО ЧГУ, 2005. – 61 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 10.06.05.
Одобрено редакционно-издательской комиссией факультета общематематических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 5 от 14.06.05.
Составители: О.А. Калько – канд. техн. наук, доцент;
Н.В. Кунина
Рецензенты: Г.В. Козлова – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Т.А. Окунева (ГОУ ВПО ЧГУ)
Научный редактор: Г.В. Козлова – канд. хим. наук, доцент
© Калько О.А., Кунина Н.В., 2005
© ГОУ ВПО Череповецкий государст-
 венный университет, 2005
венный университет, 2005

ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по следующим разделам курса «Общая и неорганическая химия»: основные законы химии; строение атома и периодичность изменения свойств элементов; химическая связь и строение молекул. Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства при выполнении домашних контрольных работ. Оно также будет полезным при подготовке к экзамену или зачету. Для более глубокого изучения дисциплины необходимо также ознакомиться с соответствующими разделами учебников, рекомендуемых в программе курса. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Математически закон эквивалентов для условной реакции вида
А + В ® С + D
можно выразить различными способами. Например:
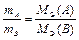 или
или 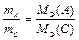 . (13)
. (13)
Если в реакции участвуют газообразные вещества, то закон эквивалентов целесообразнее записать как соотношение объемов
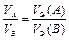 . (13а)
. (13а)
Наконец, когда один из участников реакции – газ, а другой – твердый реагент, то формула, выражающая закон эквивалентов, принимает вид
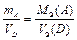 . (13б)
. (13б)
Примеры решения задач
Пример 1. Определите, сколько молекул СО образуется при сгорании 4 мг углерода. Чему равна абсолютная масса одной молекулы кислорода?
Р е ш е н и е
Составим уравнение реакции горения углерода с образованием СО:
2С + О2 = 2СО ,
из которого следует, что при сгорании 2 моль углерода образует
ся 2 моль газа СО. Используем формулу (2) для определения количества моль углерода, которое будет равно числу моль СО:
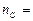
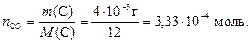
Тогда число молекул оксида углерода (II) найдем по формуле (1):
 NСО = nCO × NA = 3,33 ×10-4 × 6,02 × 1023 = 2,00 × 1020 .
NСО = nCO × NA = 3,33 ×10-4 × 6,02 × 1023 = 2,00 × 1020 .
Рассчитаем относительную молекулярную массу молекулы O2
Mr = 2× Ar(O) = 2×16 = 32 а. е. м.
Так как Mr и масса 1 моль вещества численно равны друг
другу, то
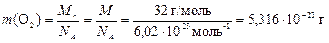 .
.
Ответ: NСО = 2×1020; 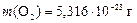 .
.
Пример 2. Сколько моль атомов азота содержится в 1 кг нитрата аммония? Определите массовую долю азота в данной соли.
Р е ш е н и е
Определяем молярную массу нитрата аммония NH4NO3 :
М = 2 Ar(N) + 4 Ar(H) + 3 Ar(O) = 2 × 14 + 4 × 1 + 3 × 16 =
= 80 г/моль.
Из формулы вещества NH4NO3 следует, что 1 моль нитрата аммония содержит 2 моль атомов азота, тогда
n(N) = 2 × nнитрата = 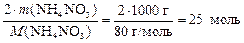 .
.
Массовую долю азота найдем как отношение двух А r(N) к молярной массе NH4NO3:
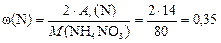 или 35 % мас.
или 35 % мас.
Ответ: число моль атомов азота равно 25 моль; w (N) = = 35 % мас.
Пример 3. Выразите в молях и в граммах 6,02 × 1021 молекул СО2.
Р е ш е н и е
Находим число моль молекул СО2 :
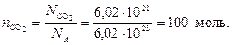
Определяем массу 100 моль молекул диоксида углерода
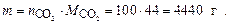
Ответ: nСО2 = 100 моль; масса CO2 равна 4400 г.
Пример 4. Массовая доля фосфора в его оксиде равна 43,7 % мас. Установите простейшую формулу оксида.
Р е ш е н и е
Обозначим числа атомов фосфора и кислорода в простейшей формуле оксида через х и у. А r данных элементов равны 31 и 16. Значит, массы фосфора и кислорода в составе оксида относятся друг к другу как 31х :16у. По условию задачи в 100 г оксида содержится 43,7 г фосфора и (100 – 43,7) = 56,3 г кислорода. Следовательно,
31х : 16у = 43,7: 56,3 или х : у = 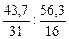 = 1,41 : 3,52.
= 1,41 : 3,52.
Чтобы выразить полученное соотношение целыми числами, необходимо оба значения поделить на наименьшее из них:
х : у = 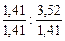 = 1 : 2,5 .
= 1 : 2,5 .
Поскольку дробные коэффициенты в химических формулах не употребляются, то оба члена последнего соотношения умножим на два
х : у = 2 : 5 .
Ответ: простейшая формула оксида фосфора Р2О5 .
Пример 5. Вычислите относительную плотность пропана по водороду и по воздуху.
Р е ш е н и е
Используем второе следствие закона Авогадро. Тогда по формуле (4) плотности пропана (С3Н8) по водороду (Н2) и воздуху соответственно равны:
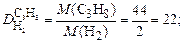
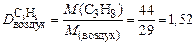 .
.
Ответ: 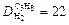 ;
; 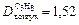 .
.
Пример 6. При температуре 280 К в сосуде вместимостью 14 дм3 находится 8 г водорода и 0,25 моль азота. Определите общее давление в системе и парциальные давления каждого газа. Вычислите мольные, объемные и массовые доли компонентов в имеющейся смеси.
Р е ш е н и е
По формуле (2) находим число моль водорода в смеси:
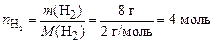 .
.
По формуле (7) рассчитываем парциальные давления газов:
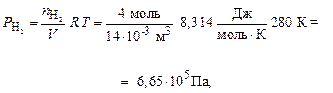
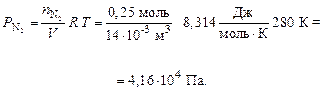
Общее давление смеси находим по формуле (6):
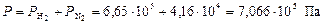 .
.
Рассчитываем массовые доли компонентов:
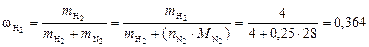 ;
;
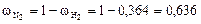 .
.
Вычисляем мольные доли газов в смеси:
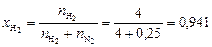 ;
;
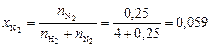 .
.
Для оценки объемных долей газов находим объемы H2 и N2 по формуле (5):
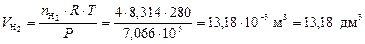 ;
;
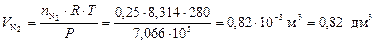 .
.
Тогда объемные доли водорода и азота соответственно равны:
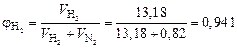 ;
;
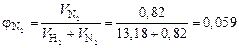 .
.
Таким образом, численные значения объемной и мольной доли для газов совпадают, так как выполняется закон Авогадро.
Ответ: 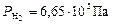 ;
; 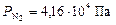 ;
; 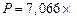
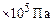 ;
; 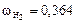 ;
; 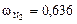 ;
; 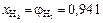 ;
; 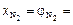
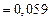 .
.
Пример 7. Какой объем займет смесь газов, содержащая 14 г азота, 32 г кислорода и 35,5 г хлора, при нормальных условиях и в условиях, когда температура возрастет на 20 К, а давление – на 0,5 атм?
Р е ш е н и е
Определяем общее число моль газов в смеси:
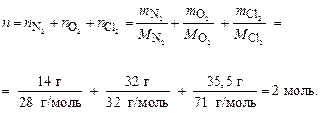
По первому следствию закона Авогадро объем смеси газов при н. у. равен
V° = n × V 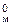 = 2 × 22,4 = 44,8 дм3 .
= 2 × 22,4 = 44,8 дм3 .
Определяем температуру и давление в новых условиях
Т = 273 + 20 = 293 К;
Р = 1 + 0,5 = 1,5 атм = 1,5 × 101 325 = 151 987,5 Па.
Тогда по формуле (5) находим объем газовой смеси:
V = 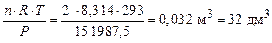 .
.
Ответ: V° = 44,8 дм3; V = 32 дм3.
Пример 8. Вычислите МЭ элементов в соединении CS2 и молярные эквивалентные массы веществ Al и SO3.
Р е ш е н и е
Находим с.о. элементов в сероуглероде 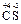 2. Тогда по формуле (9)
2. Тогда по формуле (9)
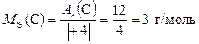 ,
,
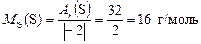 .
.
Алюминий в соединениях проявляет постоянную валентность В = 3, тогда по формуле (10)
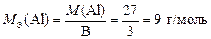 .
.
Валентность серы в оксиде SO3 равна В = 6, а число атомов S равно N = 1, тогда
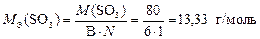 .
.
Ответ: 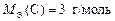 ;
; 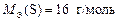 ;
; 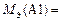
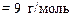 ;
; 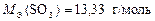 .
.
Пример 9. Определите МЭ ортофосфорной кислоты и гидроксида марганца, участвующих в реакциях:
1) Н3PO4 + 2KOH = K2HPO4 + 2H2O;
2) Mn(OH)2 + Cl2 + 2KOH = MnO2 + 2KCl + 2H2O .
Р е ш е н и е
Реакция 1) является ионно-обменной, так как протекает без изменения с.о. элементов. В данном случае от 1 моль Н3PO4 к молекулам KOH переходит два иона Н+, т.е. 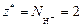 . Тогда
. Тогда
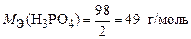 .
.
Реакция 2) – это окислительно-восстановительный процесс. В гидроксиде с.о. атома Mn равна +2, а в продукте реакции она составляет +4. Атом марганца теряет два электрона в процессе окисления, тогда 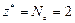 , а
, а
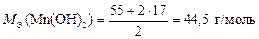 .
.
Ответ: 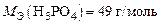 ;
; 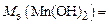
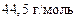 .
.
Пример 10. Вычислите молярный эквивалентный объем О2 и Н2 при н.у.
Р е ш е н и е
Э(Н) = 1 по определению. Чаще всего с.о. кислорода в сложном веществе равна –2, поэтому Э(О) = 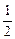 . Газы Н2 и О2 состоят из двух атомов, тогда по формуле (11)
. Газы Н2 и О2 состоят из двух атомов, тогда по формуле (11)
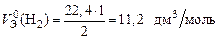 ;
;
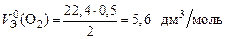 .
.
Ответ: 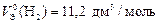 ;
; 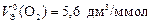 ь.
ь.
Пример 11. При сгорании 5 г металла образуется 9,44 г оксида металла. Вычислите молярную эквивалентную массу металла. Определите относительную атомную массу металла, если его валентность в оксиде равна В = 3.
Р е ш е н и е
По закону эквивалентов [из формулы (13)]
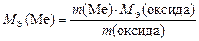 .
.
Молярную эквивалентную массу оксида можно представить так:
МЭ(оксида) = МЭ(Ме) + МЭ(О).
Следовательно,
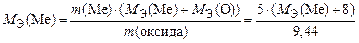 .
.
Откуда находим, что МЭ(Ме) = 9 г/моль. Относительную атомную массу металла рассчитываем по формуле
А r(Ме) = МЭ(Ме) × В = 9 × 3 = 27.
Ответ: МЭ(Ме) = 9 г/моль; А r(Ме) = 27; металл – алюминий.
Пример 12. Мышьяк образует оксид, содержащий 75,75 % мас. мышьяка. Вычислите МЭ(As) и установите простейшую формулу оксида.
Р е ш е н и е
Оксид мышьяка состоит из элементов As и О. Тогда закон эквивалентов можно записать так:
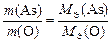 .
.
Отношение масс элементов в оксиде равно отношению массовых долей (% мас.) этих элементов, а МЭ(О) = 8 г/моль в любом оксиде. Тогда
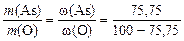
или
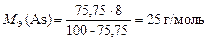 .
.
Для того чтобы записать химическую формулу оксида, вычисляем валентность мышьяка в оксиде по формуле
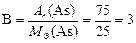 .
.
Ответ: 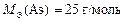 ; химическая формула оксида As2O3 .
; химическая формула оксида As2O3 .
Пример 13. На восстановление 3,6 г оксида металла израсходовали 1,7 дм3 водорода (н.у.). Чему равна молярная эквивалентная масса металла?
Р е ш е н и е
По закону эквивалентов [из формулы (13б)]
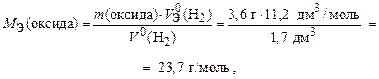
где МЭ(оксида) - это сумма МЭ(Ме) и МЭ(О), тогда МЭ(Ме) =
= МЭ(оксида) - МЭ(О) = 23,7 – 8 = 15,7 г/моль.
Ответ: МЭ(Ме) = 15,7 г/моль.
Пример 14. Из 3,31 г нитрата металла получили 2,78 г хлорида металла. Чему равна молярная эквивалентная масса оксида металла?
Р е ш е н и е
Закон эквивалентов в данном случае примет вид
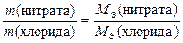 .
.
МЭ хлорида и нитрата металла можно представить таким образом:
МЭ(нитрата) = МЭ(Ме) + МЭ(NO 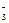 ) ,
) ,
МЭ(хлорида) = МЭ(Ме) + МЭ(Cl–) .
Молярные эквивалентные массы ионов определяем по формуле (12):
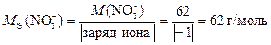 ;
;
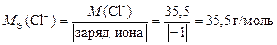 .
.
Тогда по закону эквивалентов
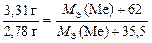 .
.
Отсюда МЭ(Ме) = 104 г/моль, а МЭ(оксида) равна
МЭ(оксида) = МЭ(Ме) + МЭ(О) = 104 + 8 = 112 г/моль.
Ответ: МЭ(оксида) = 112 г/моль.
СТРОЕНИЕ АТОМОВ И СВОЙСТВА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Таблица 4
Примеры решения задач
Пример 1. По символу изотопа элемента 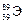 укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
Р е ш е н и е
Заряд ядра атома элемента Z = 39, значит, его порядковый номер в ПС и количество электронов также равны 39. Следовательно, искомым элементом является иттрий 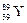 . Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
. Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
N = 89 – 39 = 50.
Электронная формула 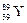 : 1s22s22p63s23p64s23d104p65s24d1 .
: 1s22s22p63s23p64s23d104p65s24d1 .
Ответ: Y; Z = 39; N = 50.
Пример 2. Квантовые числа валентных электронов иона Э2- равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 4 1 -1 + 1/2
4 4 1 0 + 1/2
Определите порядковый номер элемента и назовите его.
Р е ш е н и е
Валентная электронная формула иона Э2–: …4s24p2. После удаления двух лишних электронов электронная конфигурация атома примет вид Э…4s2. Добавим недостающие электроны
Э: 1s22s22p63s23р64s2. Общее количество электронов равно (2 + + 2 + 6 + 2 + 6 + 2) = 20, значит, это элемент № 20 – кальций (Сa).
Пример 3. Запишите полную электронную формулу элемента с порядковым номером 23. Отметьте его валентные электроны и укажите для них значения всех квантовых чисел. К какому электронному семейству относится данный атом? Составьте электронно-графическую схему его валентных подуровней. Сколько непарных и свободных АО будет иметь ион данного атома с зарядом +2?
Р е ш е н и е
Элемент с № 23 – ванадий V. Составляем его электронную формулу
23V: 1s2 2s2 2p6 3s2 3p6 4s2 3d 3
Валентными электронами являются электроны 4s и 3d подуровней. Значения квантовых чисел для каждого из пяти валентных электронов равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 3 2 -2 + 1/2
4 3 2 -1 + 1/2
5 3 2 0 + 1/2
Поскольку заполняются d -АО, то ванадий следует отнести к семейству d-элементов.
Составим электронно-графическую схему валентных подуровней V:
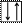
 4s 3d
4s 3d
При отрыве от атома ванадия двух электронов образуется ион V2+. Электроны покинут внешний 4s -подуровень, поэтому электронная формула V2+ примет вид:
23V2+: 1s22s22p63s23p64s03d3
После удаления электронов с 4s -АО в ионе V2+ станут свободными 3 энергетические ячейки (АО) и три АО 3d-подуровня будут заняты непарными электронами.
Пример 4. Запишите электронные формулы атома кремния в нормальном и возбужденном состояниях и определите его валентные возможности.
Р е ш е н и е
Атом кремния имеет 14-й порядковый номер в ПС. Тогда его электронная формула в нормальном состоянии имеет вид
14Si: 1s2 2s2 2p6 3s2 3p2.
Электронно-графическая схема валентного М-слоя:
 3s 3p 3d
3s 3p 3d
В таком состоянии валентность Si равна В = 2, если считать, что данный атом будет образовывать ковалентные связи только по обменному механизму за счет двух непарных АО 3р-подуровня.
При возбуждении один из парных электронов 3s-орбитали переместится на подуровень 3p и электронная формула примет вид:
Si + E ® Si*: 1s2 2s2 2p6 3s1 3p3.
Электронно-графическая схема возбужденного валентного М-слоя:
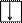 | 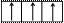 |  |
3s 3p 3d
В возбужденном состоянии валентность Si равна В = 4, поскольку атом имеет 4 непарных электрона. Дальнейшее возбуждение атома кремния невозможно, так как все валентные электроны атома являются непарными.
Пример 5. Укажите, как изменяются первая энергия ионизации, сродство к электрону и орбитальный радиус в ряду элементов K – Cu – Rb. Какой из перечисленных элементов является более сильным окислителем?
Р е ш е н и е
Калий и медь стоят в одном периоде, поэтому при переходе от K к Cu энергия ионизации и сродство к электрону возрастают, а орбитальный радиус уменьшается.
Калий и рубидий находятся в разных периодах, но в одной подгруппе, следовательно, при переходе от K к Rb энергия ионизации и сродство к электрону уменьшаются, а орбитальный радиус возрастает.
Наиболее сильным окислителем является тот элемент, у которого больше значение сродства к электрону. По возрастанию F элементы следует расположить в ряд: Rb ® K ® Cu. Таким образом, более сильным окислителем является медь.
Пример 6. Сравните энергии ионизации у следующих пар атомов: а) …2s2 2p3 и …2s2 2p4; б) …3s2 и …2s2 2p2. Ответ мотивируйте.
Р е ш е н и е
а) Элементы …2s2 2p3 и …2s2 2p4 располагаются в ПС в одном периоде, так как их валентные электроны имеют одинаковые значения главного квантового числа (n = 2). Кроме того, они стоят в периоде друг за другом (их электронные конфигурации отличаются на один электрон). В периоде с ростом порядкового номера энергия ионизации увеличивается. Однако I (2s2 2p3) > I (2s2 2p4), поскольку у электронной конфигурации …2s22p3 имеется наполовину заполненный p-подуровень, то есть здесь наблюдается локальный максимум энергии ионизации.
б) Элементы …3s2 и …2s22p2 расположены в разных периодах и группах, поэтому их нельзя сравнивать без привлечения вспомогательной конфигурации. Такой конфигурацией может служить …2s2, так как с первым элементом она стоит в одной группе (число валентных электронов одинаково и равно 2), а со вторым – в одном периоде.
I(…2s2) > I(…3s2), потому что с увеличением порядкового номера в группе происходит уменьшение энергии ионизации, а I(…2s22p2) > I(…2s2), поскольку в периоде энергия ионизации увеличивается. Таким образом, I(…2s22p2) > I(…2s2) > I(…3s2) или иначе I(…2s22p2) > I(…3s2).
Пример 7. Дайте общую характеристику элемента с порядковым номером 33. Какую высшую и низшую с.о. он проявляет в соединениях? Приведите примеры.
Р е ш е н и е
Это элемент As – мышьяк. Его полная электронная формула
33As: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Он располагается в четвертом периоде (n = 4, застраивается N-слой), в V(А) группе (имеет 5 валентных электронов …4s24p3, которые располагаются на внешнем слое). As относится к семейству p-элементов.
Высшая с.о. = +5, так как мышьяк имеет пять валентных электронов. Низшая с.о. = –3, так как до устойчивого электронного октета (4s24p6) ему недостает трех электронов. Примеры: 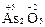 ,
, 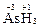 .
.
Пример 8. Почему селен и хром, находясь в одном и том же периоде и в одной группе, обладают столь разными химическими свойствами?
Р е ш е н и е
Селен и хром – это элементы шестого периода VI группы. Селен относится к семейству p-элементов и находится в главной подгруппе, тогда как хром – d -элемент, стоящий в побочной подгруппе.
Атом селена имеет на внешнем слое шесть электронов (…4s24p4), а атом хрома - только один электрон (….3d 54s1). Следовательно, у селена сильнее выражены неметаллические свойства, а у хрома – металлические.
Таблица 6
Примеры решения задач
Пример 1. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а) 1 молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
По формуле (15) найдем энергию образования 1 моль молекул аммиака
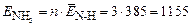
 кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобится энергия
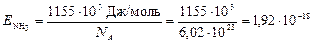 Дж.
Дж.
Энергия, необходимая для разложения 10 г аммиака, составляет
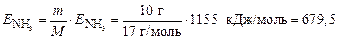
 кДж.
кДж.
Пример 2. Укажите механизм образования связей, направление смещения общих электронных пар и способ перекрывания АО в ионе SiF 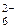 . Установите тип гибридизации центрального атома, форму и полярность молекулы.
. Установите тип гибридизации центрального атома, форму и полярность молекулы.
Р е ш е н и е
Ион SiF 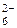 может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
Si: …3s2 3p2 3d 0 F: …2s2 2p5 F– : …2s2 2p6
В основном состоянии атом кремния имеет 2 непарных электрона на 3p подуровне, атом фтора – 1 непарный электрон на 2р подуровне, а ион фтора не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние
Si + E ® Si*: … 3s1 3p 3.
Свободные АО 3d-подуровня со стороны Si участвуют в образовании двух связей с ионами F– по донорно-акцепторному механизму, где кремний выполняет роль акцептора, а ионы фтора являются донорами. Таким образом, в частице SiF 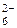 четыре связи образованы по обменному механизму, а две - по донорно-акцепторному.
четыре связи образованы по обменному механизму, а две - по донорно-акцепторному.
По табл. 4 находим ЭО(Si) = 1,74 и ЭО(F) = 4,00. ЭО(F) >
> ЭО(Si), значит, смещение общих электронных пар происходит к атомам F.
Так как все связи в ионе SiF 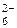 являются одинарными, то по способу перекрывания АО все они являются s-связями.
являются одинарными, то по способу перекрывания АО все они являются s-связями.
Тип гибридизации определяем по числу АО кремния, которые участвовали в образовании связей независимо от механизма их возникновения. Со стороны атома Si связи образованы с участием одной s-, трех p- и двух d-АО, следовательно, тип гибридизации – sp3d 2. Геометрическая форма – октаэдр (см. табл. 5), так как все гибридные АО являются связывающими (количество Ё = 0). Согласно табл. 6, определяем, что частица SiF 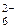 – неполярная, т. е.
– неполярная, т. е. 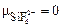 .
.
Пример 3. ЭМД молекулы IСl равен 0,54 D. Определите степень ковалентности связи и длину диполя молекулы.
Р е ш е н и е
Согласно табл. 4, ЭО атомов хлора и йода соответственно равны 2,83 и 2,21. Находим разность ЭО атомов:
DЭО(Cl – I) = 2,83 – 2,21 = 0,62.
По рис. 1 определяем СИ связи. СИ » 5 %. Тогда
СК = 100 – 5 = 95 %.
По формуле (17) вычисляем эффективные заряды атомов
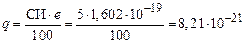 Кл.
Кл.
В молекуле IСl присутствует только одна связь I – Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. По формуле (16) оцениваем длину диполя
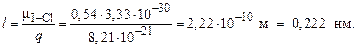
Пример 4. Составьте энергетическую диаграмму МО молекулы C2 и определите порядок связи в частице. Каковы ее магнитные свойства?
Р е ш е н и е
Образование химической связи в молекуле C2 может быть представлено следующим образом:
2C: 1s 2 2s 2 2p 5 →
→ C2 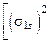
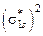
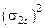
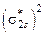
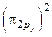
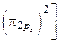 .
.
Строим энергетическую диаграмму молекулы (рис. 4), из которой следует, что молекула С2 - диамагнитная (все электроны – спаренные).
Порядок связи оцениваем по формуле (18):
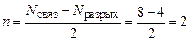 .
.

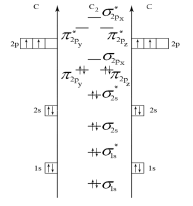
Рис. 4. Энергетическая диаграмма молекулы С2 по ММО
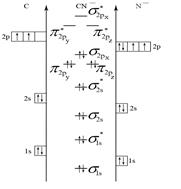
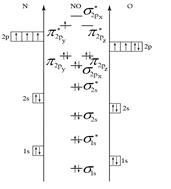
Пример 5. Составьте энергетические диаграммы МО для частиц СN– и NО. Определите магнитные свойства каждой частицы. Какая из них более прочная и почему?
Р е ш е н и е
Ион СN– состоит из атома углерода и иона N–. Электроны в этих частицах распределяются по АО следующим образом:
С: 1s2 2s2 2p2 N–: 1s2 2s2 2p4.
Для распределения электронов по МО необходимо сравнить ЭО атомов. Из табл. 4 выбираем ЭО(С) = 2,5 и ЭО(N) = 3. Поскольку ЭО(С) < ЭО(N), энергия исходных АО иона N– будет меньше, чем у атома углерода. Строим энергетическую диаграмму (см. рис. 5, а). Определяем порядок связи:
n = (10 – 4) /2 = 3.
p*2p y
p2p y
s*2s
p2p z
s2p x
p2p y
2p
2s
1s
1s
2s
p*2p z
s*1s
s1s
s*2p x
s2s
2p
p*2p z
2p
2p
2s
1s
1s
2s
p*2p y
p2p z
s*1s
s*2s
s1s
s2p x
s*2p x
s2s
а) б)
Рис. 5. Энергетические диаграммы СN– и NO
В ионе СN– нет непарных электронов, значит, частица - диамагнитная.
Молекула NО состоит из атомов азота и кислорода. Электроны в этих атомах распределяются по АО следующим образом:
N: 1s2 2s2 2p3 О: 1s2 2s2 2p4.
ЭО(N) = 3, а ЭО(О) = 3,5. Значит, энергия АО кислорода будет меньше, чем у азота. Последовательность возрастания энергии МО принимаем по более ЭО элементу, то есть по кислороду (см. рис. 5, б). Порядок связи в молекуле:
n = (10 – 5)/2 = 2,5.
NО – парамагнетик.
Прочность частиц СN– и NO можно сравнить по величине порядка связи. Чем больше порядок связи, тем больше энергия связи и меньше длина связи. В нашем случае n(CN–) > n(NО), следовательно, частица CN– более прочная, чем NО.
Пример 6. Радиусы ионов Na+ и Cu+ – одинаковые (0,098 нм). Объясните, почему температура плавления NaCl (801 °С) больше температуры плавления CuCl (430 °С).
Р е ш е н и е
При одинаковых зарядах и размерах ионов Na+ и Cu+ различие в их поляризующем действии определяется особенностями их электронного строения.
Запишем электронные формулы ионов:
Cu+: …3s23p63d10 Na+: …2s22p6.
У иона Cu+ ПД выражено сильнее, чем у иона Na+, так как главное квантовое число внешних АО у первого иона равно 3, а у второго – 2. В результате связь в кристаллах CuCl является в меньшей степени ионной, чем в NaCl. Поэтому кристаллическая решетка NaCl более близка к чисто ионному типу и имеет более высокую температуру плавления, чем у CuCl.
Пример 7. CaF2 не распадается на атомы даже при 1000 °С, а CuI2 неустойчив уже при обычной температуре. Чем объяснить различную прочность этих соединений?
Р е ш е н и е
Ион Cu2+, имеющий небольшой радиус (0,08 нм), обладает сильным ПД, а большой по размеру ион I– (r = 0,22 нм) характеризуется высокой поляризуемостью. Поэтому поляризация аниона I– катионом Cu2+ приводит к практически полному переходу электрона от аниона к катиону. В результате ион Cu2+ восстанавливается до Cu+, а ион I– окисляется до свободного йода. Поэтому соединение CuI2 – неустойчивое.
Радиус иона Са2+ составляет 0,104 нм, поэтому он оказывает более слабое ПД на анион, чем ион Cu2+. С другой стороны, поляризуемость иона F–, имеющего сравнительно малый размер
(r = 0,133 нм), значительно меньше, чем у иона I–. При взаимодействии слабополяризующего катиона Са2+ со слабо поляризующимся анионом F– электронные оболочки ионов почти не деформируются, СИ связи практически не снижается, поэтому соединение СаF2 - устойчиво.
Пример 8. H2S при обычной температуре – газ, а вода – жидкость. Чем можно объяснить это различие в физических свойствах?
Р е ш е н и е
Кислород – более ЭО элемент, чем сера. Поэтому между молекулами воды возникают более прочные водородные связи, чем между молекулами сероводорода. Разрыв этих связей требует значительной затраты энергии, что и приводит к аномальному повышению температуры кипения воды.
Пример 9. Ниже приведены Ткип (К) благородных газов:
Не Nе Ar Kr Xe Rn
4,3 27,2 87,3 119,9 165,0 211,2
Чем объясняется повышение Ткип в данном ряду?
Р е ш е н и е
С ростом порядкового номера благородных газов увеличиваются размеры их атомов при сохранении аналогичной структуры внешнего электронного слоя атома. Поэтому поляризуемость атомов возрастает, вследствие чего возрастают и силы межмолекулярного взаимодействия между ними. Отрыв атомов друг от друга, происходящий при переходе вещества из жидкого в газообразное состояние, требует все большей затраты энергии. Это и приводит к повышению температуры кипения.
Список литературы
1. Коровин Н.В. Общая химия. М.: Высш. шк., 1998.
2. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. М.: ООО «Дрофа», 2002.
3. Общая химия в формулах, определениях, схемах / И.Е. Шиманович,
М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Минск: Унiверсiтэцкае, 1996.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Изд-во «Астрель», 2004.
5. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
6. Глинка Н.Л. Задачи и упражнения по общей химии. Л.: Химия, 1988.
7. Задачи и упражнения по общей химии / Под ред. Н.В. Коровина. М.: Высш. шк., 2003.
8. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Высш. шк., 1991.
Содержание
Введение........................................ 3
Основные законы химии.............................. 3
Краткие теоретические сведения........................ 3
Примеры решения задач............................ 11
Строение атомов и свойства химических элементов 24
Краткие теоретические сведения....................... 24
Примеры решения задач............................ 34
Химическая связь и строение молекул..................... 40
Краткие теоретические сведения....................... 40
Примеры решения задач............................ 52
Список литературы................................. 60
Редактор Н.А. Бачурина
Компьютерная верстка: Т.С. Камыгина
Лицензия А № 001633 от 2 февраля 2004 г.

Сдано в набор 10.10.05. Подписано в печать 21.12.05.
Тир. 25 экз. Уч.-изд. л. 2,34. Формат 60´84 1/16. Усл. п. л. 3,72.
Гарнитура Таймс. Зак. .
162600, г. Череповец, пр. Луначарского, 5.
ГОУ ВПО Череповецкий государственный университет
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО ЧЕРЕПОВЕЦКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет общематематических и естественнонаучных дисциплин

Кафедра химии
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
(ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ)
Часть 1
Учебно-методическое пособие
Череповец
2005
Примеры решения задач по дисциплине «Общая и неорганическая химия» (для студентов заочной формы обучения). Ч. 1: Учеб.-метод. пособие. - Череповец: ГОУ ВПО ЧГУ, 2005. – 61 с.
Рассмотрено на заседании кафедры химии, протокол № 9 от 10.06.05.
Одобрено редакционно-издательской комиссией факультета общематематических и естественнонаучных дисциплин ГОУ ВПО ЧГУ, протокол № 5 от 14.06.05.
Составители: О.А. Калько – канд. техн. наук, доцент;
Н.В. Кунина
Рецензенты: Г.В. Козлова – канд. хим. наук, доцент (ГОУ ВПО ЧГУ);
Т.А. Окунева (ГОУ ВПО ЧГУ)
Научный редактор: Г.В. Козлова – канд. хим. наук, доцент
© Калько О.А., Кунина Н.В., 2005
© ГОУ ВПО Череповецкий государст-
 венный университет, 2005
венный университет, 2005

ВВЕДЕНИЕ
Данное учебно-методическое пособие содержит краткие теоретические сведения и примеры решения задач по следующим разделам курса «Общая и неорганическая химия»: основные законы химии; строение атома и периодичность изменения свойств элементов; химическая связь и строение молекул. Пособие предназначено для студентов заочной формы обучения в качестве вспомогательного руководства при выполнении домашних контрольных работ. Оно также будет полезным при подготовке к экзамену или зачету. Для более глубокого изучения дисциплины необходимо также ознакомиться с соответствующими разделами учебников, рекомендуемых в программе курса. Содержание учебно-методического пособия соответствует государственному стандарту дисциплины «Общая и неорганическая химия» для химических специальностей.
ОСНОВНЫЕ ЗАКОНЫ ХИМИИ
Краткие теоретические сведения
Химия – одна из фундаментальных естественных наук, предметом изучения которой являются вещества, их свойства и превращения. Одной из центральных характеристик вещества является масса m. Истинные массы структурных составляющих вещества (атомов, молекул и др.) очень малы (порядка 10-24¸10-20 г), поэтому для удобства в химии принято работать не с абсолютными, а с относительными значениями масс.
Относительная атомная масса химического элемента А r – это величина, равная отношению средней массы атомов данного элемента (с учетом процентного содержания его изотопов в природе) к 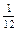 массы изотопа углерода 12 (
массы изотопа углерода 12 ( 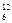 С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
С). Значения атомных масс всех химических элементов содержатся в Периодической системе Д.И. Менделеева.
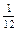 массы
массы 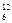 С называется атомной единицей массы (а. е. м.),
С называется атомной единицей массы (а. е. м.),
т. е.
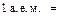
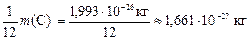 .
.
Относительная молекулярная масса вещества Mr находится как сумма А r атомов, из которых состоит молекула.
В 1971 году в Международную систему единиц измерения (СИ) была введена единица количества вещества – моль n – такое количество вещества, которое содержит столько структурных элементарных частиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 12 г изотопа углерода 12.
Число атомов в 12 г 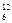 С равно 6,02 × 1023 атомов. Это число называется постоянной Авогадро NА, которая равна NА = (6,022045 ± ± 0,000031) × 1023 моль-1.
С равно 6,02 × 1023 атомов. Это число называется постоянной Авогадро NА, которая равна NА = (6,022045 ± ± 0,000031) × 1023 моль-1.
Таким образом, количество вещества можно оценить по формуле
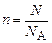 , (1)
, (1)
где N – число элементарных структурных единиц вещества.
Масса 1 моль вещества называется молярной массой M. Ее можно вычислить как отношение массы вещества m к его количеству n, кг/моль (г/моль):
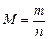 или
или 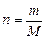 . (2)
. (2)
Численное значение М (в г/моль) совпадает с Mr вещества.
Количественные расчеты между веществами, находящимися в газообразном состоянии, удобнее производить не по массе, а по объему. Наиболее важными законами газового состояния являются законы Авогадро, Менделеева – Клапейрона и Дальтона.
Закон Авогадро: в равных объемах любых газов, взятых при одной и той же температуре и одинаковом давлении, содержится одинаковое число молекул. Это означает, что одно и то же число молекул любого газа занимает при одинаковых физических условиях один и тот же объем. Из закона Авогадро вытекают два важных следствия.
Следствие 1. При одинаковых физических условиях (т. е. Р, Т = const) 1 моль любого газа занимает один и тот же объем, который называют молярным объемом Vм . При нормальных условиях (н. у.) – давление 101,325 кПа (1 атм или 760 мм рт. ст.), температура 273 К (0 ° С) – этот объем равен V 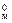 = = 22,4 дм3/моль;
= = 22,4 дм3/моль;
Следствие 2. Отношение масс равных объемов различных газов равно отношению их молярных масс:
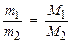 , (3)
, (3)
где m1, m2 – массы газов, г; M1, M2 – молярные массы газов, г/моль. Отношение 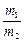 называется относительной плотностью первого газа по второму D
называется относительной плотностью первого газа по второму D 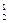 . Тогда из формулы (3) следует, что
. Тогда из формулы (3) следует, что
M1 = M2 × D 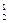 (4)
(4)
Зависимость между количеством идеального газа, его объемом, давлением и температурой можно выразить равенством, которое отражает закон Менделеева – Клапейрона:
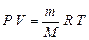 , (5)
, (5)
где 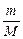 = n, моль; P – давление, Па; V – объем, м3; R =
= n, моль; P – давление, Па; V – объем, м3; R =
= 8,314 Дж/(моль × К) - универсальная газовая постоянная; T – температура, К.
Если газообразная фаза представляет собой смесь нескольких газов, химически не взаимодействующих друг с другом, то общее давление такой смеси Р можно определить по закону Дальтона:
Р = Р1 + Р2 + Р3 + … , (6)
где Р – общее давление; Р1, Р2, Р3, … – парциальные давления газов 1, 2, 3, … .
Парциальным давлением газа Р i в смеси называется давление, которое производил бы этот газ, если бы при тех же физических условиях он занимал объем всей газовой смеси. Его можно рассчитать по формулам:
Р i = 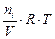 ; (7)
; (7)
Pi = xi × P, (8)
где ni – число моль i-го газа в смеси; 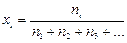 – мольная доля i -го газа в смеси.
– мольная доля i -го газа в смеси.
При количественных расчетах не обязательно записывать уравнение химической реакции и подбирать коэффициенты, если использовать понятия эквивалент и закон эквивалентов.
Эквивалентом Э (Х) называют некую реальную или условную частицу (атом, молекулу, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом равноценна 1 моль атомов водорода или ионов Н+ в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) = 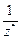 ,
,
где z* – число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента МЭ(Х) (г/моль). Ее можно рассчитать по формуле
МЭ(Х) = М(Х) × Э(Х) = 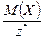 .
.
Число эквивалентности z* для химического элемента, входящего в состав какого-либо вещества, равно модулю степени окисления (с. о.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
МЭ(элемент) = 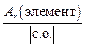 . (9)
. (9)
Для простого одноатомного вещества (например: Mg, P, S и т.д.) z* равно наиболее характерной валентности В элемента простого вещества. Тогда
МЭ (Х) = 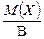 . (10)
. (10)
Правила определения значения z* веществ и формулы для расчета их молярных эквивалентных масс во всех других случаях приведены в табл. 1.
При решении задач с участием газообразных веществ обычно пользуются не МЭ, а молярным эквивалентным объемом вещества VЭ, то есть объемом, который занимает 1 моль эквивалентов газа. Расчет VЭ газа (в дм3/моль) при н. у. следует вести по формуле
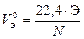 , (11)
, (11)
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем газа при н.у., дм3/моль.
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме. Для ионов МЭ вычисляют по формуле
МЭ(иона) = 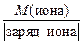 . (12)
. (12)
Таблица 1
Определение z * и расчет МЭ простых и сложных веществ
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета МЭ | Пример |
| Не участвует в реакции | Оксид | 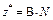 , где
В – валентность элемента; N – число атомов элемента , где
В – валентность элемента; N – число атомов элемента
| 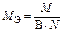
| Na2O: 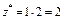 , ,
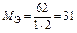 г/моль г/моль
|
| Соль | 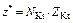 , где , где 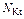 – число катионов; – число катионов; 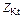 – заряд катиона – заряд катиона
| 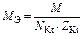
| AlCl3: 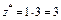 , ,
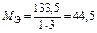 г/моль г/моль
| |
| Основание | 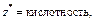 т. е. число ионов OH–, способных замещаться на анионы т. е. число ионов OH–, способных замещаться на анионы
| 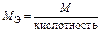
| Ca(OH)2: 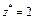 , ,
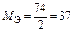 г/моль г/моль
| |
| Кислота | 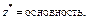 то есть число ионов H+, способных замещаться на катионы
то есть число ионов H+, способных замещаться на катионы
| 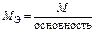
| H2SO4: 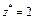 , ,
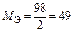 г/моль г/моль
| |
| Ионного обмена | Любое | 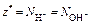 ,
где ,
где 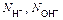 - число ионов Н+ или ОН–, переходящих от одного вещества к другому - число ионов Н+ или ОН–, переходящих от одного вещества к другому
| 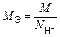 или
или
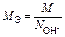
| Al(OH)3 + 2HCl = = Al(OH)Cl2 + 2H2O
Для Al(OH)3:  , , 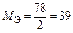 г/моль г/моль
|
Продолжение табл. 1
| Тип реакции | Вещество | Определение числа эквивалентности z* | Формула для расчета МЭ | Пример |
| ОВР | Любое | 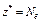 ,
где Ne – число электронов, принятых (или отданных) окислителем (или восстановителем) ,
где Ne – число электронов, принятых (или отданных) окислителем (или восстановителем)
| 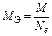
| 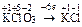 Для KClO3:
Для KClO3: 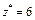 , , 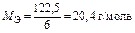
|
Закон эквивалентов: массы реагирующих друг с другом веществ, а также массы образовавшихся продуктов пропорциональны молярным массам эквивалентов этих веществ.
Дата: 2018-12-28, просмотров: 420.