Атом – электронейтральная микрочастица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядро атома содержит два типа частиц (нуклонов) – протоны и нейтроны. Число протонов в ядре определяет его заряд Z, который совпадает с порядковым номером элемента в Периодической системе (ПС) Д.И. Менделеева.
Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, которое равно сумме числа протонов Z и числа нейтронов N:
А = Z + N . (14)
Атомы с одинаковыми значениями Z, но различными значениями А и N называются изотопами (например, изотопы водорода: 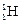 – протий,
– протий, 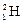 – дейтерий,
– дейтерий, 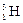 – тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например:
– тритий). Атомы, обладающие одинаковыми N, но различными Z и А, являются изотонами (например: 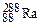 ,
, 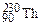 ,
, 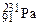 ). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например:
). Если же атомы имеют одинаковые значения А, но различаются числами Z и N, то их называют изобарами (например: 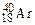 ,
, 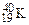 ,
, 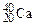 ).
).
А r элемента, указываемая в ПС, является средней величиной массовых чисел его природных изотопов с учетом их распространенности в природе. Например, природный хлор состоит в основном из двух изотопов 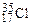 (75,43 % атом.) и
(75,43 % атом.) и 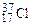 (24,57 % атом.), поэтому его атомная масса будет равна
(24,57 % атом.), поэтому его атомная масса будет равна
Ar(Cl) = 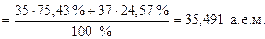
Электрон в атоме существует в виде электронного облака – определенной области пространства, которая охватывает примерно 90 % заряда и массы электрона. Эту область пространства называют орбиталью. Состояние электрона в атоме принято описывать при помощи значений четырех квантовых чисел:
1. Главное квантовое число n характеризует основной запас
энергии электрона и размер электронного облака. Оно может принимать только целочисленные значения от 1 до +¥. Чем больше значение n, тем больше размер электронного облака и выше его энергия. Электроны, имеющие одинаковые значения n, образуют электронные слои (иначе - энергетические уровни), которые обозначают буквами
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Уровень | K | L | M | N | O | Р | Q |
2. Орбитальное (иначе побочное) квантовое число l определяет момент количества движения электрона и характеризует форму электронного облака. l изменяется в пределах от 0 до (n – 1). Каждому значению l соответствует своя форма электронного облака: при l = 0 – сферическая; l = 1 – гантелевидная; l = 2 – две пересекающиеся под прямым углом гантели; l = 3 – три пересекающиеся под прямым углом гантели (см. табл. 2).
Электроны одного энергетического уровня, имеющие одинаковые значения l, образуют энергетические подуровни, которые имеют буквенные обозначения (см. табл. 2).
Состояние электрона с определенными значениями n и l записывают в виде сочетания цифрового значения n и буквенного l. Например, при n = 3 и l = 1 записывают 3p, а при n = 4 и l = 3 записывают 4f.
3. Магнитное квантовое число ml характеризует положение электронного облака в пространстве. ml изменяется в пределах от – l до + l, т.е. всего в каждом подуровне оно может принимать (2l + 1) значений, количество которых показывает число возможных положений электронного облака данного типа в пространстве. Все орбитали одного подуровня обладают одинаковой энергией и называются вырожденными.
 Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n , l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде
Состояние электрона в атоме, охарактеризованное значениями квантовых чисел n , l и ml, называется атомной орбиталью (АО) и графически изображается в виде квадрата или в виде
 черты , которые называют энергетической ячейкой.
черты , которые называют энергетической ячейкой.

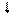
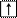
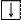 4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ).
4. Спиновое квантовое число ms характеризует собственный механический момент электрона, связанный с вращением его вокруг своей оси. ms может принимать только два значения ms = +½ ( ) и ms = – ½ ( ).
Таблица 2
Дата: 2018-12-28, просмотров: 348.