| Элемент | ЭО | Элемент | ЭО | Элемент | ЭО |
| Н | 2,10 | V | 1,45 | Tc | 1,36 |
| Li | 0,97 | Cr | 1,56 | Ru | 1,42 |
| Be | 1,47 | Mn | 1,60 | Rh | 1,45 |
| B | 2,01 | Fe | 1,64 | Pd | 1,35 |
| C | 2,50 | Co | 1,70 | Ag | 1,42 |
| N | 3,07 | Ni | 1,75 | Cd | 1,46 |
| O | 3,50 | Cu | 1,75 | In | 1,49 |
| F | 4,00 | Zn | 1,66 | Sn | 1,72 |
| Na | 1,01 | Ga | 1,82 | Sb | 1,82 |
| Mg | 1,23 | Ge | 2,02 | Te | 2,01 |
| Al | 1,47 | As | 2,20 | I | 2,21 |
| Si | 1,74 | Se | 2,48 | Cs | 0,86 |
| P | 2,10 | Br | 2,74 | Ba | 0,97 |
| S | 2,60 | Rb | 0,89 | Hf | 1,33 |
| Cl | 2,83 | Sr | 0,99 | Ta | 1,33 |
| K | 0,91 | Y | 1,11 | W | 1,40 |
| Ca | 1,04 | Zr | 1,23 | Pb | 1,55 |
| Sc | 1,20 | Nb | 1,23 | Bi | 1,67 |
| Ti | 1,32 | Mo | 1,30 | Po | 1,76 |
Закономерная периодическая повторяемость электронных структур валентных подуровней элементов и, как следствие, повторяемость их свойств отражаются в Периодическом законе, современная формулировка которого гласит: свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Графическим отражением Периодического закона является ПС элементов Д.И. Менделеева, в которой элементы расположены в порядке возрастания Z их атомов и подразделяются на естественные совокупности – периоды и группы.
Период – это горизонтальный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных слоев. Номер периода совпадает со значением n внешнего энергетического уровня и показывает число электронных слоев атома. Зависимость свойств химических элементов и их соединений в периоде с увеличением Z атомов приведена в табл. 3.
Первые три периода содержат только s- и p-элементы и называются малыми. Четвертый и последующие периоды кроме s- и p-элементов содержат также d- и f-элементы и называются большими. У атомов s- и p-элементов свойства соседних атомов изменяются отчетливо, а для d- и в особенности для f-элементов одного и того же периода различия в свойствах проявляются менее четко, так как у них происходит заполнение электронами внутренних энергетических уровней, тогда как конфигурация внешнего слоя практически не изменятся.
Элементы ПС подразделяют на восемь групп. Положение элемента в группе определяется общим числом его валентных электронов. Каждая группа состоит из главной (А) и побочной (В) подгрупп. В главных подгруппах находятся только s- и p-элементы, побочные подгруппы содержат d-элементы, а все f-элементы формально отнесены к III (В) подгруппе. В коротком (восьмиклеточном) варианте ПС 4 f-элементы 6-го периода и 5f-элементы 7-го периода вынесены за рамки таблицы как семейства лантаноидов и актиноидов соответственно.
Элементы-аналоги, то есть элементы, расположенные в одной подгруппе, имеют одинаковое строение валентных подуровней при разных значениях числа n и поэтому проявляют сходные химические свойства.
Примеры решения задач
Пример 1. По символу изотопа элемента 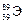 укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
укажите название элемента, число протонов и нейтронов в его ядре, а также запишите его электронную формулу.
Р е ш е н и е
Заряд ядра атома элемента Z = 39, значит, его порядковый номер в ПС и количество электронов также равны 39. Следовательно, искомым элементом является иттрий 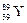 . Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
. Число протонов Z = 39, массовое число А = 89, тогда число нейтронов определяем по формуле (14):
N = 89 – 39 = 50.
Электронная формула 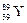 : 1s22s22p63s23p64s23d104p65s24d1 .
: 1s22s22p63s23p64s23d104p65s24d1 .
Ответ: Y; Z = 39; N = 50.
Пример 2. Квантовые числа валентных электронов иона Э2- равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 4 1 -1 + 1/2
4 4 1 0 + 1/2
Определите порядковый номер элемента и назовите его.
Р е ш е н и е
Валентная электронная формула иона Э2–: …4s24p2. После удаления двух лишних электронов электронная конфигурация атома примет вид Э…4s2. Добавим недостающие электроны
Э: 1s22s22p63s23р64s2. Общее количество электронов равно (2 + + 2 + 6 + 2 + 6 + 2) = 20, значит, это элемент № 20 – кальций (Сa).
Пример 3. Запишите полную электронную формулу элемента с порядковым номером 23. Отметьте его валентные электроны и укажите для них значения всех квантовых чисел. К какому электронному семейству относится данный атом? Составьте электронно-графическую схему его валентных подуровней. Сколько непарных и свободных АО будет иметь ион данного атома с зарядом +2?
Р е ш е н и е
Элемент с № 23 – ванадий V. Составляем его электронную формулу
23V: 1s2 2s2 2p6 3s2 3p6 4s2 3d 3
Валентными электронами являются электроны 4s и 3d подуровней. Значения квантовых чисел для каждого из пяти валентных электронов равны:
Номер электрона n l ml ms
1 4 0 0 + 1/2
2 4 0 0 - 1/2
3 3 2 -2 + 1/2
4 3 2 -1 + 1/2
5 3 2 0 + 1/2
Поскольку заполняются d -АО, то ванадий следует отнести к семейству d-элементов.
Составим электронно-графическую схему валентных подуровней V:
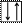
 4s 3d
4s 3d
При отрыве от атома ванадия двух электронов образуется ион V2+. Электроны покинут внешний 4s -подуровень, поэтому электронная формула V2+ примет вид:
23V2+: 1s22s22p63s23p64s03d3
После удаления электронов с 4s -АО в ионе V2+ станут свободными 3 энергетические ячейки (АО) и три АО 3d-подуровня будут заняты непарными электронами.
Пример 4. Запишите электронные формулы атома кремния в нормальном и возбужденном состояниях и определите его валентные возможности.
Р е ш е н и е
Атом кремния имеет 14-й порядковый номер в ПС. Тогда его электронная формула в нормальном состоянии имеет вид
14Si: 1s2 2s2 2p6 3s2 3p2.
Электронно-графическая схема валентного М-слоя:
 3s 3p 3d
3s 3p 3d
В таком состоянии валентность Si равна В = 2, если считать, что данный атом будет образовывать ковалентные связи только по обменному механизму за счет двух непарных АО 3р-подуровня.
При возбуждении один из парных электронов 3s-орбитали переместится на подуровень 3p и электронная формула примет вид:
Si + E ® Si*: 1s2 2s2 2p6 3s1 3p3.
Электронно-графическая схема возбужденного валентного М-слоя:
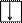 | 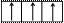 |  |
3s 3p 3d
В возбужденном состоянии валентность Si равна В = 4, поскольку атом имеет 4 непарных электрона. Дальнейшее возбуждение атома кремния невозможно, так как все валентные электроны атома являются непарными.
Пример 5. Укажите, как изменяются первая энергия ионизации, сродство к электрону и орбитальный радиус в ряду элементов K – Cu – Rb. Какой из перечисленных элементов является более сильным окислителем?
Р е ш е н и е
Калий и медь стоят в одном периоде, поэтому при переходе от K к Cu энергия ионизации и сродство к электрону возрастают, а орбитальный радиус уменьшается.
Калий и рубидий находятся в разных периодах, но в одной подгруппе, следовательно, при переходе от K к Rb энергия ионизации и сродство к электрону уменьшаются, а орбитальный радиус возрастает.
Наиболее сильным окислителем является тот элемент, у которого больше значение сродства к электрону. По возрастанию F элементы следует расположить в ряд: Rb ® K ® Cu. Таким образом, более сильным окислителем является медь.
Пример 6. Сравните энергии ионизации у следующих пар атомов: а) …2s2 2p3 и …2s2 2p4; б) …3s2 и …2s2 2p2. Ответ мотивируйте.
Р е ш е н и е
а) Элементы …2s2 2p3 и …2s2 2p4 располагаются в ПС в одном периоде, так как их валентные электроны имеют одинаковые значения главного квантового числа (n = 2). Кроме того, они стоят в периоде друг за другом (их электронные конфигурации отличаются на один электрон). В периоде с ростом порядкового номера энергия ионизации увеличивается. Однако I (2s2 2p3) > I (2s2 2p4), поскольку у электронной конфигурации …2s22p3 имеется наполовину заполненный p-подуровень, то есть здесь наблюдается локальный максимум энергии ионизации.
б) Элементы …3s2 и …2s22p2 расположены в разных периодах и группах, поэтому их нельзя сравнивать без привлечения вспомогательной конфигурации. Такой конфигурацией может служить …2s2, так как с первым элементом она стоит в одной группе (число валентных электронов одинаково и равно 2), а со вторым – в одном периоде.
I(…2s2) > I(…3s2), потому что с увеличением порядкового номера в группе происходит уменьшение энергии ионизации, а I(…2s22p2) > I(…2s2), поскольку в периоде энергия ионизации увеличивается. Таким образом, I(…2s22p2) > I(…2s2) > I(…3s2) или иначе I(…2s22p2) > I(…3s2).
Пример 7. Дайте общую характеристику элемента с порядковым номером 33. Какую высшую и низшую с.о. он проявляет в соединениях? Приведите примеры.
Р е ш е н и е
Это элемент As – мышьяк. Его полная электронная формула
33As: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p3
Он располагается в четвертом периоде (n = 4, застраивается N-слой), в V(А) группе (имеет 5 валентных электронов …4s24p3, которые располагаются на внешнем слое). As относится к семейству p-элементов.
Высшая с.о. = +5, так как мышьяк имеет пять валентных электронов. Низшая с.о. = –3, так как до устойчивого электронного октета (4s24p6) ему недостает трех электронов. Примеры: 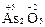 ,
, 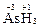 .
.
Пример 8. Почему селен и хром, находясь в одном и том же периоде и в одной группе, обладают столь разными химическими свойствами?
Р е ш е н и е
Селен и хром – это элементы шестого периода VI группы. Селен относится к семейству p-элементов и находится в главной подгруппе, тогда как хром – d -элемент, стоящий в побочной подгруппе.
Атом селена имеет на внешнем слое шесть электронов (…4s24p4), а атом хрома - только один электрон (….3d 54s1). Следовательно, у селена сильнее выражены неметаллические свойства, а у хрома – металлические.
Дата: 2018-12-28, просмотров: 363.