кислота
R и R 1 – радикалы углеводородов, одинаковые или разные).
Названия сложных эфиров образуют от названий соответствующих спиртов и кислот, например:
О О
∕∕ ∕∕
Н – С Н – С
\ \
О – СН3 О – С2Н5
метилформиат, этилацетат,
или метиловый эфир муравьиной кислоты или этиловый эфир уксусной кислоты
2. Нахождение в природе и физические свойства. Сложные эфиры содержатся в цветках, фруктах, ягодах. Сложные эфиры простейших одноосновных кислот и спиртов – жидкости, легче воды, летучие и в большинстве случаев обладающие приятным запахом. Например, изопентиловый эфир уксусной кислоты (изопентилацетат) имеет запах груши, бутиловый эфир масляной кислоты – ананаса.
Температуры кипения и плавления сложных эфиров ниже, чем соответствующих органических кислот. В воде растворимы только сложные эфиры с небольшой относительной молекулярной массой.
3. Получение. Сложные эфиры в лаборатории получают главным образом при взаимодействии карбоновых кислот со спиртами в присутствии концентрированной серной кислоты:
О O
∕∕ H2SO4,t ∕∕

 СН3 – С + Н – О – С2Н5 CH3– C + H2O
СН3 – С + Н – О – С2Н5 CH3– C + H2O
\ \
ОН O– C2H5
Реакции образования сложных эфиров называют реакциями этерификации.
4. Химические свойства. Характерное свойство сложных эфиров – их взаимодействие с водой – гидролиз:
О О
∕∕ ∕∕

 СН3– С + НОН СН3 –С + С2Н5ОН
СН3– С + НОН СН3 –С + С2Н5ОН
\ \
О – С2Н5 ОН
этилацетат уксусная кислота этанол
Гидролиз протекает в кислой, так и в щелочной среде. В щелочной среде гидролиз становится необратимым, поскольку щёлочь связывает карбоновую кислоту в соль:
O O
∕∕ ∕∕
 R1– C + NaOH R1 – C + R2 – OH
R1– C + NaOH R1 – C + R2 – OH
\ \
O – R2 O Na
Реакцию щелочного гидролиза сложного эфира называют омылением.
5. Применение. Полиметилакрилат (полимер сложного эфира
СН2=СН – СООСН3) широко используют в производстве пластмасс.
Контрольные вопросы
1. Какие вещества относят к сложным эфирам? Составьте два-три уравнения
реакций их образования.
2. Какой вид изомерии характерен для сложных эфиров? Напишите формулы
двух-трёх изомеров и их названия.
3. Охарактеризуйте физические и химические свойства сложных эфиров.
Напишите уравнения соответствующих реакций.
Лекция 25
Амины. Строение, номенклатура, изомерия.
План
1. Номенклатура.
2. Строение молекул и химические свойства.
3. Физические свойства анилина.
4. Получение.
1. Номенклатура.
Аминами называют производные аммиака, в молекулах которого один или несколько атомов водорода замещены углеводородными радикалами:
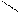
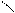 СН3 – NH2 CH3 CH3
СН3 – NH2 CH3 CH3
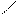 NH CH3 –– N
NH CH3 –– N
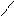 CH3
CH3
CH3
метиламин диметиламин триметиламин
(первичный амин) (вторичный амин) (третичный амин)
Заместители могут быть как одинаковыми, так и разными. Они могут быть предельными, непредельными, циклическими, ароматическими:
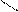 СН3
СН3
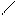 NH C6H5 – NH2
NH C6H5 – NH2
СН3 – СН2
метилэтиламин фениламин (анилин)
Функциональная группа аминов – аминогруппа – NH2. Общая формула аминов R –NH2.
Амины образуются при разложении азотсодержащих веществ (например, белков). Так, специфический запах моря обусловлен аминами, образовавшимися при разложении морских организмов.
2. Строение молекул и химические свойства. Строение молекул аминов аналогично строению молекулы аммиака, и поэтому свойства этих веществ сходны. В молекулах аминов орбитали атома азота находятся в состоянии sp3- гибридизации, три гибридные орбитали образуют связи с углеродом и водородом, а четвёртая содержит неподелённую пару электронов.
В водном растворе и в присутствии кислот эта электронная пара взаимодействует с положительно заряженным ионом водорода и присоединяет его по донорно-акцепторному механизму:
 H
H


 Н3С – N: + HOH [H3C – NH3] + + OH-
Н3С – N: + HOH [H3C – NH3] + + OH-
ион
H метиламмония
3. Физические свойства анилина. Анилин – бесцветная маслянистая ядовитая жидкость, малорастворимая в воде. Хорошими растворителями для него являются спирт, эфир и бензол. Анилин затвердевает при –60С и кипит при 1840С. Вследствие окисления на воздухе он быстро темнеет. Как и все амины, анилин токсичен.
Строение молекулы анилина можно изобразить несколькими способами:
С6Н5 – NH2
. .
В молекуле анилина, как и в молекулах других аминов, у атома азота имеется неподелённая пара, которая вовлечена в ароматическое сопряжение бензольного кольца. Там происходит перераспределение электронной плотности, в результате чего она возрастает в положениях 2,4 и 6.
4. Получение анилина в промышленности основано на реакции восстановления нитробензола, которую в 1842г. Открыл русский учёный Н.Н. Зинин. Нитробензол восстанавливают в присутствии чугунных стружек и соляной кислоты. Вначале выделяется атомарный водород, который и взаимодействует с нитробензолом:
Fe + 2HCl = FeCl2 + 2H
 C6H5 – NO2 + 6H C6H5 – NH2 +2H2O
C6H5 – NO2 + 6H C6H5 – NH2 +2H2O
Контрольные вопросы
1. Какие вещества называют аминами и каково строение их молекул?
2. На примере анилина объясните сущность взаимного влияния групп атомов
в молекуле.
3. При восстановлении 250 г нитробензола получили 150 г анилина.
Вычислите, сколько это составляет процентов по сравнению с
теоретическим выходом продукта реакции.
Дата: 2019-02-02, просмотров: 362.