План
1. Химические свойства.
2. Получение и применение.
3. Применение.
1.Химические свойства. Для аренов наиболее характерны реакции замещения атомов водорода в бензольном кольце на другие атомы или группы атомов.
Реакции замещения.
1) Галогенирование. В присутствии брома м катализатора – солей железа (III) – в бензоле происходит замена атомов водорода в бензольном кольце на атомы брома
FeBr3, t
 C6H6 + Br2 C6H5Br + HBr
C6H6 + Br2 C6H5Br + HBr
бромбензол
Аналогично бензол реагирует и с хлором.
2) Нитрование бензола (введение нитрогрупп – NO2 в его молекуле) проводят смесью концентрированных азотной и серной кислот:
 HNO3 + 2H2SO4 NO2+ + H3O+ + 2HSO4-
HNO3 + 2H2SO4 NO2+ + H3O+ + 2HSO4-
Образующийся катион нитрония NO+2 взаимодействует с бензолом:
 C6H6 + NO2 + C6H5NO2 + H+
C6H6 + NO2 + C6H5NO2 + H+
нитробензол
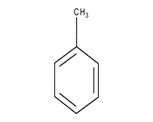
При нитровании метилбензола (толуола) происходит замена трёх атомов водорода на нитрогруппы:
 Реакции окисления. Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
Реакции окисления. Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
метилбензол
1.При действии энергичных окислителей (KMnO4) на гомологи бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть,
то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что под действием перманганата калия метильная группа толуола окисляется и превращается в карбоксильную
группу – СОООН: О
//
С6Н5 – СН3 + 3 
 С6Н5 – С \ + Н2О
С6Н5 – С \ + Н2О
ОН
бензойная кислота
2) Бензол и его гомологи на воздухе горят коптящим пламенем:
2С6Н6 + 15О2  12СО2 + 6Н2О
12СО2 + 6Н2О
Реакции присоединения для бензола не характерны и протекают с трудом (в жёстких условиях).
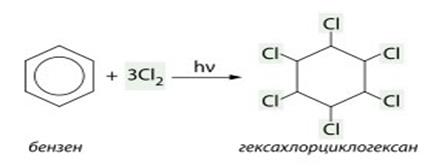
1. При действии солнечного света или ультрафиолетовых лучей бензол присоединяет хлор и образуется гексахлорциклогексан (гексахлоран)
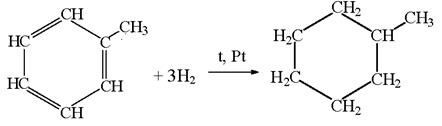
2) Бензол способен также гидрироваться (при нагревании, повышенном давлении и в присутствии катализатора).
2. Получение. В настоящее время основной источник получения бензола в промышленности – переработка нефти. Незначительные количества бензола получают из каменноугольной смолы и газов, образующихся при коксовании (пиролизе) углей.
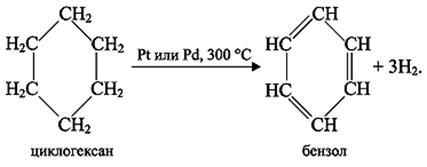
Русский учёный Н.Д. Зеленский доказал, что бензол можно получить из циклогексана, выделяемого из некоторых сортов нефти:
Если пропускать ацетилен при 4500 – 5000С над активированным углем, то он также превращается в бензол:
3. Применение. Бензол является ценным продуктом для получения красителей, медикаментов, взрывчатых веществ, средств защиты растений, пластмасс и синтетических волокон. Он является также хорошим растворителем многих органических веществ. Толуол используют для получения красителей и тринитротолуола.
Некоторые хлорпроизводные органических веществ используют для защиты растений. Например, гексахлорбензолом C6Cl6 протравливают семена зерновых для защиты от твёрдой головни. Эти и многие другие вещества относят к пестицидам.
В агрохимической практике в основном применяют инсектициды – средства борьбы с насекомыми, гербициды – для борьбы с сорняками, фунгициды – для устранения грибковых заболеваний.
Контрольные вопросы
1. Как получают ароматические углеводороды? Приведите уравнения соответствующих реакций.
2. Сравните химические свойства бензола и толуола и поясните сущность взаимного влияния атомов в молекулах. Вспомните соответствующее положение из теории А.М. Бутлерова и приведите другие примеры.
3. Какие мероприятия осуществляются в вашей местности по охране окружающей среды? Подготовьте компьютерную презентацию на эту тему.
Лекция 17
Тема: Нефть, газ, уголь.
План
1. Природный газ.
2. Нефть.
3. Попутные нефтяные газы.
1. Природный газ. Запасы природного газа на нашей планете очень велики.
Основной компонент природного газа – метан. Также в природном газе содержатся этан, пропан и бутан. Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его содержится в природном газе.
При сгорании природного газа выделяется много теплоты, поэтому он служит эффективным и дешёвым топливом. Использование на производстве природного газа даёт возможность значительно повысить производительность труда.
Следует отметить и такие преимущества газообразного топлива, как лёгкость воспламенения, возможность предварительного нагрева и получения высокой температуры, отсутствие золы и шлака при сгорании.
Природный газ – важный источник сырья для химической промышленности. Его используют для получения ацетилена, этилена, водорода, сажи, различных пластмасс, уксусной кислоты. Красителей, медикаментов.
2. Нефть – важнейшее полезное ископаемое. Это горючая маслянистая жидкость от светло-бурого дл чёрного цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется. По запасам и добыче нефти наша страна одно из ведущих мест в мире.
В зависимости от месторождения нефть имеет различный качественный и количественный состав. Так, например, бакинская нефть богата циклопарафинами и сравнительно бедна предельными углеводорода. Значительно больше предельных углеводородов в сибирской, грозненской и ферганской нефти. Пермская нефть содержит ароматические углеводороды.
Залежи нефти находятся в недрах земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Если она находится под давлением газов, то поднимается по скважине на поверхность.
3. Попутные нефтяные газы – находятся над залежами нефти или растворены в ней под давлением. Ещё недавно попутные нефтяные газы не находили применения и их сжигали. В настоящее время их улавливают и используют как топливо и ценное химическое сырьё. В попутных газах содержится меньше метана, чем в природном газе, но в них значительно больше его гомологов. Для практических целей попутные газы разделяют на смеси более узкого состава. Иногда их подвергают более тщательному разделению и извлекают из них индивидуальные углеводороды (этан, пропан и т.д.), из которых затем получают непредельные углеводороды.
Каменный уголь образовался при разложении остатков древних растений примерно 300-350млн лет назад. Он представляет собой смесь высокомолекулярных органических соединений, а также воды и летучих веществ с небольшими количествами минеральных примесей. В состав каменного угля, кроме углерода, входят водород, кислород, сера и азот. Содержание углеродов в каменном угле, в зависимости от его сорта, составляет от 75 до 95%.
Один из основных способов получения углеводородов (в том числе и ароматических) из каменного угля – его коксование (нагревание до 10000С без доступа воздуха). Подобным методом на коксохимическом производстве из каменного угля получают четыре основных продукта: кокс, каменноугольную смолу, аммиак и коксовый газ.
Контрольные вопросы
1. Какие главные природные источники углеводородов вам известны?
2. Каков состав природного газа?
3. Какие преимущества по сравнению с другими видами топлива имеет природный газ?
4. Для каких целей используют природный газ в химической промышленности?
Лекция 18
Дата: 2019-02-02, просмотров: 403.