План
1. Классификация и номенклатура.
2. Получение.
3. Физические свойства.
4. Химические свойства.
1. Классификация и номенклатура. К многоатомным спиртам относят органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
Формулы многоатомных спиртов, как и одноатомных, можно вывести из формул соответствующих углеводородов, заменяя в них атомы водорода гидроксильными группами.
Если, например, в формуле этана гидроксильными группами заместить два атома водорода (по одному у каждого атома углерода), то получится формула двухатомного спирта этиленгликоля (этандиола-1.2):

 СН3 СН2–ОН
СН3 СН2–ОН

СН3 СН2–ОН
Из формулы пропана можно вывести формулу трёхатомного спирта глицерина (пропантриола-1,2,3):

 СН3 СН2–ОН
СН3 СН2–ОН


 СН2 СН–ОН
СН2 СН–ОН
СН3 СН2–ОН
По международной номенклатуре название многоатомных спиртов составляют следующим образом: основа названия – название предельного углеводорода с таким же числом атомов углерода с добавлением суффиксов – диол-. –триол- и т.д., затем через дефис цифрами указывают положение гидроксильных групп в углеродной цепи.
2. Получение. Нам уже известно, что этиленгликоль образуется при окислении перманганатом калия. Этиленгликоль и глицерин можно получить также из галогенопроизводных соответствующих углеводородов.
СН2– Cl H – OH CH2– OH


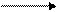 + +2HCl
+ +2HCl
 CH2– Cl H–OH CH2– OH
CH2– Cl H–OH CH2– OH
3. Физические свойства. Этиленгликоль и глицерин – бесцветные сиропообразные жидкости сладковатого вкуса. Они хорошо растворяются в воде и в этаноле. Этиленгликоль кипит при температуре 197,60С. Этиленгликоль очень ядовит!
4.Химические свойства этиленгликоля и глицерина сходны с химическими свойствами одноатомных спиртов.
1) Многоатомные спирты реагируют с активными металлами:
 СН2 –ОН CH2–O–Na
СН2 –ОН CH2–O–Na

 + 2Na + H2
+ 2Na + H2 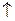
СН2–ОН СН2–О– Na
2) Многоатомные спирты реагируют с галогеноводородами:

 СН2 –ОН CH2–Cl
СН2 –ОН CH2–Cl
 + 2HCl + 2H2O
+ 2HCl + 2H2O
СН2–ОН СН2–Cl
3) Для многоатомных спиртов характерны и некоторые специфические свойства. Например, если к свежеприготовленном гидроксиду меди (II) в присутствии щёлочи прилить глицерин и смесь встряхнуть, то осадок растворяется и образуется раствор ярко-синего цвета.
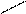 H
H




 СН2–О–Н Н – О CH2–O O–CH2
СН2–О–Н Н – О CH2–O O–CH2


 + Cu Cu
+ Cu Cu


 2СН –О–Н Н–О CH–O О– СН+2Н2О
2СН –О–Н Н–О CH–O О– СН+2Н2О

 H
H
CH2–O–H CH2–OH HO – CH2
глицерин меди (II)
комплексное соединение
Контрольные вопросы:
1. Какие соединения называют многоатомными спиртами? Приведите молекулярную, структурную и электронную формулы (бутантриола-1,2.4).
2. Охарактеризуйте химические свойства этиленгликоля и глицерина. Напишите уравнения соответствующих реакций и перечислите одинаковые и различные свойства одноатомных и многоатомных спиртов.
Лекция 22
Альдегиды и кетоны. Строение карбонильной группы. Физические и химические свойства
План
1. Общая характеристика альдегидов.
2. Строение молекул альдегидов.
3. Изомерия и номенклатура.
4. Физические свойства.
5. Получение.
6. Химические свойства.

 1. Общая характеристика альдегидов. Карбонильные соединения – это органические вещества, которые содержат карбонильную группу С=О. К ним относятся альдегиды и кетоны.
1. Общая характеристика альдегидов. Карбонильные соединения – это органические вещества, которые содержат карбонильную группу С=О. К ним относятся альдегиды и кетоны.
В молекулах альдегидов карбонильная группа связана с атомом водорода:
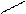
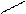 О
О

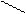 – С
– С
Н
Эту группу атомов считают функциональной группой альдегидов и называют альдегидной группой.
Альдегиды – это органические вещества, содержащие функциональную группу
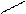
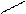 О
О

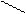 – С (альдегидную группу).
– С (альдегидную группу).
Н
С некоторыми альдегидами вы уже знакомы. Так, например, муравьиный альдегид, или формальдегид, образуется при окислении метанола, уксусный альдегид, или ацетальдегид, – при окислении этанола.
В молекулах всех альдегидов группа связана с углеводородным радикалом. (Исключение – формальдегид, в молекуле которого альдегидная группа связана с атомом водорода). Обозначив углеводородный радикал латинской R, можно записать общую формулу альдегидов:
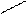
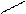 О
О
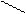
 R– С
R– С
Н
В молекулах КЕТОНОВ карбонильная группа связана с двумя углеводородными радикалами:
Общая формула кетонов:


 R– C – R1
R– C – R1
О

 Простейший представитель кетонов – ацетон: СН3– C – СН3
Простейший представитель кетонов – ацетон: СН3– C – СН3
О
2. Строение молекул альдегидов. В молекулах альдегидов между атомами углерода и водорода существует 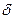 – связь, а между атомами углерода – одна
– связь, а между атомами углерода – одна 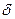 -и одна
-и одна 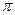 -связь. Атом углерода находится в состоянии sp2– гибридизации. Электронная плотность, преимущественно
-связь. Атом углерода находится в состоянии sp2– гибридизации. Электронная плотность, преимущественно 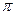 -связи как наиболее подвижной, смещается от атома углерода к более электроотрицательному атому кислорода. Поэтому атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный.
-связи как наиболее подвижной, смещается от атома углерода к более электроотрицательному атому кислорода. Поэтому атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный.
3. Изомерия и номенклатура. Для альдегидов характерна изомерия углеродного скелета он может иметь либо неразветвлённую, либо разветвлённую цепь. Для кетонов возможна изомерия углеродного скелета и изомерия положения карбонильной группы.
Названия альдегидов происходит от исторических названий соответствующих органических кислот, в которые эти альдегиды превращаются при окислении (муравьиный альдегид. Уксусный альдегид, пропионовый альдегид и т. д). По международной номенклатуре названия альдегидов образуют от названий соответствующих углеводородов с прибавлением суффикса - аль. Перед названием указывают положение и названия заместителей в углеродной цепи. Например:
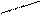
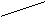
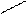
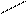
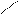
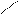
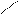 О O О
О O О

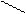
 Н– С СН3– С СН3– СН – С
Н– С СН3– С СН3– СН – С

 Н Н
Н Н
Н СН3
метаналь этаналь 2-метилпропаналь
(муравьиный альдегид) (уксусный альдегид, (изомасляный альдегид)
формальдегид) ацетальдегид)
Название кетогруппы отражают суффиком – он, например:
Н3С – С– СН3 Н3С – С – СН2– СН3





О О
ацетон, или пропанон бутанон
1 2 3 4 5



 Н3С – С – СН2– СН2– СН3 Н3С – СН2– С – СН2– СН3
Н3С – С – СН2– СН2– СН3 Н3С – СН2– С – СН2– СН3
О О
пентанон-2 пентанон-3
4. Физические свойства. Метаналь – бесцветный ядовитый газ с резким запахом. Раствор метаналя в воде (35–40%-ный) называют формалином. Остальные члены ряда альдегидов – жидкости, а высшие альдегиды – твёрдые вещества. Ацетон – легколетучая жидкость.
5. Получение. В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие вещества, способные отдавать кислород. В общем виде это можно показать так:
 O
O
 R – CH2– O–H+[O]
R – CH2– O–H+[O]  R – C +H2O
R – C +H2O
 Н
Н
В промышленности альдегиды получают различными способами. Основную массу формальдегида производят из метанола, пропуская его пары вместе с воздухом через реактор с раскалённой серебряной сеткой:

 t, Ag O
t, Ag O
 2СН3ОН + О2 2H– C +2H2O
2СН3ОН + О2 2H– C +2H2O
H
6. Химические свойства. Для альдегидов наиболее характерны реакции окисления и присоединения.
Реакции окисления. 1) Реакция «серебряного зеркала». Для осуществления этой реакции в чистую пробирку наливают аммиачный раствор оксида серебра ( I) (Ag2O в воде практически не растворяется, но с аммиаком образует растворимое соединение [Ag(NH3)2] OH, к нему добавляют раствор альдегида и нагревают:
1) СН3– СНО+2[Ag(NH3)2] OH 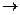 2Ag
2Ag 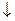 +CH3COONH4+3NH3+H2O
+CH3COONH4+3NH3+H2O
В общем виде это уравнение часто записывают так:

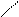
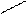
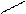 О t,аммиачный раствор O
О t,аммиачный раствор O

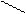

 R– С +Ag2O R – C +2Ag
R– С +Ag2O R – C +2Ag 
Н OH
Восстановленное серебро оседает на стенках пробирки в виде блестящего налёта. А альдегид окисляется в соответствующую органическую кислоту.
2) Другой качественной реакцией на альдегиды является их окисление гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида в щелочной среде и смесь нагреть, то появляется жёлтый осадок гидроокиси меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I).
+2 +1
 СН3– СНО+2Сu(OH)2+NaOH CH3COONa + Cu2O +3H2O
СН3– СНО+2Сu(OH)2+NaOH CH3COONa + Cu2O +3H2O
Контрольные вопросы
1. Как можно двумя способами доказать, что в данном растворе содержится альдегид? Приведите уравнения соответствующих реакций.
2. Перечислите области применения важнейших альдегидов и кетонов. На каких свойствах основано их использование?
Лекция 23
Карбоновые кислоты. Строение карбоксильной группы. Номенклатура.
План
1. Функциональная группа карбоновых кислот.
2. Изомерия и номенклатура.
3. Нахождение в природе.
4. Физические свойства.
5. Получение.
1. Функциональная группа карбоновых кислот.
Функциональную группу карбоновых кислот называют карбоксильной группой или карбоксогруппой. Карбоксильная группа – СООН состоит из карбонильной группы > С =О и гидроксильной группы – ОН.
Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.
Карбоновые кислоты классифицируют: а) в зависимости от числа карбоксильных групп в молекуле на одноосновные двухосновные и многоосновные; б) в зависимости от природы радикала на предельные, непредельные и ароматические.
В молекулах одноосновных предельных карбоновых кислот имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода.
Общая формула одноосновных карбоновых кислот R – COOH .
2. Изомерия и номенклатура. Изомерия предельных одноосновных карбоновых кислот аналогична изомерии альдегидов.
Чаще всего употребляют исторически сложившиеся названия кислот (муравьиная, уксусная и т.д.). По международной номенклатуре названия карбоновых кислот образуют от названий соответствующих углеводородов с прибавлением окончания –овая и слова кислота СН3–СООН.
3. Нахождение в природе. Муравьиная кислота содержится в выделениях муравьёв, в крапиве и хвое ели. Ожог крапивой – это результат раздражающего действия муравьиной кислоты. Масляная (бутановая) кислота входит в состав прогорклого масла, а валериановая (пентановая) кислота содержится в корнях валерианы.
4. Физические свойства. Низшие карбоновые кислоты – жидкости с острым запахом, хорошо растворимые в воде.
С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (нонановой) СН3(СН2)7СООН, – твёрдые вещества, без запаха, нерастворимые в воде.
5. Получение. В лаборатории карбоновые кислоты, как ии кислоты неорганические, можно получить из их солей, действуя на них серной кислотой.
О О
∕∕ t ∕∕
2СН3 – С + H2SO4 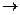 Na2SO4 + 2CH3 – C
Na2SO4 + 2CH3 – C
\ \
О – Na O –H
Контрольные вопросы
1. Какие соединения относят к карбоновым кислотам? Как их
классифицируют. Приведите по одному примеру из каждой группы
кислот.
2. Какие две кислоты имеют общую молекулярную формулу С4Н8О2?
Назовите их.
Лекция 24
Сложные эфиры.
План
1. Номенклатура.
2. Нахождение в природе и физические свойства.
3. Получение.
4. Химические свойства.
5. Применение.
1. Номенклатура. Органические вещества, которые образуются в реакциях кислот со спиртами, относят к сложным эфирам.
Реакции образования сложных эфиров идут с отщеплением воды:
O O
∕∕ ∕∕
R – C + H – O – R1 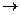 R – C + H2O
R – C + H2O
\ \
O – H O – R1
Дата: 2019-02-02, просмотров: 569.