По строению углеродного скелета и по кратности связей
Схема 1
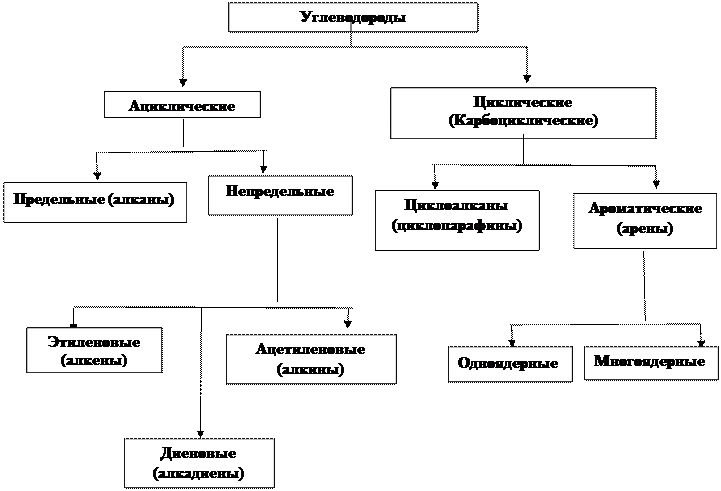
Классификация органических соединений
По функциональным группам
Схема 2
 | |||||||||||||||
 | |||||||||||||||
 |  | ||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||

|
Контрольные вопросы
1. Какое значение имеет в химии классификация веществ?
2. По каким двум признакам принято классифицировать органические
вещества?
3. Какие вещества называют производными углеводородов?
Лекция 9
Тема: Классификация химических реакций в неорганической
И органической химии.
План
1. Типы органических реакций.
Органические реакции, как и не органические подразделяются на реакции замещения, присоединения и отщепления. Особый, важный тип реакций при соединении составляют взаимодействия между несколькими органическими молекулами, ведущие к усложнению углеводородного скелета: такие превращения называют реакциями полимеризации и конденсации.
В современной органической химии, кроме того, реакции классифицируют по их механизмам: по характеру протекающих в ходе реакции элементарных актов (отдельных стадий разрыва и образования связей). Способом разрыва связей различают два.
Гомолитический (радикальный) разрыв ковалентной связи, заключающийся в том, что связующая электронная пара разъединяется и каждый из образующихся осколков (свободных радикалов, атомов) получает один не спаренный электрон. Например:
Н Н
Н : С : Н 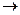 Н : С . + .Н
Н : С . + .Н
: :
Н Н
радикал атом
метил водорода
(радикал водорода)
Радикальному разрыву подвергаются обычно неполярные или малополярные ковалентные связи (С – С, С – Н, N – N) при высокой температуре, под действием света или радиоактивного излучения. Образовавшиеся частицы неустойчивы, они быстро вступают в дальнейшее превращения. Так, например, радикал метил и атом водорода могут превратиться в устойчивые продукты путем димеризации:
СН3 + СН3 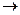 Н3С – СН3; .Н + .Н
Н3С – СН3; .Н + .Н 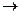 Н:Н
Н:Н
СН3. + .Н 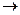 СН4
СН4
Когда в реакционной смеси присутствуют другие вещества (специально добавленные реагенты или примеси), то осуществляются иные пути превращения радикалов в устойчивые продукты.
Гетеролитический (ионный) разрыв ковалентной связи, приводящий к переходу связующей электронной пары к одному из осколков, в результате чего образуются катион и анион, например:
Н Н
: :
Н : С : I 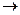 Н : С+ + : I-
Н : С+ + : I-
: :
Н Н
иодистый метил- иодид-
метил катион анион
К гетеролитическому разрыву склонны сильно полярные и легко поляризуемые связи. Ему способствуют растворители с высокой диэлектрической постоянной и большой полярностью.
Метил-катион и другие карбокатионные частицы имеют атом с 6 электронами на внешнем уровне: они легко вступают в реакцию с частицами, обладающими избытком электронной плотности в виде полного или частичного отрицательного заряда либо имеющими свободную электронную пару. Такие частицы называют нуклеофильными («любящими ядра»).
Например:
СН3+ + : ОН- 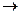 СН3ОН
СН3ОН
К нуклеофильным реагентам относятся вода, основания, аммиак, кислотные остатки (например, CN-, SO3H-), галогенид-ионы.
Гетеролитический разрыв ковалентной связи может приводить и к образованию органических анионов (карбанионов), например:
CH3:Li 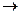 CH3- : Li+
CH3- : Li+
Превращение неустойчивых карбанионов в конечные продукты происходит за счет их реакций с электрофильными реагентами. К ним относятся протон, катионы металлов, карбокатионы. Примером может служить реакция метиллития с водой:
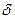 -
- 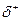
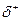
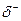
СН3: Li + H– OH 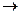 CH4 + Li++OH-
CH4 + Li++OH-
Приведенные примеры показывают, что характер ионного разрыва зависит от того, как поляризована разрывающаяся связь в исходной молекуле.
Существует определенная аналогия между используемыми в органической химии понятиями нуклеофильных и электрофильных реагентов понятиями анионов и катионов в неорганической химии: нуклеофильные частицы заряжены отрицательно, подобно анионам, электрофильные – положительно, подобно катионам. Однако это не такие ионы, как в неорганической химии. Неорганические соли, основания, кислоты диссоциируют в водных растворах, их ионы присутствуют в растворах постоянно. До реакции после неё. Органические же ионные частицы появляются только мимолетно, в момент реакции. Во многих случаях вообще правильнее говорить не о свободных ионах, а о сильно поляризованных молекулах.
Обычно даже в простых органических соединениях имеется много связей между атомами. Так. Например, в молекуле этилового спирта
Н Н
1│ 2│ 4 5
Н – С – С – О – Н их 8, причем
│ │3
Н Н
разрыв пяти продуктов реакции. В ходе реакции рвутся преимущественно определенные связи, а остальные остаются незатронутыми. Такую особенность органических реакций называют принципом наименьшего изменения строения. При реакции затрагиваются главным образом связи функциональных групп, кратные углерод - углеродные связи. Так у этилового спирта в большинстве реакций затрагиваются связи О–Н или С – О, в то время как углеводородный радикал обычно остается неизменным.
Принцип наименьшего изменения строения иногда нарушается.
Контрольные вопросы
1. Определите, какая из связей в каждой паре более связана в гетеролитическому расщеплению: а) C– Cl или C – I;
б) Н – О или Н – С;
в) С – О или C – Br.
Лекция 16
Дата: 2019-02-02, просмотров: 407.