Лекция 8
Тема: Важнейшие классы органических соединений.
Основы номенклатуры.
План
1. Классификация органических соединений.
Так как органических соединений много, то необходимо их сгруппировать по определённым классам, т.е. классифицировать. При ознакомлении с простейшими представителями каждого класса соединений можно получить общее представление о соединениях всех классов. Основой классификации органических веществ, принято считать вещества, которые состоят только из углерода и водорода. Такие вещества называют углеводородами. Все остальные органические вещества – производные углеводородов. Их можно считать соответствующими продуктами замены одного или нескольких атомов водорода в молекуле углеводорода атомами группами атомов других элементов:
|



 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
| ||||
| ||||
Химией углеводородов и их производных назвал органическую химию в 1871 г. К. Шорлеммер – немецкий химик-органик.
Любая классификация основана на определённых признаках. В основу современной классификации органических соединений положены два важнейших признака:
– строение углеродного скелета молекулы;
– наличие в молекуле функциональных групп.
Функциональная группа это атомы или группа атомов в молекуле вещества, определяющие его химические свойства.
К функциональным группам относят, например, гидроксогруппу (гидроксильную группу) – ОН, аминогруппу – NH2 и др. По функциональным группам определяют принадлежность данного соединения к тому или иному классу веществ.
Классификация углеводородов, в основу которой положено их химическое строение и ИВД химической связи, представлена на схеме 1. Если же за основу классификации взять наличие функциональных групп, то она будет выглядеть иначе(схема 2).
Классификация органических соединений
По строению углеродного скелета и по кратности связей
Схема 1
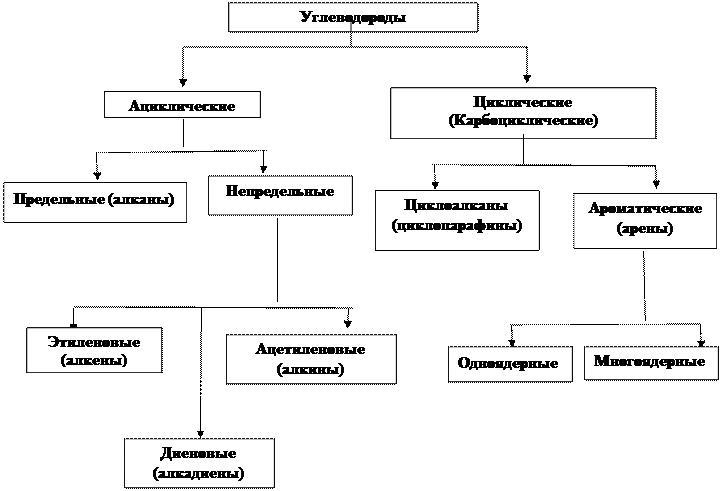
Классификация органических соединений
По функциональным группам
Схема 2
 | |||||||||||||||
 | |||||||||||||||
 |  | ||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||

|
Контрольные вопросы
1. Какое значение имеет в химии классификация веществ?
2. По каким двум признакам принято классифицировать органические
вещества?
3. Какие вещества называют производными углеводородов?
Лекция 9
Тема: Классификация химических реакций в неорганической
И органической химии.
План
1. Типы органических реакций.
Органические реакции, как и не органические подразделяются на реакции замещения, присоединения и отщепления. Особый, важный тип реакций при соединении составляют взаимодействия между несколькими органическими молекулами, ведущие к усложнению углеводородного скелета: такие превращения называют реакциями полимеризации и конденсации.
В современной органической химии, кроме того, реакции классифицируют по их механизмам: по характеру протекающих в ходе реакции элементарных актов (отдельных стадий разрыва и образования связей). Способом разрыва связей различают два.
Гомолитический (радикальный) разрыв ковалентной связи, заключающийся в том, что связующая электронная пара разъединяется и каждый из образующихся осколков (свободных радикалов, атомов) получает один не спаренный электрон. Например:
Н Н
Н : С : Н 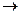 Н : С . + .Н
Н : С . + .Н
: :
Н Н
радикал атом
метил водорода
(радикал водорода)
Радикальному разрыву подвергаются обычно неполярные или малополярные ковалентные связи (С – С, С – Н, N – N) при высокой температуре, под действием света или радиоактивного излучения. Образовавшиеся частицы неустойчивы, они быстро вступают в дальнейшее превращения. Так, например, радикал метил и атом водорода могут превратиться в устойчивые продукты путем димеризации:
СН3 + СН3 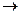 Н3С – СН3; .Н + .Н
Н3С – СН3; .Н + .Н 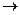 Н:Н
Н:Н
СН3. + .Н 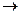 СН4
СН4
Когда в реакционной смеси присутствуют другие вещества (специально добавленные реагенты или примеси), то осуществляются иные пути превращения радикалов в устойчивые продукты.
Гетеролитический (ионный) разрыв ковалентной связи, приводящий к переходу связующей электронной пары к одному из осколков, в результате чего образуются катион и анион, например:
Н Н
: :
Н : С : I 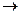 Н : С+ + : I-
Н : С+ + : I-
: :
Н Н
иодистый метил- иодид-
метил катион анион
К гетеролитическому разрыву склонны сильно полярные и легко поляризуемые связи. Ему способствуют растворители с высокой диэлектрической постоянной и большой полярностью.
Метил-катион и другие карбокатионные частицы имеют атом с 6 электронами на внешнем уровне: они легко вступают в реакцию с частицами, обладающими избытком электронной плотности в виде полного или частичного отрицательного заряда либо имеющими свободную электронную пару. Такие частицы называют нуклеофильными («любящими ядра»).
Например:
СН3+ + : ОН- 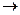 СН3ОН
СН3ОН
К нуклеофильным реагентам относятся вода, основания, аммиак, кислотные остатки (например, CN-, SO3H-), галогенид-ионы.
Гетеролитический разрыв ковалентной связи может приводить и к образованию органических анионов (карбанионов), например:
CH3:Li 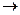 CH3- : Li+
CH3- : Li+
Превращение неустойчивых карбанионов в конечные продукты происходит за счет их реакций с электрофильными реагентами. К ним относятся протон, катионы металлов, карбокатионы. Примером может служить реакция метиллития с водой:
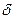 -
- 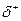
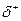
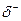
СН3: Li + H– OH  CH4 + Li++OH-
CH4 + Li++OH-
Приведенные примеры показывают, что характер ионного разрыва зависит от того, как поляризована разрывающаяся связь в исходной молекуле.
Существует определенная аналогия между используемыми в органической химии понятиями нуклеофильных и электрофильных реагентов понятиями анионов и катионов в неорганической химии: нуклеофильные частицы заряжены отрицательно, подобно анионам, электрофильные – положительно, подобно катионам. Однако это не такие ионы, как в неорганической химии. Неорганические соли, основания, кислоты диссоциируют в водных растворах, их ионы присутствуют в растворах постоянно. До реакции после неё. Органические же ионные частицы появляются только мимолетно, в момент реакции. Во многих случаях вообще правильнее говорить не о свободных ионах, а о сильно поляризованных молекулах.
Обычно даже в простых органических соединениях имеется много связей между атомами. Так. Например, в молекуле этилового спирта
Н Н
1│ 2│ 4 5
Н – С – С – О – Н их 8, причем
│ │3
Н Н
разрыв пяти продуктов реакции. В ходе реакции рвутся преимущественно определенные связи, а остальные остаются незатронутыми. Такую особенность органических реакций называют принципом наименьшего изменения строения. При реакции затрагиваются главным образом связи функциональных групп, кратные углерод - углеродные связи. Так у этилового спирта в большинстве реакций затрагиваются связи О–Н или С – О, в то время как углеводородный радикал обычно остается неизменным.
Принцип наименьшего изменения строения иногда нарушается.
Контрольные вопросы
1. Определите, какая из связей в каждой паре более связана в гетеролитическому расщеплению: а) C– Cl или C – I;
б) Н – О или Н – С;
в) С – О или C – Br.
Лекция 16
План
1. Химические свойства.
2. Получение и применение.
3. Применение.
1.Химические свойства. Для аренов наиболее характерны реакции замещения атомов водорода в бензольном кольце на другие атомы или группы атомов.
Реакции замещения.
1) Галогенирование. В присутствии брома м катализатора – солей железа (III) – в бензоле происходит замена атомов водорода в бензольном кольце на атомы брома
FeBr3, t
 C6H6 + Br2 C6H5Br + HBr
C6H6 + Br2 C6H5Br + HBr
бромбензол
Аналогично бензол реагирует и с хлором.
2) Нитрование бензола (введение нитрогрупп – NO2 в его молекуле) проводят смесью концентрированных азотной и серной кислот:
 HNO3 + 2H2SO4 NO2+ + H3O+ + 2HSO4-
HNO3 + 2H2SO4 NO2+ + H3O+ + 2HSO4-
Образующийся катион нитрония NO+2 взаимодействует с бензолом:
 C6H6 + NO2 + C6H5NO2 + H+
C6H6 + NO2 + C6H5NO2 + H+
нитробензол
При нитровании метилбензола (толуола) происходит замена трёх атомов водорода на нитрогруппы:
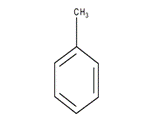 Реакции окисления. Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
Реакции окисления. Бензол очень стоек к окислению. В отличие от него ароматические углеводороды с боковыми цепями окисляются относительно легко.
метилбензол
1.При действии энергичных окислителей (KMnO4) на гомологи бензола окислению подвергаются только боковые цепи. Если, например, в пробирку налить 2-3 мл толуола, затем добавить к нему раствор перманганата калия и нагреть,
то можно заметить, что фиолетовая окраска раствора постепенно обесцвечивается. Это происходит потому, что под действием перманганата калия метильная группа толуола окисляется и превращается в карбоксильную
группу – СОООН: О
//
С6Н5 – СН3 + 3 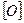
 С6Н5 – С \ + Н2О
С6Н5 – С \ + Н2О
ОН
бензойная кислота
2) Бензол и его гомологи на воздухе горят коптящим пламенем:
2С6Н6 + 15О2 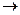 12СО2 + 6Н2О
12СО2 + 6Н2О
Реакции присоединения для бензола не характерны и протекают с трудом (в жёстких условиях).
1. При действии солнечного света или ультрафиолетовых лучей бензол присоединяет хлор и образуется гексахлорциклогексан (гексахлоран)
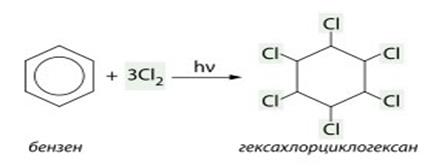
2) Бензол способен также гидрироваться (при нагревании, повышенном давлении и в присутствии катализатора).
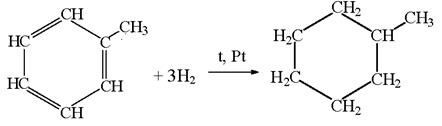
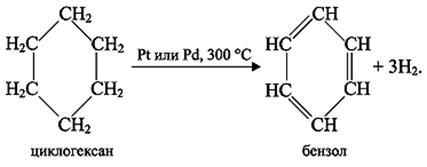
2. Получение. В настоящее время основной источник получения бензола в промышленности – переработка нефти. Незначительные количества бензола получают из каменноугольной смолы и газов, образующихся при коксовании (пиролизе) углей.
Русский учёный Н.Д. Зеленский доказал, что бензол можно получить из циклогексана, выделяемого из некоторых сортов нефти:
Если пропускать ацетилен при 4500 – 5000С над активированным углем, то он также превращается в бензол:
3. Применение. Бензол является ценным продуктом для получения красителей, медикаментов, взрывчатых веществ, средств защиты растений, пластмасс и синтетических волокон. Он является также хорошим растворителем многих органических веществ. Толуол используют для получения красителей и тринитротолуола.
Некоторые хлорпроизводные органических веществ используют для защиты растений. Например, гексахлорбензолом C6Cl6 протравливают семена зерновых для защиты от твёрдой головни. Эти и многие другие вещества относят к пестицидам.
В агрохимической практике в основном применяют инсектициды – средства борьбы с насекомыми, гербициды – для борьбы с сорняками, фунгициды – для устранения грибковых заболеваний.
Контрольные вопросы
1. Как получают ароматические углеводороды? Приведите уравнения соответствующих реакций.
2. Сравните химические свойства бензола и толуола и поясните сущность взаимного влияния атомов в молекулах. Вспомните соответствующее положение из теории А.М. Бутлерова и приведите другие примеры.
3. Какие мероприятия осуществляются в вашей местности по охране окружающей среды? Подготовьте компьютерную презентацию на эту тему.
Лекция 17
Тема: Нефть, газ, уголь.
План
1. Природный газ.
2. Нефть.
3. Попутные нефтяные газы.
1. Природный газ. Запасы природного газа на нашей планете очень велики.
Основной компонент природного газа – метан. Также в природном газе содержатся этан, пропан и бутан. Существует следующая закономерность: чем выше относительная молекулярная масса углеводорода, тем меньше его содержится в природном газе.
При сгорании природного газа выделяется много теплоты, поэтому он служит эффективным и дешёвым топливом. Использование на производстве природного газа даёт возможность значительно повысить производительность труда.
Следует отметить и такие преимущества газообразного топлива, как лёгкость воспламенения, возможность предварительного нагрева и получения высокой температуры, отсутствие золы и шлака при сгорании.
Природный газ – важный источник сырья для химической промышленности. Его используют для получения ацетилена, этилена, водорода, сажи, различных пластмасс, уксусной кислоты. Красителей, медикаментов.
2. Нефть – важнейшее полезное ископаемое. Это горючая маслянистая жидкость от светло-бурого дл чёрного цвета с характерным запахом. Она немного легче воды и практически в ней не растворяется. По запасам и добыче нефти наша страна одно из ведущих мест в мире.
В зависимости от месторождения нефть имеет различный качественный и количественный состав. Так, например, бакинская нефть богата циклопарафинами и сравнительно бедна предельными углеводорода. Значительно больше предельных углеводородов в сибирской, грозненской и ферганской нефти. Пермская нефть содержит ароматические углеводороды.
Залежи нефти находятся в недрах земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Если она находится под давлением газов, то поднимается по скважине на поверхность.
3. Попутные нефтяные газы – находятся над залежами нефти или растворены в ней под давлением. Ещё недавно попутные нефтяные газы не находили применения и их сжигали. В настоящее время их улавливают и используют как топливо и ценное химическое сырьё. В попутных газах содержится меньше метана, чем в природном газе, но в них значительно больше его гомологов. Для практических целей попутные газы разделяют на смеси более узкого состава. Иногда их подвергают более тщательному разделению и извлекают из них индивидуальные углеводороды (этан, пропан и т.д.), из которых затем получают непредельные углеводороды.
Каменный уголь образовался при разложении остатков древних растений примерно 300-350млн лет назад. Он представляет собой смесь высокомолекулярных органических соединений, а также воды и летучих веществ с небольшими количествами минеральных примесей. В состав каменного угля, кроме углерода, входят водород, кислород, сера и азот. Содержание углеродов в каменном угле, в зависимости от его сорта, составляет от 75 до 95%.
Один из основных способов получения углеводородов (в том числе и ароматических) из каменного угля – его коксование (нагревание до 10000С без доступа воздуха). Подобным методом на коксохимическом производстве из каменного угля получают четыре основных продукта: кокс, каменноугольную смолу, аммиак и коксовый газ.
Контрольные вопросы
1. Какие главные природные источники углеводородов вам известны?
2. Каков состав природного газа?
3. Какие преимущества по сравнению с другими видами топлива имеет природный газ?
4. Для каких целей используют природный газ в химической промышленности?
Лекция 18
План
1. Полициклические (многоядерные) ароматические соединения.
Многоядерные ароматические соединения, т.е. вещества, содержащие несколько бензольных циклов, можно разделить на несколько групп в зависимости от способа соединения бензольных циклов.
Так, два или более бензольных цикла могут быть непосредственно связаны друг с другом, как, например, в простейшем представителе этой группы – дифениле:
 | |||
 | |||
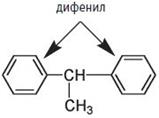
Два или более бензольных цикла, содержащихся в молекуле, могут быть разделены одной (или несколькими) метиленовой группой, как, например, в дифенилметане, 1,2-дифенилэтане или трифенилметане:
 |
 |



 СН2 дифенилэтан
СН2 дифенилэтан
1,2-дифенилэтан
Трифенилметан
1.1. Нафталин. Главным источником получения нафталина является каменноугольная смола, содержащая до 10% нафталина. При её фракционировании нафталин переходит вместе с фенолами во фракцию карболового масла. Фенолы отделяют от нафталина при помощи щелочи, растворяющей фенолы, а нафталин очищают перегонкой в вакууме и возгонкой.
Нафталин в виде своих многочисленных производных широко применяется для изготовления красителей, лекарственных, взрывчатых веществ, инсектицидов и т.д.
Атомы водорода в нафталине легко замещаются на электрофильные группы, причем в большинстве случаев легче получаются  производные. Во многих случаях
производные. Во многих случаях 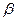 – производные могут быть получены лишь обходным путем.
– производные могут быть получены лишь обходным путем.
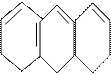
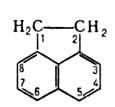
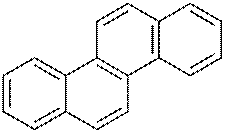
1.2. Антрацен и фенантрен, имеющие одинаковую молекулярную формулу С6Н10, содержатся в каменноугольной смоле, их выделяют из высококипящей фракции кантраценового масла».
Фенатрен – изомер антрацена. Эти соединения представляют собой конденсированные системы, состоящие из трех шестичленных циклов; причем в фенантрене циклы сочетаются иначе, чем в молекуле антрацена:
 | |||
 | |||


 | |||||
 | |||||
 | |||||

 антрацен
антрацен
фенатрен
Скелет гидрированного фенатрена лежит в основе многих природных структур: терпенов, алкалоидов, стероидов.
1.3. Конденсированные системы. Наряду с нафталином, антраценом и фенантреном в каменноугольном дегте содержится большое число других углеводорода с конденсированными циклами, например:
инден аценафтен хризен
пирен
Некоторые поликонденсированные углеводороды обладают высокойц канцерогенностью – способностью вызывать появление злокачественных опухолей
Лекция 19.
Лекция 20
Лекция 21
План
1. Классификация и номенклатура.
2. Получение.
3. Физические свойства.
4. Химические свойства.
1. Классификация и номенклатура. К многоатомным спиртам относят органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом.
Формулы многоатомных спиртов, как и одноатомных, можно вывести из формул соответствующих углеводородов, заменяя в них атомы водорода гидроксильными группами.
Если, например, в формуле этана гидроксильными группами заместить два атома водорода (по одному у каждого атома углерода), то получится формула двухатомного спирта этиленгликоля (этандиола-1.2):

 СН3 СН2–ОН
СН3 СН2–ОН

СН3 СН2–ОН
Из формулы пропана можно вывести формулу трёхатомного спирта глицерина (пропантриола-1,2,3):

 СН3 СН2–ОН
СН3 СН2–ОН


 СН2 СН–ОН
СН2 СН–ОН
СН3 СН2–ОН
По международной номенклатуре название многоатомных спиртов составляют следующим образом: основа названия – название предельного углеводорода с таким же числом атомов углерода с добавлением суффиксов – диол-. –триол- и т.д., затем через дефис цифрами указывают положение гидроксильных групп в углеродной цепи.
2. Получение. Нам уже известно, что этиленгликоль образуется при окислении перманганатом калия. Этиленгликоль и глицерин можно получить также из галогенопроизводных соответствующих углеводородов.
СН2– Cl H – OH CH2– OH


 + +2HCl
+ +2HCl
 CH2– Cl H–OH CH2– OH
CH2– Cl H–OH CH2– OH
3. Физические свойства. Этиленгликоль и глицерин – бесцветные сиропообразные жидкости сладковатого вкуса. Они хорошо растворяются в воде и в этаноле. Этиленгликоль кипит при температуре 197,60С. Этиленгликоль очень ядовит!
4.Химические свойства этиленгликоля и глицерина сходны с химическими свойствами одноатомных спиртов.
1) Многоатомные спирты реагируют с активными металлами:
 СН2 –ОН CH2–O–Na
СН2 –ОН CH2–O–Na

 + 2Na + H2
+ 2Na + H2 
СН2–ОН СН2–О– Na
2) Многоатомные спирты реагируют с галогеноводородами:

 СН2 –ОН CH2–Cl
СН2 –ОН CH2–Cl
 + 2HCl + 2H2O
+ 2HCl + 2H2O
СН2–ОН СН2–Cl
3) Для многоатомных спиртов характерны и некоторые специфические свойства. Например, если к свежеприготовленном гидроксиду меди (II) в присутствии щёлочи прилить глицерин и смесь встряхнуть, то осадок растворяется и образуется раствор ярко-синего цвета.
 H
H




 СН2–О–Н Н – О CH2–O O–CH2
СН2–О–Н Н – О CH2–O O–CH2


 + Cu Cu
+ Cu Cu


 2СН –О–Н Н–О CH–O О– СН+2Н2О
2СН –О–Н Н–О CH–O О– СН+2Н2О

 H
H
CH2–O–H CH2–OH HO – CH2
глицерин меди (II)
комплексное соединение
Контрольные вопросы:
1. Какие соединения называют многоатомными спиртами? Приведите молекулярную, структурную и электронную формулы (бутантриола-1,2.4).
2. Охарактеризуйте химические свойства этиленгликоля и глицерина. Напишите уравнения соответствующих реакций и перечислите одинаковые и различные свойства одноатомных и многоатомных спиртов.
Лекция 22
Альдегиды и кетоны. Строение карбонильной группы. Физические и химические свойства
План
1. Общая характеристика альдегидов.
2. Строение молекул альдегидов.
3. Изомерия и номенклатура.
4. Физические свойства.
5. Получение.
6. Химические свойства.

 1. Общая характеристика альдегидов. Карбонильные соединения – это органические вещества, которые содержат карбонильную группу С=О. К ним относятся альдегиды и кетоны.
1. Общая характеристика альдегидов. Карбонильные соединения – это органические вещества, которые содержат карбонильную группу С=О. К ним относятся альдегиды и кетоны.
В молекулах альдегидов карбонильная группа связана с атомом водорода:
 О
О

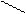 – С
– С
Н
Эту группу атомов считают функциональной группой альдегидов и называют альдегидной группой.
Альдегиды – это органические вещества, содержащие функциональную группу
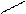
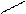 О
О

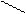 – С (альдегидную группу).
– С (альдегидную группу).
Н
С некоторыми альдегидами вы уже знакомы. Так, например, муравьиный альдегид, или формальдегид, образуется при окислении метанола, уксусный альдегид, или ацетальдегид, – при окислении этанола.
В молекулах всех альдегидов группа связана с углеводородным радикалом. (Исключение – формальдегид, в молекуле которого альдегидная группа связана с атомом водорода). Обозначив углеводородный радикал латинской R, можно записать общую формулу альдегидов:
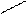
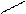 О
О
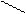
 R– С
R– С
Н
В молекулах КЕТОНОВ карбонильная группа связана с двумя углеводородными радикалами:
Общая формула кетонов:


 R– C – R1
R– C – R1
О

 Простейший представитель кетонов – ацетон: СН3– C – СН3
Простейший представитель кетонов – ацетон: СН3– C – СН3
О
2. Строение молекул альдегидов. В молекулах альдегидов между атомами углерода и водорода существует 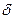 – связь, а между атомами углерода – одна
– связь, а между атомами углерода – одна 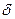 -и одна
-и одна 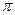 -связь. Атом углерода находится в состоянии sp2– гибридизации. Электронная плотность, преимущественно
-связь. Атом углерода находится в состоянии sp2– гибридизации. Электронная плотность, преимущественно 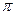 -связи как наиболее подвижной, смещается от атома углерода к более электроотрицательному атому кислорода. Поэтому атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный.
-связи как наиболее подвижной, смещается от атома углерода к более электроотрицательному атому кислорода. Поэтому атом углерода приобретает частичный положительный заряд, а атом кислорода – частичный отрицательный.
3. Изомерия и номенклатура. Для альдегидов характерна изомерия углеродного скелета он может иметь либо неразветвлённую, либо разветвлённую цепь. Для кетонов возможна изомерия углеродного скелета и изомерия положения карбонильной группы.
Названия альдегидов происходит от исторических названий соответствующих органических кислот, в которые эти альдегиды превращаются при окислении (муравьиный альдегид. Уксусный альдегид, пропионовый альдегид и т. д). По международной номенклатуре названия альдегидов образуют от названий соответствующих углеводородов с прибавлением суффикса - аль. Перед названием указывают положение и названия заместителей в углеродной цепи. Например:
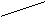
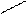
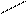
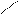
 О O О
О O О

 Н– С СН3– С СН3– СН – С
Н– С СН3– С СН3– СН – С

 Н Н
Н Н
Н СН3
метаналь этаналь 2-метилпропаналь
(муравьиный альдегид) (уксусный альдегид, (изомасляный альдегид)
формальдегид) ацетальдегид)
Название кетогруппы отражают суффиком – он, например:
Н3С – С– СН3 Н3С – С – СН2– СН3





О О
ацетон, или пропанон бутанон
1 2 3 4 5



 Н3С – С – СН2– СН2– СН3 Н3С – СН2– С – СН2– СН3
Н3С – С – СН2– СН2– СН3 Н3С – СН2– С – СН2– СН3
О О
пентанон-2 пентанон-3
4. Физические свойства. Метаналь – бесцветный ядовитый газ с резким запахом. Раствор метаналя в воде (35–40%-ный) называют формалином. Остальные члены ряда альдегидов – жидкости, а высшие альдегиды – твёрдые вещества. Ацетон – легколетучая жидкость.
5. Получение. В лаборатории альдегиды получают окислением первичных спиртов. В качестве окислителей применяют оксид меди (II), пероксид водорода и другие вещества, способные отдавать кислород. В общем виде это можно показать так:
 O
O
 R – CH2– O–H+[O]
R – CH2– O–H+[O] 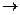 R – C +H2O
R – C +H2O
 Н
Н
В промышленности альдегиды получают различными способами. Основную массу формальдегида производят из метанола, пропуская его пары вместе с воздухом через реактор с раскалённой серебряной сеткой:

 t, Ag O
t, Ag O
 2СН3ОН + О2 2H– C +2H2O
2СН3ОН + О2 2H– C +2H2O
H
6. Химические свойства. Для альдегидов наиболее характерны реакции окисления и присоединения.
Реакции окисления. 1) Реакция «серебряного зеркала». Для осуществления этой реакции в чистую пробирку наливают аммиачный раствор оксида серебра ( I) (Ag2O в воде практически не растворяется, но с аммиаком образует растворимое соединение [Ag(NH3)2] OH, к нему добавляют раствор альдегида и нагревают:
1) СН3– СНО+2[Ag(NH3)2] OH 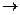 2Ag
2Ag  +CH3COONH4+3NH3+H2O
+CH3COONH4+3NH3+H2O
В общем виде это уравнение часто записывают так:

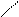
 О t,аммиачный раствор O
О t,аммиачный раствор O


 R– С +Ag2O R – C +2Ag
R– С +Ag2O R – C +2Ag 
Н OH
Восстановленное серебро оседает на стенках пробирки в виде блестящего налёта. А альдегид окисляется в соответствующую органическую кислоту.
2) Другой качественной реакцией на альдегиды является их окисление гидроксидом меди (II). Если к голубому осадку гидроксида меди (II) прилить раствор альдегида в щелочной среде и смесь нагреть, то появляется жёлтый осадок гидроокиси меди (I), который при дальнейшем нагревании превращается в красный оксид меди (I).
+2 +1
 СН3– СНО+2Сu(OH)2+NaOH CH3COONa + Cu2O +3H2O
СН3– СНО+2Сu(OH)2+NaOH CH3COONa + Cu2O +3H2O
Контрольные вопросы
1. Как можно двумя способами доказать, что в данном растворе содержится альдегид? Приведите уравнения соответствующих реакций.
2. Перечислите области применения важнейших альдегидов и кетонов. На каких свойствах основано их использование?
Лекция 23
Карбоновые кислоты. Строение карбоксильной группы. Номенклатура.
План
1. Функциональная группа карбоновых кислот.
2. Изомерия и номенклатура.
3. Нахождение в природе.
4. Физические свойства.
5. Получение.
1. Функциональная группа карбоновых кислот.
Функциональную группу карбоновых кислот называют карбоксильной группой или карбоксогруппой. Карбоксильная группа – СООН состоит из карбонильной группы > С =О и гидроксильной группы – ОН.
Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп, соединённых с углеводородным радикалом или водородным атомом.
Карбоновые кислоты классифицируют: а) в зависимости от числа карбоксильных групп в молекуле на одноосновные двухосновные и многоосновные; б) в зависимости от природы радикала на предельные, непредельные и ароматические.
В молекулах одноосновных предельных карбоновых кислот имеется одна карбоксильная группа, связанная с радикалом предельного углеводорода или с атомом водорода.
Общая формула одноосновных карбоновых кислот R – COOH .
2. Изомерия и номенклатура. Изомерия предельных одноосновных карбоновых кислот аналогична изомерии альдегидов.
Чаще всего употребляют исторически сложившиеся названия кислот (муравьиная, уксусная и т.д.). По международной номенклатуре названия карбоновых кислот образуют от названий соответствующих углеводородов с прибавлением окончания –овая и слова кислота СН3–СООН.
3. Нахождение в природе. Муравьиная кислота содержится в выделениях муравьёв, в крапиве и хвое ели. Ожог крапивой – это результат раздражающего действия муравьиной кислоты. Масляная (бутановая) кислота входит в состав прогорклого масла, а валериановая (пентановая) кислота содержится в корнях валерианы.
4. Физические свойства. Низшие карбоновые кислоты – жидкости с острым запахом, хорошо растворимые в воде.
С повышением относительной молекулярной массы растворимость кислот в воде уменьшается, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (нонановой) СН3(СН2)7СООН, – твёрдые вещества, без запаха, нерастворимые в воде.
5. Получение. В лаборатории карбоновые кислоты, как ии кислоты неорганические, можно получить из их солей, действуя на них серной кислотой.
О О
∕∕ t ∕∕
2СН3 – С + H2SO4  Na2SO4 + 2CH3 – C
Na2SO4 + 2CH3 – C
\ \
О – Na O –H
Контрольные вопросы
1. Какие соединения относят к карбоновым кислотам? Как их
классифицируют. Приведите по одному примеру из каждой группы
кислот.
2. Какие две кислоты имеют общую молекулярную формулу С4Н8О2?
Назовите их.
Лекция 24
Сложные эфиры.
План
1. Номенклатура.
2. Нахождение в природе и физические свойства.
3. Получение.
4. Химические свойства.
5. Применение.
1. Номенклатура. Органические вещества, которые образуются в реакциях кислот со спиртами, относят к сложным эфирам.
Реакции образования сложных эфиров идут с отщеплением воды:
O O
∕∕ ∕∕
R – C + H – O – R1  R – C + H2O
R – C + H2O
\ \
O – H O – R1
Лекция 25
План
1. Номенклатура.
2. Строение молекул и химические свойства.
3. Физические свойства анилина.
4. Получение.
1. Номенклатура.
Аминами называют производные аммиака, в молекулах которого один или несколько атомов водорода замещены углеводородными радикалами:
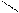
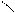 СН3 – NH2 CH3 CH3
СН3 – NH2 CH3 CH3
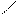 NH CH3 –– N
NH CH3 –– N
 CH3
CH3
CH3
метиламин диметиламин триметиламин
(первичный амин) (вторичный амин) (третичный амин)
Заместители могут быть как одинаковыми, так и разными. Они могут быть предельными, непредельными, циклическими, ароматическими:
 СН3
СН3
 NH C6H5 – NH2
NH C6H5 – NH2
СН3 – СН2
метилэтиламин фениламин (анилин)
Функциональная группа аминов – аминогруппа – NH2. Общая формула аминов R –NH2.
Амины образуются при разложении азотсодержащих веществ (например, белков). Так, специфический запах моря обусловлен аминами, образовавшимися при разложении морских организмов.
2. Строение молекул и химические свойства. Строение молекул аминов аналогично строению молекулы аммиака, и поэтому свойства этих веществ сходны. В молекулах аминов орбитали атома азота находятся в состоянии sp3- гибридизации, три гибридные орбитали образуют связи с углеродом и водородом, а четвёртая содержит неподелённую пару электронов.
В водном растворе и в присутствии кислот эта электронная пара взаимодействует с положительно заряженным ионом водорода и присоединяет его по донорно-акцепторному механизму:
 H
H


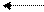 Н3С – N: + HOH [H3C – NH3] + + OH-
Н3С – N: + HOH [H3C – NH3] + + OH-
ион
H метиламмония
3. Физические свойства анилина. Анилин – бесцветная маслянистая ядовитая жидкость, малорастворимая в воде. Хорошими растворителями для него являются спирт, эфир и бензол. Анилин затвердевает при –60С и кипит при 1840С. Вследствие окисления на воздухе он быстро темнеет. Как и все амины, анилин токсичен.
Строение молекулы анилина можно изобразить несколькими способами:
С6Н5 – NH2
. .
В молекуле анилина, как и в молекулах других аминов, у атома азота имеется неподелённая пара, которая вовлечена в ароматическое сопряжение бензольного кольца. Там происходит перераспределение электронной плотности, в результате чего она возрастает в положениях 2,4 и 6.
4. Получение анилина в промышленности основано на реакции восстановления нитробензола, которую в 1842г. Открыл русский учёный Н.Н. Зинин. Нитробензол восстанавливают в присутствии чугунных стружек и соляной кислоты. Вначале выделяется атомарный водород, который и взаимодействует с нитробензолом:
Fe + 2HCl = FeCl2 + 2H
 C6H5 – NO2 + 6H C6H5 – NH2 +2H2O
C6H5 – NO2 + 6H C6H5 – NH2 +2H2O
Контрольные вопросы
1. Какие вещества называют аминами и каково строение их молекул?
2. На примере анилина объясните сущность взаимного влияния групп атомов
в молекуле.
3. При восстановлении 250 г нитробензола получили 150 г анилина.
Вычислите, сколько это составляет процентов по сравнению с
теоретическим выходом продукта реакции.
Лекция 8
Тема: Важнейшие классы органических соединений.
Основы номенклатуры.
План
1. Классификация органических соединений.
Так как органических соединений много, то необходимо их сгруппировать по определённым классам, т.е. классифицировать. При ознакомлении с простейшими представителями каждого класса соединений можно получить общее представление о соединениях всех классов. Основой классификации органических веществ, принято считать вещества, которые состоят только из углерода и водорода. Такие вещества называют углеводородами. Все остальные органические вещества – производные углеводородов. Их можно считать соответствующими продуктами замены одного или нескольких атомов водорода в молекуле углеводорода атомами группами атомов других элементов:
|



 ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
| ||||
| ||||
Химией углеводородов и их производных назвал органическую химию в 1871 г. К. Шорлеммер – немецкий химик-органик.
Любая классификация основана на определённых признаках. В основу современной классификации органических соединений положены два важнейших признака:
– строение углеродного скелета молекулы;
– наличие в молекуле функциональных групп.
Функциональная группа это атомы или группа атомов в молекуле вещества, определяющие его химические свойства.
К функциональным группам относят, например, гидроксогруппу (гидроксильную группу) – ОН, аминогруппу – NH2 и др. По функциональным группам определяют принадлежность данного соединения к тому или иному классу веществ.
Классификация углеводородов, в основу которой положено их химическое строение и ИВД химической связи, представлена на схеме 1. Если же за основу классификации взять наличие функциональных групп, то она будет выглядеть иначе(схема 2).
Дата: 2019-02-02, просмотров: 521.