План
1. Строение молекул.
2. Изомерия и номенклатура.
3. Физические свойства.
4. Получение.
5. Химические свойства.
6. Применение.
1. Строение молекул. Типичный представитель спиртов – этанол (этиловый спирт). Его простейшая формула С2Н6О. Этой молекулярной формуле соответствует две структурные формулы:
Н Н Н Н
│ │ │ │
Н – С – С – О – Н Н – С – О – С – Н
│ │ │ │
Н Н Н Н
а б
Возникает вопрос: какая же из них соответствует этиловому спирту? Рассмотрим формулу a. В молекуле вещества а один из водородных атомов связан с атомом кислорода. Эта ковалентная химическая связь более полярна, чем связь между атомами углерода и водорода.
Спиртами называют производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
Гидроксильная группа – ОН является функциональной группой спиртов. В этой группе более электроотрицательный кислород (имеющий к тому же непоселённую пару) оттягивает на себя общую электронную пару и приобретает частичный отрицательный заряд, а атом водорода – частичный положительный:
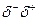
Н3С – О – Н
Благодаря подобному распределению зарядов молекулы спиртов притягиваются друг к другу – возникает так называемая водородная связь:

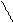 R – O R
R – O R
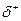
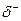
H… O – H
2. Изомерия и номенклатура. Из формулы метана можно вывести формулу только одного спирта – метанола:
Н Н
│ │
 Н – С – Н Н – С – ОН
Н – С – Н Н – С – ОН
│ │
Н Н
метан метанол (метиловый спирт)
Этану СН3–СН3 также соответствует один одноатомный спирт, формула которого СН3– СН2– ОН. Это этанол.
Из формулы пропана в зависимости от места гидроксильной группы в молекуле можно вывести формулы двух одноатомных спиртов:
Н Н Н Н Н Н
│ 3 │2 │1 │3 │ 2 │1
Н – С – С – С – ОН Н – С – С – С – Н
│ │ │ │ │ │
Н Н Н Н ОН Н
пропанол-1 пропанол-2
(первичный пропиловый спирт) (вторичный пропиловый спирт)
Первичным называют такой атом углерода, который связан только с одним атомом углерода. Вторичный атом углерода связан с двумя, а третичный – с тремя атомами углерода.
3. Физические свойства. Одноатомные предельные первичные спирты с короткой цепью углеродных атомов – жидкости, а высшие (начиная с С12Н25ОН) – твёрдые вещества.
С увеличением относительной молекулярной массы жидких спиртов повышаются их температуры кипения. Температуры кипения спиртов гораздо выше, чем у соответствующих углеводородов. Это можно объяснить существованием между молекулами спиртов водородных связей, на разрывание которых при нагревании спиртов тратится дополнительная энергия.
Водородная связь может возникнуть как между молекулами спиртов так и между молекулами спиртов и воды:

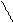 R – O Н
R – O Н
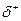
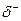
H… O – H
Это объясняет хорошую растворимость спиртов в воде. Метанол, этанол и пропанол в воде растворяется в неограниченных количествах. Растворимость других гомологов значительно меньше. Высшие спирты начиная с С11Н23ОН в воде практически нерастворимы.
Метанол, этанол и прропано-1 имеют специфический алкогольный запах, у следующих за ними гомологов сильный запах, у некоторых – неприятный. Высшие спирты запаха не имеют.
Все адноатомные спирты ядовиты! Самый ядовитый из них – метанол (метиловый спирт( СН3ОН). Уже небольшая его доза м ожжет вызвать слепоту или оказаться смертельной. В организме метанол превращается в муравьиную. Кислоту и её соли – формиаты, которые и оказывают токсическое действие на нервную систему. По запаху и вкусу метанол неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь.
4. Получение. Наибольшее промышленное значение имеют метанол и этанол. Метанол синтезирует главным образом из синтез- газа:
220– 2800С, 5– 20 МПа, Cu, Zn O
 CO + 2H2 CH3OH
CO + 2H2 CH3OH
Этанол в промышленности получают различными способами.
1. на современном производстве этанол получают гидратацией этилена при помощи водяного пара:

 Н Н 280 – 3000С, 7 – 8 МПа, Н3РО4
Н Н 280 – 3000С, 7 – 8 МПа, Н3РО4
 С = С + НОН СН3– СН2ОН
С = С + НОН СН3– СН2ОН
Н Н
2. Наиболее древний метод получения этанола – сбраживание сахаристых веществ, содержащих глюкозу. Сбраживание глюкозы осуществляют с помощью дрожжевых грибков, выделяющих биологические катализаторы – ферменты. Процесс спиртового брожения глюкозы виноградного сахара) в упрощённом виде можно изобразить так:
ферменты
 С6Н12О6 2С2Н5ОН + 2СО2↑
С6Н12О6 2С2Н5ОН + 2СО2↑
Этот процесс происходит при производстве вин.
5. Химические свойства.
1) Водные растворы спиртов на индикаторы не действуют.
2) Спирты, подобно воде, реагируют с активными металлами. Так, например, при взаимодействии натрия с этанолом образуется этилат натрия и выделяется водород:
2СН3–СН2–ОН+2Na  2CH3 – CH2 – O Na +H2
2CH3 – CH2 – O Na +H2 
этанол этилат натрия
Этилат натрия в воде подвергается гидролизу:
СН3–СН2– O Na +HOH  CH3– CH2– OH +NaOH
CH3– CH2– OH +NaOH
Равновесие этой реакции сильно смещено вправо.
3) В присутствии концентрированной серной кислоты спирты реагируют с галогеноводородными кислотами и образуются галогенопроизводные углеводородов:
H2SO4
 СН3–ОН+Н–Сl CH3Cl +H2O
СН3–ОН+Н–Сl CH3Cl +H2O
метанол хлорметан
4) В присутствии водоотнимающих веществ и при повышенной температуре происходит дегидратация спиртов (от их молекул оцепляется вода) и образуются непредельные углеводороды:
t>1400C, H2SO4 (конц.)
 H3C – CH2– OH Н2С = СН2
H3C – CH2– OH Н2С = СН2  +Н2О
+Н2О
При избытке спирта и более низкой температуре получаются простые эфиры:
t>1400C, H2SO4 (конц.)
 СН3– СН2–ОН +НО– СН2– СН3 СН3–СН2–О–СН2–СН3+НОН
СН3– СН2–ОН +НО– СН2– СН3 СН3–СН2–О–СН2–СН3+НОН
диэтиловый спирт
5) Одноатомные первичные спирты относительно легко окисляются. При этом образуются альдегиды. Если в этанол опустить накалённую медную спираль, покрытую чёрным оксидом меди (II), спираль становится блестящей, появляется специфический запах ацетальдегида:

 H H O
H H O
 t
t


 Н – С – С – О–Н+СuO CH3– C +Cu+H2O
Н – С – С – О–Н+СuO CH3– C +Cu+H2O
 H
H
H H ацетальдегид
6. Применение. Широкое применение находит этанол. В больших количествах его используют при производстве синтетических каучуков. Он является также растворителем и исходным материалом для производства лаков. Медикаментов и душистых веществ. Из него получают уксусную кислоту, диэтиловый спирт, различные сложные эфиры, красители и другие вещества. В медицине этанол применяют как дезинфицирующее средство.
Метанол широко применяют в промышленности в качестве растворителя лаков и красок, сырья для изготовления фармацевтических препаратов, химических веществ, органических красителей. Большие количества метанола используются для производства формальдегида, применяемого при изготовлении пластмасс, промышленности, сельском хозяйстве, медицине. Метиловый спирт обладает антидетонационными свойствами, применяется в качестве антифриза для охлаждения радиаторов двигателей.
Контрольные вопросы
1. Как на производстве получают этанол и метанол? Приведите уравнения соответствующих реакций.
2. Какое применение имеют метанол и этанол? Ответ оформите в виде схемы.
Лекция 21
Дата: 2019-02-02, просмотров: 333.