План.
1. Скорость химических реакций, её зависимость от различных факторов.
2. Обратимость химических реакций. Химическое равновесие.
3. Принцип Ле-Шателье.
1. Скорость химических реакций, её зависимость от различных факторов.
Скорость гомогенной реакции измеряется числом молей веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени в единице объема.
В математической форме это определение можно отразить так:
Vгомог = 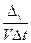
где Vгомог – скорость реакции в гомогенной системе; v – число молей одного из вступивших в реакцию или образующегося в результате реакции вещества; V – объем газа; t – время; 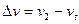 – изменение числа молей за время
– изменение числа молей за время 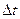 .
.
Так как отношение числа молей к объему представляет собой концентрацию с, то 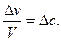 Следовательно, Vгомог = –
Следовательно, Vгомог = – 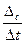
Скорость химической реакции выражает так : 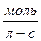
Учитывая это, скорость гомогенных реакций можно определить и так:
Скорость гомогенной реакции определяется изменением концентрации одного из вступивших в реакцию или образующихся в результате реакции веществ в единицу времени.
Руководствуясь этим определением скорости гомогенной реакции, следует учитывать, что по приведенным выше математическим формулам можно вычислить среднюю скорость только гомогенной реакции, так как ее скорость зависит от концентрации реагирующих веществ, которая с течением времени изменяется.
Если реакция протекает между веществами в гетерогенной системе, то реагирующие вещества соприкасаются между собой не по всему объему, а только на поверхности. Так, например, при горении угля молекулы кислорода реагируют только с теми атомами углерода, которые находятся на поверхности. Ри измельчении угля его поверхность возрастает и скорость горения увеличивается. В связи с этим определение скорости гетерогенной реакции следующее:
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности.
В математической форме это определение можно отразить так:
Vгомог = – 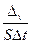
где S – площадь поверхности.
Факторы, влияющие на скорость гомогенных и гетерогенных реакций. Основные факторы, влияющие на скорость химических реакций:
1. Скорость химических реакций зависит от природы реагирующих веществ.
2. Для веществ в растворенном состоянии и газов скорость химических реакций зависит от их концентрации.
3. Для веществ в твердом состоянии скорость химических реакций прямо пропорциональна поверхности реагирующих веществ.
4. При повышении температуры скорость большинства химических реакций увеличивается.
5. Скорость химических реакций зависит от присутствия некоторых веществ. Вещества, которые ускоряют химические реакции, но сами в итоге не расходуются, называются катализаторами, а вещества, которые замедляют скорость химических реакций – ингибиторами.
2. Обратимость химических реакций. Химическое равновесие.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером необратимой реакции может служить разложение бертолетовой соли при нагревании:
2KClO3 = 2KCl + 3O2
Реакция прекратится тогда, когда вся бертолетова соль превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставятся две стрелки, направленные в противоположные стороны. Примером обратимой реакции может служить получение иодоводорода из водорода и иода:

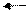 ½ Н2 + ½ I2 HI,
½ Н2 + ½ I2 HI, 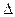 H0 = 25,9 кДж/моль
H0 = 25,9 кДж/моль
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Так, в реакции получения иодоводорода равновесие наступает тогда, когда в единицу времени будет образовываться столько же молекул HI, сколько их будет распадаться на молекулы H2 и I2. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления ( в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле-Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствуют протеканию той из двух противоположных реакций, которая ослабляет воздействие. Поясним это на примере той же реакции синтеза иодоводорода.
Если внешнее воздействие выразится в увеличении концентрации водорода или иода, то оно смещает равновесие в сторону образования продукта реакции HI смещает равновесие в сторону исходных веществ.
Контрольные вопросы
1. Почему реакции сопровождаются: а) выделением энергии; б) поглощением
энергии? Приведите примеры таких реакций.
2. Приведите примеры гомогенных и гетерогенных каталитических реакций.
3. Почему пищевые продукты хранятся при низких температурах?
Лекция 7
Дата: 2019-02-02, просмотров: 344.