При сжигании 10 г органического вещества получается 27, 5 г углекислого газа и 22,5 г воды. Относительная плотность пара вещества по кислороду равна 0,5. Вывести формулу вещества.
Обозначаем органическое вещество формулой СхНуОz, поскольку, если образовались СО2 и вода, то в составе вещества могут быть Карбон, Гидроген и Оксиген.
Дано:

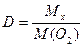 М (СО2) = 44 г/моль
М (СО2) = 44 г/моль
 ) = 27,5г
) = 27,5г 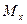 =
= 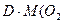 ) М (Н2О) = 18 г/моль
) М (Н2О) = 18 г/моль
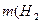 О) = 22,4г М (О2) = 32 г/моль
О) = 22,4г М (О2) = 32 г/моль
D (O2) = 0,5
Решение
1) Находим молярную массу органического вещества:
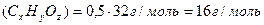
2) Записываем уравнение реакции в общем виде и расставляем коэффициенты.
 10 г 27,5г
10 г 27,5г
2CxHyOz + O2 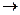 2xCO2 + yH2O
2xCO2 + yH2O
2x16г/моль 2х х44г/моль
3) Записываем данные условия задачи и данные уравнения. Вычисляем количество Карбона, составив пропорцию:
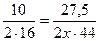 ;
; 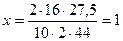 (С)
(С)
4) По данному уравнению находим количество Гидрогена:
10 г 22,5г
2CxHyOz + O2 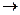 2xCO2 + yH2O
2xCO2 + yH2O
2x16г/моль у х18г/моль
5) Составляем пропорцию, вычисляем количество Гидрогена:

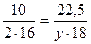 ;
; 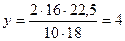 (Н)
(Н)
Итак, в соединении Оксигена нет. Это углеводород. В молекуле углеводорода на один атом Карбона приходится четыре атома Гидрогена.
Формула углеводорода СН4 (метан), относительная молекулярная масса 16.
Ответ: формула углеводорода СН4.
3.Нахождение молекулярной формулы соединения по уравнению химической реакции.
Этиленовый углеводород массой 4,2г присоединяет 16 г брома. Найти молекулярную формулу соединения, составить структурную формулу. Общая формула этиленовых углеводородов CnH2n
Дано: М (Br2) =160 г/моль
m(CnH2n) = 4,2г Ar (C) = 12
m (Br2) = 16г
Формула – ?
Решение
1) Составляем уравнение реакции в общем виде и записываем данные условия задачи и данные уравнения.
4,2 г 16г
CnH2n + Br2 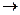 CnH2nBr2
CnH2nBr2
160г/моль
Х m=160г
2) Составляем пропорцию и находим молярную массу углеводорода:
 ;
; 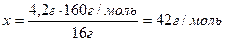
M (CnH2n) = 42 г/моль
3) Находим количество атомов Карбона и Гидрогена в молекуле углеводорода.
CnH2n= 42
12n + 2n= 42; 14n=42; n = 42: 14; n = 3
Итак, в молекуле этиленового углеводорода на три Карбона приходится шесть атомов Гидрогена. Формула углеводорода С3Н6. Это ненасыщенный углеводород – пропилен.
Контрольные вопросы
1. Как вывести молекулярную формулу органического соединения? Выведение молекулярной формулы органического соединения
Лекция 4
Тема: Электролиз водных растворов. Дисперсные системы.
План.
1. Электролиз.
2. Дисперсные системы.
Электролиз.
Ионы в растворах могут вступать также и в реакции, сопровождающиеся изменением валентности, – реакции окисления-восстановления. Например, если внести железную пластинку в раствор хлорной меди СиСl2, то через несколько минут пластинка покроется красным налетом меди. Нейтральные атомы меди могут образоваться из ионов Си2+, только получив по два электрона от какого-то их источника. В данному случае источником электронов оказались атомы железа, которые, отдавая меди свои электролиты, сами превращаются в положительно заряженные ионы.
Эту окислительно-восстановительную реакцию можно записать в виде молекулярного уравнения:
CuCl2 + Fe= FeCl2+ Cu,
Или в виде ионного уравнения:
Cu2+ + Fe0 = Fe2+ + Cu0.
В качестве поставщика электронов вместо атомов железа можно использовать отрицательный полюс аккумулятора или какого-либо другого источника постоянного тока. При работе аккумулятора на отрицательном полюсе создается избыток электронов, а на положительном – недостаток их. При замыкании полюсов металлическим проводником возникает электрический ток за счет перемещения избытка электронов к положительному полюсу. Если между полюсами поместить раствор электролита, то и тогда ток будет проходить. Но в электролитах ток проходит не за счет передвижения электронов, а за счет движения ионов и протекания окислительно0восстановительной реакции на электродах. При опускании электродов в раствор электролита положительно заряженные ионы движутся в сторону отрицательного электрода, а отрицательно заряженные ионы – в сторону положительного электрода.
Ион меди Cu2+ из раствора CuCl2, приближаясь к отрицательно заряженному электроду, получает недостающие ему два электрона и превращается в нейтральный атом:
Cu2+ + 2е- = Сu.
К положительному электроду двигаются отрицательно заряженные ионы хлора Cl-. Отдавая свои электроны, они окисляются до свободных атомов хлора:
2Cl- –2е- = 2Cl, которые соединяясь попарно, образуют молекулы хлора:
Cl + Cl = Cl2
Под действие электрического тока происходит химическая реакция окисления хлора и восстановления меди.
Химический процесс, протекающий при прохождении электрического тока через раствор или расплав электролита, называется электролизом и происходит в результате реакции окисления-восстановления.
Электрод, соединенный с отрицательным полюсом источника тока, называется катодом, а электрод, соединенный с положительным полюсом – анодом. Положительно заряженные ионы, направляющиеся к катоду, называется катионами, а отрицательные ионы – анионами.
2. Дисперсные системы.
При смешивании веществ с водой образуются и однородные системы (характерное свойство растворов), и неоднородные, т.е. суспензии и эмульсии. При растворении вещества измельчаются – дробятся. Поэтому истинные растворы, а также суспензии и эмульсии относят к дисперсным системам (диспергирование означает раздробление). Дисперсных систем известно много. Они различаются между собой в зависимости от того, какие частицы (твердые, жидкие, газообразные) и в какой среде (жидкой, газообразной)распределены. Так, например одной из таких дисперсных систем является дымили пыль в воздухе: воздух – смесь газов, а частицы – мелкораздробленные твердые вещества. Туман – это дисперсная система, где среда – воздух, диспергированные частицы – мелкие капли жидкости. Обе дисперсные системы относятся к типу аэрозолей.
Наибольшее значение в практике имеют дисперсные систем, в которых средой является вода и другие жидкости. Эти системы в зависимости от размеров частиц подразделяются на истинные растворы, или просто растворы, коллоидные растворы и грубодисперсные системы, или суспензии и эмульсии. Следовательно, истинные растворы тоже относятся к дисперсным системам, но в них диспергированные частицы исключительно малы. Именно поэтому истинные растворы называют однородными системами, ибо их неоднородность нельзя обнаружить даже с помощью ультрамикроскопа. В истинных растворах диспергированными частицами являются отдельные молекулы ионы или их гидраты. Размеры этих частиц меньше 1нм (10-9м).
| Виды дисперсных систем и размеры частиц, нм | Примеры | Внешний вид дисперсных систем и видимость частиц | Способность осаждаться | Способность Задерживаться фильтрами |
| 1.Грубодисперсные системы: а) суспензии (больше 100нм) б) эмульсии (больше 100нм) | Смесь глины с водой Смесь растительного масла или бензин с водой | Мутные. Частицы видны невооруженным глазом. Мутные. Отдельные капельки видны невооруженным глазом. | Осаждаются легко, иногда в течение нескольких минут. | Задерживаются обычными фильтрами, например фильтровальной бумагой. |
| 2.Тонкодисперс-ные системы: а)коллоидные растворы (1– 100нм) б) истинные растворы (меньше 1 нм) | Раствор яичного белка в воде Раствор сахара или поваренной соли в воде | Прозрачные. Отдельные частицы обнаруживаются только при помощи ультрамикроскопа Прозрачные. Отдельные частицы нельзя обнаружить даже при помощи ультрамикроскопа. | Осаждаются с трудом. Не осаждаются. | Задерживаются только ультрафильтрами с очень маленькими порами (пергаментная бумага, животный пузырь). Фильтрами не задерживаются. |
Контрольные вопросы
1. В чем особенности протекания электролиза?
2. Объяснить классификацию дисперсных систем.
Лекция 5
Дата: 2019-02-02, просмотров: 419.