| Класс | Составляющие названия | Примеры |
| Оксиды | название химического элемента в именительном падеже + оксид | CaO – кальций оксид NO2 – нитроген (IV) оксид |
| Основания | название металлического элемента + гидроксид | Ca(OH)2-кальций гидрок-сид Cu(OH)2 купрум(II) – гидроксид |
| Кислоты | название аниона с добавлением окончания –ная + кислота | HCl – хлоридная кислота HNO3 –нитратная кислота |
| Соли | название металлического элемента + название кислотного остатка | CaCl2 – кальций хлорид Cu(NO3)2-купрум(II) нитрат |
Контрольные вопросы
1. Укажите, к какому классу соединений принадлежат вещества, формулы которых: NiO, As2O3, Cu2O, PbO, CO, Mn2O7, V2O5.
Классифицируйте вещества в пределах класса, назовите соединения.
2. Формулы веществ какого класса преобладают в приведенном перечне:
CO2, HMnO4, ZnCO3, BaO, Mn(OH)2 Fe (OH)3, HNO3, K3PO4, P2O5, KCl,
MgSO4?
Назовите вещества согласно современной научной номенклатуре.
3. Напишите уравнения реакций согласно схеме превращений:
алюминий 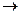 алюминий оксид
алюминий оксид 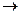 алюминий нитрат
алюминий нитрат 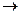 алюминий гидрокисд
алюминий гидрокисд 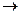 алюминий оксид.
алюминий оксид.
Лекция 2
Тема: Химическая связь. Молекулы. Пространственная структура молекул. Простые и кратные связи, 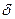 -и
-и  – связи.
– связи.
Основные характеристики ковалентной связи.
План
1. Виды химической связи.
2. Ионная связь
1. Виды химической связи. Основой теории химической связи является положение о том, что образование химических связей сопровождается достижением атомами завершённого строения внешнего энергетического уровня.
Внешний энергетический уровень считается завершённым, если он содержит 8 электронов (для Гидрогена и Гелия – 2). При образовании химических связей ядра атомов не изменяются изменения происходят в электронных оболочках. Химической связью называют взаимодействие между атомами, которое обусловливает образование молекул и кристаллов. Известны: ковалентная, ионная и водородная связь.
Имеющийся у атома Гидрогена 1 электрон составляет половину от количества завершённого для него (двухэлектронного) внешнего энергетического уровня. У атома Оксигена на внешнем энергетическом уровне 6 электронов, то есть он близок к завершённому для него восьмиэлектронному составу. Имея половину и более половины электронов, чем их есть на завершённом уровне, атомам этих элементов энергетически выгоднее не отдавать электроны, а присоединять или образовывать общие электронные пары. Например, в молекуле водорода два атома Гидрогена достигают завершённости внешнего энергетического уровня путём образования одной обще электронной пары, в молекуле кислорода – двух.
У обеих молекул общие электронные пары равноудалены от ядер атомов между которыми образовалась химическая связь.
В молекуле воды атомы также соединены общими электронными парами, смещёнными ближе к атому Оксигена.
Смещение электронных пар произошло потому, что Оксиген по сравнению с Гидрогеном имеет большую электроотрицательность – условную величину, которая характеризует способность атома в соединении притягивать к себе электроны.
Неметаллические элементы характеризуются большей по сравнению с металлическими элементами электроотрицательностью, поэтому между атомами неметаллических элементов химическая связь образуется за счёт общих электронных пар, а не путем отдачи или присоединения электронов. Химическую связь с помощью общих электронных пар называют ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, она – неполярная, а если смещены в сторону более электроотрицательного атома – полярная.
2. Ионная связь. Натрий хлорид, в отличие от водорода, кислорода и воды, является веществом немолекулярного строения. Поэтому образование химической связи происходит по-другому. Атом Натрия отдаёт единственный электрон внешнего энергетического уровня и превращается в катион, в котором внешний энергетический уровень завершён (им становится предпоследний энергетический уровень атома Натрия). Поэтому Хлору энергетически выгодно присоединить этот электрон на внешний энергетический уровень и завершить его. При этом нейтральные атомы Натрия и Хлора превращаются в заряженные частицы – ионы. Связь, образующаяся в веществах путём притягивания разноимённо заряженных ионов называется ионной связью.
Электронейтральные атомы всех металлических элементов способны к отдаче, а не к присоединению электронов.
Контрольные вопросы
1. Напишите электронную и графическую электронную формулы атомов химических элементов Нитрогена и Фосфора. Что общего в строении электронных оболочек атомов этих элементов?
2. Напишите электронную и графическую электронную формулы атомов химических элементов Магния и Сульфура. Что общего в строении электронных оболочек их атомов?
Лекция 3
Дата: 2019-02-02, просмотров: 370.