Лекция 1
Тема: Важнейшие классы неорганических и органических веществ.
Атомно-молекулярное учение.
План
1. Оксиды.
2. Основания.
3. Соли.
4. Номенклатура неорганических соединений.
Среди неорганических соединений преобладают представители именно этих классов. Хотя, кроме них, вам известны амфотерные гидроксиды (алюминий гидроксид, цинк гидроксид и др.), пероксиды (гидроген пероксид и др.).
Вещества, формулы которых относятся к одному классу, подобны по составу, но отличаются физическими и химическими свойствами. Это даёт основание для классификации их в отдельные группы. Например, в зависимости от агрегатного состояния (физическая характеристика) оксиды делятся на твёрдые (например, фосфор (V) оксид), жидкие (например, вода), газообразные (например карбонат (IV) оксид.
Растворимые основания образуют мылкие растворы, вследствие чего эти вещества получили название щелочи. Это: литий гидроксид, натрий гидроксид, калий гидроксид, кальций гидроксид, барий гидроксид и некоторые другие. Их гораздо меньше, чем нерастворимых оснований.
1. Оксиды – это бинарные соединения элемента с Оксигеном, в которых он проявляет степень окисления. Они бывают солеобразующие и несолеобразующие. Солеобразующие оксиды в зависимости от их химических свойств разделяют на основные, кислотные и амфотерные.
Основные – это оксиды, взаимодействующие с кислотами, с образованием соли и воды.
К ним относятся оксиды металлических элементов со степенью окисления +1, +2, реже +3. Гидратами оксидов (гидратами формами), которые соответствуют основным оксидам, являются основания.
Например: Na2O – NaOH, CuO – Cu(OH)2,
Cu2O – CuOH, FeO – Fe(OH)2
Кислотные оксиды – это оксиды, взаимодействующие со щёлочами, с образованием соли и воды.
К ним относятся все солеобразующие оксиды неметаллических элементов и оксиды некоторых металлических элементов с высокими степенями окисления
( +5, +6, + 7). Гидратами оксидов (гидратными формами), которые соответствуют кислотным оксидам, являются кислоты.
Например: SiO2 – H2SiO3, P2O5 – H3PO4, Mn2O7 – HMnO4
Что касается кислотных оксидов и соответствующих им гидратов оксидов (оксигеносодержащих кислот), то для них также характерна закономерность, обнаруженная у оснований: атомы кислотнообразующих элементов в кислотном оксиде и соответствующей ему кислоте имеют одинаковую степень окисления.
Амфотерные оксиды – это те, что образуют соль и воду как с кислотой, так и со щёлочью.
К ним принадлежит небольшое количество оксидов металлических элементов: BeO, Al2O3, ZnO, PbO, Cr2O3 и некоторые другие. Гидратами оксидов (гидратными формами) которые соответствуют амфотерным оксидам, являются амфотерные гидроксиды.
Например: BeO – Be(OH)2, Al2O3 – Al (OH)3
Кислоты – это электролиты, которые в водном растворе диссоциируют на катионы Гидрогена и анионы кислотного остатка.
Например: HCl 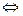 H+ + Cl H2SO4
H+ + Cl H2SO4 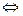 2H+ + SO2-4
2H+ + SO2-4
В растворах кислот имеются катионы Гидрогена, которые обусловливают общие свойства кислот. Так, кислоты взаимодействуют: 1) индикаторами; 2) металлами (расположенными в ряде активности до водорода); 3) основными и амфотерными оксидами; 4) основаниями и амфотерными гидроксидами; 5) солями других кислот, если один из продуктов реакции выпадает в осадок или выделяется в газообразном состоянии.
2. Основания – это электролиты, которые диссоциируют с образованием катионов металлического элемента и гидроксид-анионов.
Например: KOH = K+ + OH-
Наличие гидроксид -ионов обусловливает общие свойства щёлочей:
1) действие на индикаторы; 2) взаимодействие с кислотными и амфотерными оксидами; 3) взаимодействие с кислотами (реакция нейтрализации); 4) взаимодействие с амфотерными гидроксидами; 5) взаимодействие с солями, если один из продуктов реакции выпадает в осадок или выделится в газообразном состоянии.
3. Соли – это электролиты, которые диссоциируют с образованием катионов металлического элемента и анионов кислотного остатка. Например:
K2CO3= 2K+ + CO32-
Соли взаимодействуют с: 1) металлами, более активными, чем металл, ионы которого входят в состав соли (в растворе); 2) щёлочами (в растворе при условии образования осадка); 3) другой солью ( в растворе при условии образования осадка); 4) кислотами, являющимися более сильными электролитами, чем кислота, с солью которой проводят реакцию (при условии образования осадка или выделения газа); 5) разложение солей некоторых кислот (например, карбонатов, нитратов) при нагревании.
4. Номенклатура неорганических соединений. Кроме правильной записи химических формул и уравнений химических реакций, не менее важно правильно называть вещества. При повторении нужно помнить, что для оксидов, оснований и солей существует общее правило номенклатуры.
Лекция 2
Тема: Химическая связь. Молекулы. Пространственная структура молекул. Простые и кратные связи, 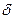 -и
-и  – связи.
– связи.
План
1. Виды химической связи.
2. Ионная связь
1. Виды химической связи. Основой теории химической связи является положение о том, что образование химических связей сопровождается достижением атомами завершённого строения внешнего энергетического уровня.
Внешний энергетический уровень считается завершённым, если он содержит 8 электронов (для Гидрогена и Гелия – 2). При образовании химических связей ядра атомов не изменяются изменения происходят в электронных оболочках. Химической связью называют взаимодействие между атомами, которое обусловливает образование молекул и кристаллов. Известны: ковалентная, ионная и водородная связь.
Имеющийся у атома Гидрогена 1 электрон составляет половину от количества завершённого для него (двухэлектронного) внешнего энергетического уровня. У атома Оксигена на внешнем энергетическом уровне 6 электронов, то есть он близок к завершённому для него восьмиэлектронному составу. Имея половину и более половины электронов, чем их есть на завершённом уровне, атомам этих элементов энергетически выгоднее не отдавать электроны, а присоединять или образовывать общие электронные пары. Например, в молекуле водорода два атома Гидрогена достигают завершённости внешнего энергетического уровня путём образования одной обще электронной пары, в молекуле кислорода – двух.
У обеих молекул общие электронные пары равноудалены от ядер атомов между которыми образовалась химическая связь.
В молекуле воды атомы также соединены общими электронными парами, смещёнными ближе к атому Оксигена.
Смещение электронных пар произошло потому, что Оксиген по сравнению с Гидрогеном имеет большую электроотрицательность – условную величину, которая характеризует способность атома в соединении притягивать к себе электроны.
Неметаллические элементы характеризуются большей по сравнению с металлическими элементами электроотрицательностью, поэтому между атомами неметаллических элементов химическая связь образуется за счёт общих электронных пар, а не путем отдачи или присоединения электронов. Химическую связь с помощью общих электронных пар называют ковалентной. Если общие электронные пары равноудалены от ядер обоих атомов, она – неполярная, а если смещены в сторону более электроотрицательного атома – полярная.
2. Ионная связь. Натрий хлорид, в отличие от водорода, кислорода и воды, является веществом немолекулярного строения. Поэтому образование химической связи происходит по-другому. Атом Натрия отдаёт единственный электрон внешнего энергетического уровня и превращается в катион, в котором внешний энергетический уровень завершён (им становится предпоследний энергетический уровень атома Натрия). Поэтому Хлору энергетически выгодно присоединить этот электрон на внешний энергетический уровень и завершить его. При этом нейтральные атомы Натрия и Хлора превращаются в заряженные частицы – ионы. Связь, образующаяся в веществах путём притягивания разноимённо заряженных ионов называется ионной связью.
Электронейтральные атомы всех металлических элементов способны к отдаче, а не к присоединению электронов.
Контрольные вопросы
1. Напишите электронную и графическую электронную формулы атомов химических элементов Нитрогена и Фосфора. Что общего в строении электронных оболочек атомов этих элементов?
2. Напишите электронную и графическую электронную формулы атомов химических элементов Магния и Сульфура. Что общего в строении электронных оболочек их атомов?
Лекция 3
План
1. Выведение молекулярной формулы органического соединения
(по массовой доле, относительной плотности, по водороду и воздуху).
2. Нахождение молекулярной формулы органического соединения по массе,
объему и количеству вещества – продуктов сгорания.
3. Нахождение молекулярной формулы соединения по уравнению
химической реакции.
Способ.
1) Определяем относительную молекулярную массу углеводорода по формуле: Mr = 2 х 42 = 84
2. Определяем количество атомов Карбона и Гидрогена (по формуле):
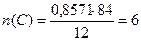
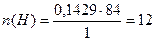
Итак, в молекуле углеводорода на 6 атомов Карбона приходится 12 атомов Гидрогена. Формула углеводорода С6Н12, относительная молекулярная масса 84.
Ответ: формула углеводорода С6Н12 (гексан).
Лекция 4
План.
1. Электролиз.
2. Дисперсные системы.
Электролиз.
Ионы в растворах могут вступать также и в реакции, сопровождающиеся изменением валентности, – реакции окисления-восстановления. Например, если внести железную пластинку в раствор хлорной меди СиСl2, то через несколько минут пластинка покроется красным налетом меди. Нейтральные атомы меди могут образоваться из ионов Си2+, только получив по два электрона от какого-то их источника. В данному случае источником электронов оказались атомы железа, которые, отдавая меди свои электролиты, сами превращаются в положительно заряженные ионы.
Эту окислительно-восстановительную реакцию можно записать в виде молекулярного уравнения:
CuCl2 + Fe= FeCl2+ Cu,
Или в виде ионного уравнения:
Cu2+ + Fe0 = Fe2+ + Cu0.
В качестве поставщика электронов вместо атомов железа можно использовать отрицательный полюс аккумулятора или какого-либо другого источника постоянного тока. При работе аккумулятора на отрицательном полюсе создается избыток электронов, а на положительном – недостаток их. При замыкании полюсов металлическим проводником возникает электрический ток за счет перемещения избытка электронов к положительному полюсу. Если между полюсами поместить раствор электролита, то и тогда ток будет проходить. Но в электролитах ток проходит не за счет передвижения электронов, а за счет движения ионов и протекания окислительно0восстановительной реакции на электродах. При опускании электродов в раствор электролита положительно заряженные ионы движутся в сторону отрицательного электрода, а отрицательно заряженные ионы – в сторону положительного электрода.
Ион меди Cu2+ из раствора CuCl2, приближаясь к отрицательно заряженному электроду, получает недостающие ему два электрона и превращается в нейтральный атом:
Cu2+ + 2е- = Сu.
К положительному электроду двигаются отрицательно заряженные ионы хлора Cl-. Отдавая свои электроны, они окисляются до свободных атомов хлора:
2Cl- –2е- = 2Cl, которые соединяясь попарно, образуют молекулы хлора:
Cl + Cl = Cl2
Под действие электрического тока происходит химическая реакция окисления хлора и восстановления меди.
Химический процесс, протекающий при прохождении электрического тока через раствор или расплав электролита, называется электролизом и происходит в результате реакции окисления-восстановления.
Электрод, соединенный с отрицательным полюсом источника тока, называется катодом, а электрод, соединенный с положительным полюсом – анодом. Положительно заряженные ионы, направляющиеся к катоду, называется катионами, а отрицательные ионы – анионами.
2. Дисперсные системы.
При смешивании веществ с водой образуются и однородные системы (характерное свойство растворов), и неоднородные, т.е. суспензии и эмульсии. При растворении вещества измельчаются – дробятся. Поэтому истинные растворы, а также суспензии и эмульсии относят к дисперсным системам (диспергирование означает раздробление). Дисперсных систем известно много. Они различаются между собой в зависимости от того, какие частицы (твердые, жидкие, газообразные) и в какой среде (жидкой, газообразной)распределены. Так, например одной из таких дисперсных систем является дымили пыль в воздухе: воздух – смесь газов, а частицы – мелкораздробленные твердые вещества. Туман – это дисперсная система, где среда – воздух, диспергированные частицы – мелкие капли жидкости. Обе дисперсные системы относятся к типу аэрозолей.
Наибольшее значение в практике имеют дисперсные систем, в которых средой является вода и другие жидкости. Эти системы в зависимости от размеров частиц подразделяются на истинные растворы, или просто растворы, коллоидные растворы и грубодисперсные системы, или суспензии и эмульсии. Следовательно, истинные растворы тоже относятся к дисперсным системам, но в них диспергированные частицы исключительно малы. Именно поэтому истинные растворы называют однородными системами, ибо их неоднородность нельзя обнаружить даже с помощью ультрамикроскопа. В истинных растворах диспергированными частицами являются отдельные молекулы ионы или их гидраты. Размеры этих частиц меньше 1нм (10-9м).
| Виды дисперсных систем и размеры частиц, нм | Примеры | Внешний вид дисперсных систем и видимость частиц | Способность осаждаться | Способность Задерживаться фильтрами |
| 1.Грубодисперсные системы: а) суспензии (больше 100нм) б) эмульсии (больше 100нм) | Смесь глины с водой Смесь растительного масла или бензин с водой | Мутные. Частицы видны невооруженным глазом. Мутные. Отдельные капельки видны невооруженным глазом. | Осаждаются легко, иногда в течение нескольких минут. | Задерживаются обычными фильтрами, например фильтровальной бумагой. |
| 2.Тонкодисперс-ные системы: а)коллоидные растворы (1– 100нм) б) истинные растворы (меньше 1 нм) | Раствор яичного белка в воде Раствор сахара или поваренной соли в воде | Прозрачные. Отдельные частицы обнаруживаются только при помощи ультрамикроскопа Прозрачные. Отдельные частицы нельзя обнаружить даже при помощи ультрамикроскопа. | Осаждаются с трудом. Не осаждаются. | Задерживаются только ультрафильтрами с очень маленькими порами (пергаментная бумага, животный пузырь). Фильтрами не задерживаются. |
Контрольные вопросы
1. В чем особенности протекания электролиза?
2. Объяснить классификацию дисперсных систем.
Лекция 5
План.
1. Электролиты и неэлектролиты.
2. Теория электролитической диссоциации.
3. Диссоциация кислот, оснований и солей в водных растворах.
1. Электролиты и неэлектролиты. Не все вещества одинаково хорошо проводят электрический ток. Самыми лучшими проводниками являются металлы. Соли, окислы и другие химические соединения в твердом виде чаще всего являются непроводниками. Чистые жидкости в обычных условиях также крайне плохо проводят ток. Но растворы многих твердых веществ в жидкостях отличаются значительной проводимостью.
Чистые соли и щелочи, а также многие окислы металлов в расплавленном состоянии также обладают электропроводимостью.
Вещества, которые в растворенном или расплавленном состоянии проводят электрический ток, называются электролитами.
К электролитам относятся соли, кислоты, основания и окислы некоторых металлов.
Если опустим электроды нашего прибора в водный раствор сахара или глицерина, то увидим, что лампочка не загорится. Следовательно, растворы этих веществ электрический ток не проводят.
Вещества, которые в растворенном или расплавленном состоянии не проводят электрический ток, называются неэлектролитами.
Неэлектролиты являются сахар, глицерин и многие другие вещества.
2. Теория электролитической диссоциации. Механизм электропроводности металлов отличается от механизма электропроводности растворов электролитов. При пропускании тока через металлический провод никаких изменений с ним не происходит, а при прохождении электрического тока через раствор происходит превращение растворенного вещества. Если опустить в раствор хлорной меди СиСl2 угольные электроды, присоединенные к полюсам аккумулятора, и через раствор пропустить постоянный ток, то у электрода, соединенного с положительным полюсом аккумулятора, выделяются пузырьки удушливого газа – хлора, а электрод, соединенный с отрицательным полюсом, покрывается слоем меди. Следовательно, хлорная медь при прохождении через ее раствор тока разлагается на медь т хлор.
Электрический ток представляет собой поток заряженных частиц, В металлических проводах заряженными частицами могут быть либо положительно заряженные ионы, включающие в себя ядра атомов, либо отрицательно заряженные электроны, которые легко отрываются от атомов металла. Так как при прохождении тока переноса атомов металла не происходит, то электропроводность металлов осуществляется движущимися электронами. Атомы, несущие электрический заряд, называются ионами. Следовательно, электролит в растворе распадается на ионы. Хлорная медь, в частности, распадается на ионы меди и хлора:
CuCl2  Cu2 + 2 Cl-
Cu2 + 2 Cl-
Молекулы электролита распадаются на ионы не под действием электрического тока, а в момент растворения.
Ионы могут быть простые, состоящие из одного атома (например, Ag+, Cu2+ и т.д.), и сложные, состоящие из нескольких атомов (например, NO-3, SO2-4 и др.).
Распад электролита на ионы при растворении его в воде называются электролитической диссоциацией.
Теория электролитической диссоциации, объясняющая особенности водных растворов распадом их на ионы, была предложена шведским ученым Сванте Аррениусом в 1887г. С тех пор она развивалась многими учеными на основе новых представлений о строении атомов и молекул. Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием «степень диссоциации».
Степенью электролитической диссоциации называется отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
3. Диссоциация кислот, оснований и солей в водных растворах. Молекулы кислот, оснований и солей распадаются в растворе на противоположно заряженные частицы по месту ионной или сильнополярной связи. Такая связь существует между металлом и неметаллом, а также между водородом и неметаллом. При электролитической диссоциации эта связь частично разрушается растворителем.
Кислоты в водном растворе диссоциируют на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотных остатков. Например:

 HCl H + + Cl-
HCl H + + Cl-

 HNO3 H + + NO-3
HNO3 H + + NO-3

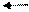 CH3COOH H+ + CH3COO-
CH3COOH H+ + CH3COO-
Следовательно, кислоты с точки зрения электролитической диссоциации – это электролиты, которые в водных растворах диссоциируют на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка.
Молекулы основания в водном растворе распадаются на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила. Например:
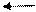
 NaOH Na+ + OH-
NaOH Na+ + OH-

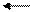 KOH K+ + OH-,
KOH K+ + OH-,
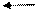
 Ca(OH)2 Ca2+ + 2OH-
Ca(OH)2 Ca2+ + 2OH-
Следовательно, основания – это электролиты, которые в водных растворах диссоциируют на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила.
Средние соли диссоциируют в воде на положительно заряженные ионы металла и на отрицательно заряженные ионы кислотных остатков. Например:

 KCl K+ + Cl
KCl K+ + Cl

 Na2CO3 2Na+ + CO2-3
Na2CO3 2Na+ + CO2-3

 Al2(SO4)3 2 Al3+ + 3SO2-4
Al2(SO4)3 2 Al3+ + 3SO2-4
При диссоциации кислых солей в водных растворах образуются также ионы водорода:

 NaHCO3 Na+ + HCO-3
NaHCO3 Na+ + HCO-3
 HCO-3 H+ + CO2-3
HCO-3 H+ + CO2-3
При диссоциации основных солей – ионы ОН-
 Sn (OH) Cl [Sn (OH]+ Cl-
Sn (OH) Cl [Sn (OH]+ Cl-
Сильными электролитами называются такие электролиты, у которых даже в сравнительно концентрированных растворах степень электролитической диссоциации велика (от 30 до 100%).
К сильным электролитам относятся почти все соли, а также азотная, хлорная, серная и другие кислоты, гидроокиси калия, натрия, кальция и т.п.
Слабыми электролитами называются электролиты, степень диссоциации которых также в разбавленных растворах мала.
Слабыми электролитами являются угольная кислота Н2СО3, уксусная кислота СН3СООН, сероводородная кислота H2S, гидроокись алюминия Al (OH)3, гидроокись железа Fe (OH)3 и др.
Растворы слабых электролитов плохо проводят электрический ток.
Контрольные вопросы
1. Какие вещества называют электролитами и неэлектролитами?
2. Какие вещества относят к слабым электролитам?
3. Как протекает диссоциация кислот, оснований и щелочей?
Лекция 6
План.
1. Скорость химических реакций, её зависимость от различных факторов.
2. Обратимость химических реакций. Химическое равновесие.
3. Принцип Ле-Шателье.
1. Скорость химических реакций, её зависимость от различных факторов.
Скорость гомогенной реакции измеряется числом молей веществ, вступивших в реакцию или образовавшихся в результате реакции за единицу времени в единице объема.
В математической форме это определение можно отразить так:
Vгомог = 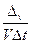
где Vгомог – скорость реакции в гомогенной системе; v – число молей одного из вступивших в реакцию или образующегося в результате реакции вещества; V – объем газа; t – время; 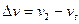 – изменение числа молей за время
– изменение числа молей за время 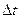 .
.
Так как отношение числа молей к объему представляет собой концентрацию с, то 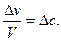 Следовательно, Vгомог = –
Следовательно, Vгомог = – 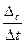
Скорость химической реакции выражает так : 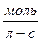
Учитывая это, скорость гомогенных реакций можно определить и так:
Скорость гомогенной реакции определяется изменением концентрации одного из вступивших в реакцию или образующихся в результате реакции веществ в единицу времени.
Руководствуясь этим определением скорости гомогенной реакции, следует учитывать, что по приведенным выше математическим формулам можно вычислить среднюю скорость только гомогенной реакции, так как ее скорость зависит от концентрации реагирующих веществ, которая с течением времени изменяется.
Если реакция протекает между веществами в гетерогенной системе, то реагирующие вещества соприкасаются между собой не по всему объему, а только на поверхности. Так, например, при горении угля молекулы кислорода реагируют только с теми атомами углерода, которые находятся на поверхности. Ри измельчении угля его поверхность возрастает и скорость горения увеличивается. В связи с этим определение скорости гетерогенной реакции следующее:
Скорость гетерогенной реакции определяется числом молей веществ, вступивших в реакцию или образующихся в результате реакции в единицу времени на единице поверхности.
В математической форме это определение можно отразить так:
Vгомог = – 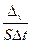
где S – площадь поверхности.
Факторы, влияющие на скорость гомогенных и гетерогенных реакций. Основные факторы, влияющие на скорость химических реакций:
1. Скорость химических реакций зависит от природы реагирующих веществ.
2. Для веществ в растворенном состоянии и газов скорость химических реакций зависит от их концентрации.
3. Для веществ в твердом состоянии скорость химических реакций прямо пропорциональна поверхности реагирующих веществ.
4. При повышении температуры скорость большинства химических реакций увеличивается.
5. Скорость химических реакций зависит от присутствия некоторых веществ. Вещества, которые ускоряют химические реакции, но сами в итоге не расходуются, называются катализаторами, а вещества, которые замедляют скорость химических реакций – ингибиторами.
2. Обратимость химических реакций. Химическое равновесие.
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных реагирующих веществ в конечные вещества, называются необратимыми. Примером необратимой реакции может служить разложение бертолетовой соли при нагревании:
2KClO3 = 2KCl + 3O2
Реакция прекратится тогда, когда вся бертолетова соль превратится в хлорид калия и кислород. Необратимых реакций не так много. Большинство реакций являются обратимыми.
Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно противоположных направлениях. В уравнениях обратимых реакций между левой и правой частями ставятся две стрелки, направленные в противоположные стороны. Примером обратимой реакции может служить получение иодоводорода из водорода и иода:

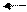 ½ Н2 + ½ I2 HI,
½ Н2 + ½ I2 HI, 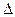 H0 = 25,9 кДж/моль
H0 = 25,9 кДж/моль
Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия. Так, в реакции получения иодоводорода равновесие наступает тогда, когда в единицу времени будет образовываться столько же молекул HI, сколько их будет распадаться на молекулы H2 и I2. Следовательно, химическое равновесие можно определить как такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
Направление смещения химического равновесия при изменениях концентрации реагирующих веществ, температуры и давления ( в случае газовых реакций) определяется общим положением, известным под названием принципа подвижного равновесия или принципа Ле-Шателье: если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствуют протеканию той из двух противоположных реакций, которая ослабляет воздействие. Поясним это на примере той же реакции синтеза иодоводорода.
Если внешнее воздействие выразится в увеличении концентрации водорода или иода, то оно смещает равновесие в сторону образования продукта реакции HI смещает равновесие в сторону исходных веществ.
Контрольные вопросы
1. Почему реакции сопровождаются: а) выделением энергии; б) поглощением
энергии? Приведите примеры таких реакций.
2. Приведите примеры гомогенных и гетерогенных каталитических реакций.
3. Почему пищевые продукты хранятся при низких температурах?
Лекция 7
План
1. Предмет органической химии и ее значение.
2. Источники органических соединений.
3. Сравнение органических и неорганических соединений.
1. Предмет органической химии. Органическая химия – химия соединений углерода. Вместе с тем известны также вещества, как, например, угольна кислота Н2СО3 и её соли, которые хотя и содержат углерод, но относятся к неорганическим соединениям. Действительно, четкую грань между неорганической и органической химией провести невозможно. Однако огромное большинство соединений углерода относят к органическим веществам.
Существует и другое определение: органическая химия – это химия углеводородов и их производных. Такое определение предмета органической химии дал в 70-х годах прошлого столетия Карл Шорлеммер – известный немецкий химик. Углеводородами называют простейшие органические вещества, в состав которых входят атомы только двух элементов – углерода и водорода. Производные углеводородов – это сложные вещества, которые можно рассматривать как продукты замещения атомов водорода в углеводородах на атомы других элементов или группы из нескольких атомов.
Название «органическая химия» возникло в начале XIXв, когда было выяснено, что углеродсодержащие вещества являются основой растительных и животных организмов. Изучением этих веществ и занималась органическая химия.
Современная органическая химия изучает как природные, так и синтетические органические вещества: их строение, пути получения, свойства, возможности практического использования. Не менее важной составной частью органической химии, как и химии вообще, является изучение общих закономерностей, определяющих свойства органических веществ, направление их реакций.
2. Источники органических соединений. В состав органических соединений всегда входит углерод, почти во всех имеется также водород. Многие органические вещества содержат кислород и азот, несколько реже – галогены, серы, фосфор. Перечисленные элементы образуют группу органогенов. В настоящее время вместе с тем широко развивалась область элементоорганической химии. В составе молекул элементоорганических соединений можно встретить почти любой элемент.
Сейчас известно около 5млн. углеродсодержащих соединений; веществ же, не содержащих углерода, насчитывается всего несколько сотен тысяч. Общая причина многообразия органических соединений в том, что в их молекулы входят десятки (а иногда – сотни и тысячи) атомов, располагающихся в равном порядке.
Типичные органические вещества характеризуются определенными свойствами, отличающими их от типичных неорганических веществ). Большинство органических веществ – жидкости или низкоплавкие твердые вещества, нерастворимые в воде.
3. Сравнение органических и неорганических соединений. Истинное различие между неорганическими и органическими веществами – в характере химических связей. Если для многих неорганических соединений характерно наличие полярных ковалентных и ионных связей, то в органической химии господствует ковалентная связь. Важна также способность углеводорода образовывать длинные цепи и кольца из атомов, связанных ковалентными связями.
Молекулярные формулы, выражающие состав молекул, недостаточны для полной характеристики органических веществ. Среди низ есть группы веществ, которые имеют одинаковую молекулярную формулу и тем не мене отличаются друг от друга по свойствам. Разные вещества, имеющие одинаковую молекулярную формулу, называются изомерами, а само явление носит название изомерии. Так, например, известны два изомерных вещества с формулой С2Н6О: жидкость – этиловый (винный спирт), газ – диметиловый эфир.
Явление изомерии было открыто на раннем этапе развития органической химии и способствовало развитию теории органической химии.
Контрольные вопросы
1. Количественный анализ жидкого органического вещества, состоящего из углерода и кислорода, дал следующие результаты: при сжигании 4,25 г вещества было получено 8,14 мг СО2 и 5,08 мг Н2О. Определите процентное содержание элементов в молекуле данного вещества. Какова его простейшая формула?
2. Вещество состава С2Н6О представляет собой жидкость с т.кип. 780С. Масса паров этой жидкости +1000С и нормальном давлении равна 1,50 г в объеме 1л. Определите молекулярную массу вещества.
Лекция 1
Тема: Важнейшие классы неорганических и органических веществ.
Атомно-молекулярное учение.
План
1. Оксиды.
2. Основания.
3. Соли.
4. Номенклатура неорганических соединений.
Среди неорганических соединений преобладают представители именно этих классов. Хотя, кроме них, вам известны амфотерные гидроксиды (алюминий гидроксид, цинк гидроксид и др.), пероксиды (гидроген пероксид и др.).
Вещества, формулы которых относятся к одному классу, подобны по составу, но отличаются физическими и химическими свойствами. Это даёт основание для классификации их в отдельные группы. Например, в зависимости от агрегатного состояния (физическая характеристика) оксиды делятся на твёрдые (например, фосфор (V) оксид), жидкие (например, вода), газообразные (например карбонат (IV) оксид.
Растворимые основания образуют мылкие растворы, вследствие чего эти вещества получили название щелочи. Это: литий гидроксид, натрий гидроксид, калий гидроксид, кальций гидроксид, барий гидроксид и некоторые другие. Их гораздо меньше, чем нерастворимых оснований.
1. Оксиды – это бинарные соединения элемента с Оксигеном, в которых он проявляет степень окисления. Они бывают солеобразующие и несолеобразующие. Солеобразующие оксиды в зависимости от их химических свойств разделяют на основные, кислотные и амфотерные.
Основные – это оксиды, взаимодействующие с кислотами, с образованием соли и воды.
К ним относятся оксиды металлических элементов со степенью окисления +1, +2, реже +3. Гидратами оксидов (гидратами формами), которые соответствуют основным оксидам, являются основания.
Например: Na2O – NaOH, CuO – Cu(OH)2,
Cu2O – CuOH, FeO – Fe(OH)2
Кислотные оксиды – это оксиды, взаимодействующие со щёлочами, с образованием соли и воды.
К ним относятся все солеобразующие оксиды неметаллических элементов и оксиды некоторых металлических элементов с высокими степенями окисления
( +5, +6, + 7). Гидратами оксидов (гидратными формами), которые соответствуют кислотным оксидам, являются кислоты.
Например: SiO2 – H2SiO3, P2O5 – H3PO4, Mn2O7 – HMnO4
Что касается кислотных оксидов и соответствующих им гидратов оксидов (оксигеносодержащих кислот), то для них также характерна закономерность, обнаруженная у оснований: атомы кислотнообразующих элементов в кислотном оксиде и соответствующей ему кислоте имеют одинаковую степень окисления.
Амфотерные оксиды – это те, что образуют соль и воду как с кислотой, так и со щёлочью.
К ним принадлежит небольшое количество оксидов металлических элементов: BeO, Al2O3, ZnO, PbO, Cr2O3 и некоторые другие. Гидратами оксидов (гидратными формами) которые соответствуют амфотерным оксидам, являются амфотерные гидроксиды.
Например: BeO – Be(OH)2, Al2O3 – Al (OH)3
Кислоты – это электролиты, которые в водном растворе диссоциируют на катионы Гидрогена и анионы кислотного остатка.
Например: HCl 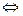 H+ + Cl H2SO4
H+ + Cl H2SO4 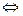 2H+ + SO2-4
2H+ + SO2-4
В растворах кислот имеются катионы Гидрогена, которые обусловливают общие свойства кислот. Так, кислоты взаимодействуют: 1) индикаторами; 2) металлами (расположенными в ряде активности до водорода); 3) основными и амфотерными оксидами; 4) основаниями и амфотерными гидроксидами; 5) солями других кислот, если один из продуктов реакции выпадает в осадок или выделяется в газообразном состоянии.
2. Основания – это электролиты, которые диссоциируют с образованием катионов металлического элемента и гидроксид-анионов.
Например: KOH = K+ + OH-
Наличие гидроксид -ионов обусловливает общие свойства щёлочей:
1) действие на индикаторы; 2) взаимодействие с кислотными и амфотерными оксидами; 3) взаимодействие с кислотами (реакция нейтрализации); 4) взаимодействие с амфотерными гидроксидами; 5) взаимодействие с солями, если один из продуктов реакции выпадает в осадок или выделится в газообразном состоянии.
3. Соли – это электролиты, которые диссоциируют с образованием катионов металлического элемента и анионов кислотного остатка. Например:
K2CO3= 2K+ + CO32-
Соли взаимодействуют с: 1) металлами, более активными, чем металл, ионы которого входят в состав соли (в растворе); 2) щёлочами (в растворе при условии образования осадка); 3) другой солью ( в растворе при условии образования осадка); 4) кислотами, являющимися более сильными электролитами, чем кислота, с солью которой проводят реакцию (при условии образования осадка или выделения газа); 5) разложение солей некоторых кислот (например, карбонатов, нитратов) при нагревании.
4. Номенклатура неорганических соединений. Кроме правильной записи химических формул и уравнений химических реакций, не менее важно правильно называть вещества. При повторении нужно помнить, что для оксидов, оснований и солей существует общее правило номенклатуры.
Дата: 2019-02-02, просмотров: 385.