План.
1. Электролиты и неэлектролиты.
2. Теория электролитической диссоциации.
3. Диссоциация кислот, оснований и солей в водных растворах.
1. Электролиты и неэлектролиты. Не все вещества одинаково хорошо проводят электрический ток. Самыми лучшими проводниками являются металлы. Соли, окислы и другие химические соединения в твердом виде чаще всего являются непроводниками. Чистые жидкости в обычных условиях также крайне плохо проводят ток. Но растворы многих твердых веществ в жидкостях отличаются значительной проводимостью.
Чистые соли и щелочи, а также многие окислы металлов в расплавленном состоянии также обладают электропроводимостью.
Вещества, которые в растворенном или расплавленном состоянии проводят электрический ток, называются электролитами.
К электролитам относятся соли, кислоты, основания и окислы некоторых металлов.
Если опустим электроды нашего прибора в водный раствор сахара или глицерина, то увидим, что лампочка не загорится. Следовательно, растворы этих веществ электрический ток не проводят.
Вещества, которые в растворенном или расплавленном состоянии не проводят электрический ток, называются неэлектролитами.
Неэлектролиты являются сахар, глицерин и многие другие вещества.
2. Теория электролитической диссоциации. Механизм электропроводности металлов отличается от механизма электропроводности растворов электролитов. При пропускании тока через металлический провод никаких изменений с ним не происходит, а при прохождении электрического тока через раствор происходит превращение растворенного вещества. Если опустить в раствор хлорной меди СиСl2 угольные электроды, присоединенные к полюсам аккумулятора, и через раствор пропустить постоянный ток, то у электрода, соединенного с положительным полюсом аккумулятора, выделяются пузырьки удушливого газа – хлора, а электрод, соединенный с отрицательным полюсом, покрывается слоем меди. Следовательно, хлорная медь при прохождении через ее раствор тока разлагается на медь т хлор.
Электрический ток представляет собой поток заряженных частиц, В металлических проводах заряженными частицами могут быть либо положительно заряженные ионы, включающие в себя ядра атомов, либо отрицательно заряженные электроны, которые легко отрываются от атомов металла. Так как при прохождении тока переноса атомов металла не происходит, то электропроводность металлов осуществляется движущимися электронами. Атомы, несущие электрический заряд, называются ионами. Следовательно, электролит в растворе распадается на ионы. Хлорная медь, в частности, распадается на ионы меди и хлора:
CuCl2 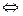 Cu2 + 2 Cl-
Cu2 + 2 Cl-
Молекулы электролита распадаются на ионы не под действием электрического тока, а в момент растворения.
Ионы могут быть простые, состоящие из одного атома (например, Ag+, Cu2+ и т.д.), и сложные, состоящие из нескольких атомов (например, NO-3, SO2-4 и др.).
Распад электролита на ионы при растворении его в воде называются электролитической диссоциацией.
Теория электролитической диссоциации, объясняющая особенности водных растворов распадом их на ионы, была предложена шведским ученым Сванте Аррениусом в 1887г. С тех пор она развивалась многими учеными на основе новых представлений о строении атомов и молекул. Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита при данных условиях пользуются понятием «степень диссоциации».
Степенью электролитической диссоциации называется отношение числа молекул, распавшихся на ионы, к общему числу растворенных молекул.
3. Диссоциация кислот, оснований и солей в водных растворах. Молекулы кислот, оснований и солей распадаются в растворе на противоположно заряженные частицы по месту ионной или сильнополярной связи. Такая связь существует между металлом и неметаллом, а также между водородом и неметаллом. При электролитической диссоциации эта связь частично разрушается растворителем.
Кислоты в водном растворе диссоциируют на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотных остатков. Например:
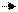

 HCl H + + Cl-
HCl H + + Cl-

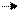 HNO3 H + + NO-3
HNO3 H + + NO-3

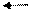 CH3COOH H+ + CH3COO-
CH3COOH H+ + CH3COO-
Следовательно, кислоты с точки зрения электролитической диссоциации – это электролиты, которые в водных растворах диссоциируют на положительно заряженные ионы водорода и отрицательно заряженные ионы кислотного остатка.
Молекулы основания в водном растворе распадаются на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила. Например:
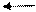
 NaOH Na+ + OH-
NaOH Na+ + OH-

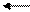 KOH K+ + OH-,
KOH K+ + OH-,
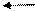
 Ca(OH)2 Ca2+ + 2OH-
Ca(OH)2 Ca2+ + 2OH-
Следовательно, основания – это электролиты, которые в водных растворах диссоциируют на положительно заряженные ионы металла и отрицательно заряженные ионы гидроксила.
Средние соли диссоциируют в воде на положительно заряженные ионы металла и на отрицательно заряженные ионы кислотных остатков. Например:

 KCl K+ + Cl
KCl K+ + Cl

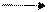 Na2CO3 2Na+ + CO2-3
Na2CO3 2Na+ + CO2-3

 Al2(SO4)3 2 Al3+ + 3SO2-4
Al2(SO4)3 2 Al3+ + 3SO2-4
При диссоциации кислых солей в водных растворах образуются также ионы водорода:

 NaHCO3 Na+ + HCO-3
NaHCO3 Na+ + HCO-3
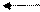
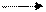 HCO-3 H+ + CO2-3
HCO-3 H+ + CO2-3
При диссоциации основных солей – ионы ОН-
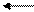
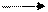 Sn (OH) Cl [Sn (OH]+ Cl-
Sn (OH) Cl [Sn (OH]+ Cl-
Сильными электролитами называются такие электролиты, у которых даже в сравнительно концентрированных растворах степень электролитической диссоциации велика (от 30 до 100%).
К сильным электролитам относятся почти все соли, а также азотная, хлорная, серная и другие кислоты, гидроокиси калия, натрия, кальция и т.п.
Слабыми электролитами называются электролиты, степень диссоциации которых также в разбавленных растворах мала.
Слабыми электролитами являются угольная кислота Н2СО3, уксусная кислота СН3СООН, сероводородная кислота H2S, гидроокись алюминия Al (OH)3, гидроокись железа Fe (OH)3 и др.
Растворы слабых электролитов плохо проводят электрический ток.
Контрольные вопросы
1. Какие вещества называют электролитами и неэлектролитами?
2. Какие вещества относят к слабым электролитам?
3. Как протекает диссоциация кислот, оснований и щелочей?
Лекция 6
Дата: 2019-02-02, просмотров: 315.