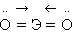Поскольку наиболее долгоживущими элементами являются первые 5f-элементы (Th – Am), их химические свойства изучены лучше, а многообразие проявляемых степеней окисления в значительной мере отличает их от типичных 4f-элементов и тяжелых 5f-элементов.
С водородом актиноиды образуют гидриды переменного состава (ThH2, Th4H15; PaH2–2,7; AmH2–2,7), но для урана можно получить и стехиометрический гидрид UH3. В общем случае гидриды этих элементов термически менее устойчивы, чем гидриды 4f-элементов.
С кислородом актиноиды образуют оксиды, соответствующие их наиболее устойчивым степеням окисления (ThO2, PaO2, Pa2O5, NpO2 и др.). К исключительно сложным следует отнести систему уран – кислород. Характерными для урана являются оксиды UO2 – UO2,25; U3O8 и UO3, из них наиболее устойчив U3O8 (UO2∙2UO3) – урановая смолка.
Отличительной особенностью кислородсодержащих соединений актиноидов в высших степенях окисления V, VI является наличие катионных группировок ЭО2+ и ЭО22+ или РаО2(ОН), UО2(ОН)2. Эти группировки называются иловыми оксоионами. Например, UO22+ – уранил, PaО2+ – протактинил. Оксоионы устойчивы и сохраняются без изменения в разнообразных химических реакциях:
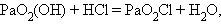
|
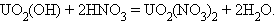
|
Особая устойчивость оксоионов объясняется тем, что связь между атомами актиноида и кислорода формально можно рассматривать как тройную:
|
Для ионов ЭО22+ прочность связи увеличивается в ряду Am < Pu < Np.
С галогенами актиноиды образуют многообразные галогениды ЭГn, где n = 3, 4, 5, 6. Фториды элементов в высших степенях окисления летучи, что позволило разделить изотопы урана 235U и 238U. Взаимодействие актиноидов с B, Si, C, N, P, S и Se приводит к образованию соединений нестехиометрического состава вследствие возможного присутствия элемента в разных степенях окисления.
Уменьшение радиусов элементов в ряду Th–Lr приводит к ослаблению основных свойств соединений.
Соединения актиноидов склонны к диспропорционированию. Например:
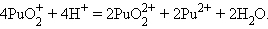
|
Свойства тяжелых 5f-элементов (Bk, Cf, Es, Md, No, Fm, Lr) изучены мало, поскольку они получены в виде короткоживущих радиоактивных изотопов в очень малых количествах. Однако есть основания полагать, что они подобны лантаноидам.
Актиноиды и их соединения используются в атомной энергетике. Торий используется как легирующая добавка в жаропрочных сталях, катализаторах при синтезе многих соединений, вакуумной электронике. Соли урана применяются как красители для стекла и глазурей, аналитические и фотографические препараты.
МЕТОДЫ РАЗДЕЛЕНИЯ РЗЭ
Вследствие близости свойств лантаноидов их разделение – сложная задача. Применявшиеся ранее способы разделения были основаны главным образом на различии в растворимости соединений лантаноидов. В результате большого числа дробных кристаллизаций или дробных осаждений (иногда достигавших нескольких тысяч) получали отдельные элементы большей или меньшей степени чистоты.
Для отделения некоторых элементов использовали способность их окисляться до четырехвалентного состояния (Се, Pr, Tb) или восстанавливаться до двухвалентного состояния (Sm, Eu, Yb). В этом случае разделение облегчается благодаря значительным отличиям в свойствах соединений лантаноидов со степенью окисления +4 и +2 и соединений лантаноидов со степенью окисления +3. По этому признаку легче всего разделить элементы цериевой группы. Сначала выделяют элементы, присутствующие в преобладающем количестве: Се, La, Y.
Современные схемы разделения лантаноидов основаны на использовании более эффективных методов: жидкостной экстракции и ионного обмена. Старые «классические» методы дробного осаждения и кристаллизации практически не используют в настоящее время.
Дробная кристаллизация
Метод основан на различной растворимости простых или двойных соединений РЗЭ и различии в температурных коэффициентах растворимости. Наиболее эффективна кристаллизация в виде двойных нитратов: 2Ln(NO3)3 ∙ 2Mg(NO3)2 ∙ 24H2O. Кроме двойных нитратов также используются двойные сульфаты и броматы.
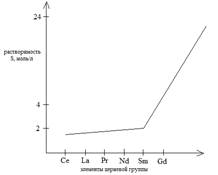
Легкие РЗЭ кристаллизуются из раствора, а тяжелые остаются в маточном растворе.
Дробное осаждение
Основано на различной растворимости соединений в растворе. Основным недостатком процесса является образование местных пересыщений в момент добавления осадителя. Для предотвращения этого вводят добавки, селективно (т.е. избирательно) повышающие растворимость.
· Наиболее эффективно осаждение гидроксидов. рН осаждения гидроксидов возрастает от Lu к La (от 6 до 8).
Недостатки метода: необходимость работать с разбавленными растворами, плохая фильтруемость осадков, высокая адсорбционная способность осадков.
· Часто в технологии используют двойные сульфаты (они имеют отрицательный температурный коэффициент). В насыщенных растворах сульфатов щелочных металлов наименьшей растворимостью обладают сульфаты элементов цериевой группы от La до Sm; плохо, но несколько лучше растворимы сульфаты от Eu до Tb. Элементы иттриевой группы от Dy до Lu, иттрий обладают наибольшей растворимостью.
Ln2(SO4)3 + Na2SO4 + 2H2O 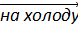 Ln2(SO4)3 ∙ Na2SO4 + 2H2O.
Ln2(SO4)3 ∙ Na2SO4 + 2H2O.
Вследствие изоморфизма (схожести по свойствам) многие элементы иттриевой подгруппы осаждаются совместно с элементами цериевой подгруппы, и для уменьшения этого явления используют разбавленные растворы (поэтому в формуле присутствует вода).
Осадитель добавляют до полного выделения Nd (La, Ce, Pr остаются в растворе). Осадок отделяют, оставшийся раствор нагревают – в осадок выпадает средняя фракция лантаноидов (в растворе остаются элементы иттриевой группы). Остаток сульфатов цериевой группы обрабатывают раствором щелочи. Образовавшуюся пульпу гидрокисдов разбавляют, затем добавляют азотную кислоту:
2Ln(ОН)3 + 4Na2SO4 + 2H2O 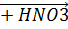 Ln2(SO4)3 ∙ Na2SO4 + 2NaNO3 + H2O.
Ln2(SO4)3 ∙ Na2SO4 + 2NaNO3 + H2O.
Эти операции повторяют 5-10 раз и таким образом разделяют иттриевую и цериевую группы.
· Кроме того, возможно осаждение оксалатов Ln2(C2O4)3. Метод основан на уменьшении растворимости от La к Lu. Оксалаты осаждают в присутсвии комплексообразователей, например, трилона Б для большего различия в рН начала осаждения.
Процесс проводят следующим образом:
Ln2O3 + HNO3 → Ln(NO3)3
Ln(NO3)3 + (NH4)2C2O4 → Ln2(C2O4)3↓ + NH4 NO3
Затем осадок растворяют в трилоне Б, образуется комплекс Na3[Ln(N(CH2COO)3)2]. При подкислении выпадает практически чистый оксалат лантана.
Дата: 2019-02-02, просмотров: 754.