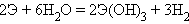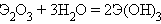РАЗДЕЛ 3 Редкие и рассеянные элементы III группы Периодической системы элементов Д.И. Менделеева
Тема 3.1 Общая характеристика свойств III -А подгруппы элементов – 4 часа
Тема 3.2 Общая характеристика свойств III -Б подгруппы элементов – 4 часа
Химические, физические свойства элементов III -Б подгруппы: скандий, иттрий, лантан; технология получения основных соединений
К III-Б группе относятся скандий, иттрий, лантан и актиний. За лантаном и актинием в периодической системе расположены семейства элементов, названных лантаноидами и актиноидами, каждое из которых состоит из 14 элементов. Металлы III-Б группы (кроме актиния) и лантаноиды принято называть редкоземельными металлами.
В 1794 г. финский химик Ю. Гадолин, изучая минерал, который незадолго до этого был обнаружен в каменоломне вблизи городка Иттерби недалеко от Стокгольма, выделил, как он считал, новый оксид (или «землю»), названный А.Г. Экебергом в 1797 г. иттриевой землей. Как оказалось, этот оксид представлял собой смесь оксидов металлов. Оксид иттрия был выделен из нее К.Г. Мосандером в 1843 г.
Впервые металлический иттрий, хотя и очень загрязненный примесями, был получен Ф. Велером в 1828 г. путем восстановления трихлорида иттрия калием. За четыре года до выделения иттриевой земли Мосандер извлек из нитрата церия примесь — оксид лантана (от греческого
«скрываюсь», «прячусь»), но только в 1923 г. относительно чистый металлический лантан был получен электролизом расплава галогенидов.
Скандий, первый член этой группы элементов, встречается в тех же шведских рудах, из которых были выделены иттрий и лантан, хотя и в очень небольших количествах. Возможно, именно по этой причине он был открыт только в 1879 г., когда Л.Ф. Нильсон выделил новый оксид и назвал его скандиевой землей. Через несколько лет, П.-Т. Клеве, имея в своем распоряжении уже достаточно большое количество этого оксида, получил из него целый ряд солей. Ему удалось показать, что это был оксид нового элемента, свойства которого очень напоминали свойства, предсказанные Д.И. Менделеевым для экабора — элемента, отсутствовавшего в периодической системе. Сам металл был получен только в 1937 г. электролизом расплава хлоридов калия, лития и скандия, а в 1960 г. был произведен первый фунт (453,6 г) скандия 99%-ной чистоты.
Последний элемент группы — актиний — был идентифицирован в урановых минералах А. Дебьерном в 1899 г., год спустя после того как П. и М. Кюри открыли в тех же минералах полоний и радий.
Скандий
Об этом элементе слагают легенды. Например, что в виде металла он намного дороже золота, и поэтому банки скупают чистый скандий и хранят как высоколиквидный актив, что он придает уникальные свойства сплавам и соединениям, и поэтому его считают металлом ХХI века.
Скандий – двадцать первый элемент Периодической таблицы. Обозначение – Sc от латинского «scandium». Расположен в четвертом периоде, III-Б группе. Относится к металлам. Заряд ядра равен 21.
Скандий содержится в земной коре в количествах порядка 10-3% (масс.). В свободном состоянии он представляет собой серебристо-белый металл с высокой температурой плавления (1541oС). Плотность – 3,0 г/см3. По химической активности скандий уступает лишь щелочным и щелочноземельным металлам. Вследствие пассивирования скандий не растворяется в воде и с ней не взаимодействует.
Поскольку в свободном состоянии скандий существует в виде одноатомных молекул Sc, значения его атомной и молекулярной масс совпадают. Они равны 44,9559.
Известно, что в природе скандий может находиться в виде единственного стабильного изотопа 45Sc. Массовое число равно 45, ядро атома содержит двадцать один протон и двадцать четыре нейтрона.
Существуют искусственные изотопы скандия с массовыми числами от 36-ти до 60-ти, среди которых наиболее стабильным является 46Sc с периодом полураспада равным 83,79 суток, а также десять ядерных изотопов.
На внешнем энергетическом уровне атома скандия имеется три электрона, которые являются валентными:
1s22s22p63s23p63d14s2.
В результате химического взаимодействия скандий отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Sc0 - 3e → Sc3+.
В свободном состоянии скандий существует в виде одноатомных молекул Sc.
Содержание скандия в земной коре 6∙10-4%, основные минералы: тортвейтит Sc2Si2O7 и стереттит ScPO4*H2O.
Получают скандий восстановлением ScF3 или ScCl3 металлическим кальцием с последующей перегонкой в вакууме: скандий, как и ряд других РЗМ, получают из оксидов, переводя их во фторид с последующим восстановлением металлическим кальцием. Полученный скандий и шлак разделяют вакуумным переплавом.
Таким способом можно получить скандий с чистотой более 95%. Доведение скандия до чистоты 99% и выше — многоступенчатый процесс. Так получают скандий в виде слитков.
Мелкодисперсный порошок скандия получают методом гидрирования.
Важным источником скандия являются отходы — так называемые хвосты производства вольфрама, олова, алюминия, титана, ванадия, чугуна, урана. В шламах и отвалах гидро- и пирометаллургических производств содержание скандия возрастает в 10–5000 раз. Общее содержание скандия в ежегодно образующихся шламах и отвалах на несколько порядков превышает его современное производство.
Скандий – легкий металл с характерным желтым отливом, который появляется при контакте металла с воздухом. Металлический скандий имеет удельный вес 2,99 г/см3 при 20°С (легкий металл), плавится при 1539°С, кипит при 2727°С, хрупок, слабо парамагнитен.
Химические свойства
Скандий – активный, легко окисляющийся металл, разлагающий воду при нагревании, легко растворяющийся при нормальной температуре в разбавленных кислотах с образованием солей и выделением водорода:
Sc + 3H2O = Sc(OH)3 + 1,5H2
2Sc + 3H2SO4 = Sc2(SO4)3 + 3H2
При нагревании металлический скандий взаимодействует с кислородом, хлором, бромом, йодом, серой и азотом с образованием соответственно Sc2O3, ScCl3, ScBr3, ScI3, Sc2S3, ScN.
В соединениях проявляет степень окисления +3 (редко +2). В растворах скандий находится либо в виде катионов Sc3+, либо в составе комплексных анионов: [ScF4]-, [ScF5]2- и т.д. Свойства многих соединений скандия близки к свойствам аналогичных соединений алюминия.
Важнейшие соединения
Оксид скандия Sc2O3 получают при нагревании металла в атмосфере кислорода, а также прокаливанием на воздухе гидроксида, нитрата, карбоната или оксалата скандия. Он представляет собой рыхлый белый порошок или бесцветные кубические кристаллы. После сильного прокаливания Sc2O3 плохо растворяется в концентрированной HCl. При сплавлении с оксидами щелочных и щелочноземельных металлов образует скандиаты, напр., LiScO2. Оксид скандия используют в производстве ферритов, люминофоров, стекла и керамики.
Гидроксид скандия Sc(OH)3 получают обработкой растворов солей скандия щелочами:
Sc(NO3)3 + 3NaOH = Sc(OH)3 + 3NaNO3.
Гидроксид скандия можно выделить в виде белого аморфного порошка или в виде бесцветных кубических гранецентрированных кристаллов, а также в виде студнеобразного белого осадка, трудно растворимого в воде.
Амфотерный гидроксид с преобладанием основных свойств, в концентрированных растворах щелочей образует гидроксоскандиаты, например: Na3[Sc(OH)6].
Хлорид скандия ScCl3 получают действием сухого хлора на металлический скандий при нагревании, на сульфиды, карбиды скандия или смесь Sc2O3 c углем. Он представляет собой бесцветные ромбоэдрические кристаллы, растворимые в спирте и гидролизующиеся легче, чем хлориды редкоземельных металлов.
Сульфид скандия Sc2S3 получают действием паров серы на металлический скандий, обработкой сероуглеродом оксида скандия или нагреванием безводного сульфата скандия в атмосфере сероводорода. Sc2S3 – желтое твердое вещество; устойчив на воздухе, гидролизуется кипящей водой:
Sc2S3+6HOH=2Sc(OH)3+3H2S.
Гидриды скандия получают взаимодействием скандия с недостатком (ScH2) или избытком (ScH3) водорода при нагревании. Твердые вещества серого цвета, электропроводны.
Карбид скандия Sc4C3, образуется в виде черных гексагональных кристаллов восстановлением оксида скандия углем при нагревании. Компонент металлокерамики.
Применение
Скандий – компонент легких сплавов с высокой прочностью и коррозионной стойкостью, нейтронный фильтр в ядерной технике.
Скандий образует сплавы с алюминием, при этом существенно улучшаются свариваемость, коррозионная стойкость, ковкость, механические характеристики и почти в два раза увеличивается область рабочих температур.
Так называемый суперсплав — superalloy — алюминий с 2% скандия внедряется в современную авиационную технику. В разработку алюмоскандиевых сплавов очень большой вклад внесли советские и российские ученые. Эти сплавы прекрасно работают в авиакосмических изделиях: истребителях, транспортных самолетах, космических аппаратах, а также в других высокотехнологичных продуктах: автомобильные двигатели и кузовные детали, клюшки для гольфа и биты для бейсбола, рамы для спортивных велосипедов и мотоциклов — везде, где требуется сочетание прочности, долговечности и легкости.
Скандий используется как компонент сплавов с высокой прочностью и коррозионной стойкостью на основе магния, титана, никеля, кобальта, хрома, вольфрама, циркония.
Другая область применения скандия — твердо-оксидные топливные элементы, в которых скандий используют как добавку в циркониевых катодах, и эти катоды обеспечивают наилучшую ионную проводимость.
Оксид скандия обеспечивает высокую яркость ламп, а иодид скандия ScI3 приближает спектр ламп к спектру дневного света, и такие лампы используются для освещения при телесъемках и на стадионах.
Оксид скандия также используется в производстве ферритов с малой индукцией, стекол для оптоэлектроники и в производстве солнечных батарей. Скандий применяется для производства многослойных рентгеновских зеркал в виде композиции: скандий-вольфрам, скандий-хром, скандий-молибден. Теллурид скандия рассматривают как перспективный материал для производства термоэлементов, поскольку он имеет высокую термо-электродвижущую силу, малую плотность и высокую прочность.
Известны тугоплавкие интерметаллические сплавы скандия с рением (температура плавления до 2575°C), рутением (температура плавления до 1840°C), обладающие высокой жаропрочностью и приемлемой плотностью. Скандий используют для синтеза сверхтвердых материалов и других материалов.
Области применения скандиевых сплавов
1) металлургия,
2) оптоэлектроника: производство германатных стекол,
3) производство спортивной экипировки,
4) авиационная промышленность,
5) ракетостроение,
6) микроэлектроника,
7) ядерная энергетика,
8) медицина,
9) производство лазерных материалов, солнечных батарей, МГД-генераторов, рентгеновских зеркал, огнеупорных материалов, фианитов,
10) радиоэлектронная промышленность: производство люминофоров,
11) производство осветительных элементов высокой интенсивности
Примеры решения задач
Пример 1
| Задание | Рассчитайте массовые доли элементов, входящих в состав оксида скандия, если его молекулярная формула имеет вид Sc2O3. |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: ω (Х) = n × Ar (X) / Mr (HX) × 100%. Найдем молекулярную массу оксида скандия: Mr(Sc2O3) = 2×Ar(Sc) + 3×Ar(O) = 2×45 + 3×16 = 90 + 48 = 138 г. Тогда, массовые доли скандия и кислорода будут равны: ω (Sc) = 2 × Ar (Sc) / Mr (Sc2O3) × 100%; ω (Sc) = 2 × 45 / 138 × 100% = 65,22%. ω (O) = 3 × Ar (O) / Mr (Sc2O3) × 100%; ω (O) = 3 × 16 / 138 × 100% = 34,78%. |
| Ответ | Массовая доля скандия равна 65,22%, массовая доля кислорода равна 34,78%. |
Пример 2
| Задание | Осуществите ряд превращений: Sc→Sc(OH)3→ Sc2O3→ ScCl3→Sc(OH)3. |
| Ответ | При растворении скандия в горячей воде выпадает осадок гидроксида скандия и происходит выделение пузырьков газа (водород): 2Sc + 6H2Ohot→ 2Sc(OH)3¯ + 3H2. При нагревании полученного осадка до температуры 460oС происходит его разложение, в результате которого образуется оксид скандия: 2Sc(OH)3→Sc2O3 + 3H2O. В результате растворения оксида скандия в концентрированной соляной кислоте получается хлорид скандия: Sc2O3 + 6HClconc→ 6ScCl3 + 3H2O. При добавлении к хлориду скандия холодного разбавленного раствора щелочи образуется гидроксид скандия: ScCl3 + 3NaOHcold, dilute→Sc(OH)3¯+ 3NaCl. |
Иттрий
Остров Руслаген – один из многочисленных островков на Балтике близ столицы Швеции Стокгольма – знаменит тем, что здесь находится городок Иттербю, название которого отражено в именах четырех химических элементов – иттрия, иттербия, тербия и эрбия. В 1787 г. лейтенант шведской армии минералог-любитель Карл Аррениус нашел здесь, в заброшенном карьере, неизвестный прежде черный блестящий минерал. Этот минерал назвали иттербитом. Спустя 130 лет финский минералог Флинт скажет, что он «сыграл в истории неорганической химии, быть может, большую роль, чем какой-либо другой минерал».
В этом утверждении безусловно есть преувеличение. Но так же, безусловно, что минерал, в котором нашли семь новых химических элементов, – вещь незаурядная. Тем не менее, ни в одном минералогическом справочнике названия «иттербит» сейчас не найти.
Первым серьезным исследователем этого минерала и первооткрывателем окиси иттрия был финский химик Юхан Гадолин (1760...1852). Это он, проанализировав иттербит, обнаружил в нем окислы железа, кальция, магния и кремния, а также 38% окиси неизвестного еще элемента. Через три года шведский ученый Экеберг подтвердил результат финского коллеги и ввел в химический обиход название «иттриевая земля». Позже, еще при жизни Гадолина, было решено называть открытый им элемент иттрием, а минерал из Иттербю переименовали в гадолинит.
Впрочем, впоследствии оказалось, что упоминавшиеся 38% приходятся на долю не одного, а нескольких новых элементов. «Расщепление» окиси иттрия заняло больше 100 лет.
В 1843 г. Карл Мозандер поделил ее на три компонента, три окисла: бесцветный, коричневый и розовый. Три окисла – три элемента, название каждого происходит от фрагментов также «расщепленного» слова Иттербю. От «итт» – иттрий (бесцветная окись), от «тер» – тербий (коричневая) и от «эрб» – эрбии (розовая окись).
В 1879 г. из окиси иттрия были выделены окислы еще трех элементов – иттербия, тулия и предсказанного Менделеевым скандия. А в 1907 г к ним прибавился еще один элемент – лютеций.
Это единственный случай в истории науки: один минерал, причем редкий минерал, оказался «хранителем» семи новых элементов.
С позиции современной химии этот факт легко объясним: электронное строение атомов редкоземельных элементов – а к ним относится скандий, иттрий, лантан и 14 лантаноидов – очень сходно. Химические свойства их, в том числе свойства, определяющие поведение элемента в земной коре, трудноразличимы. Очень близки размеры их ионов. В частности, у иттрия и тяжелых элементов семейства лантаноидов – гадолиния, тербия, диспрозия, гольмия, эрбия, тулия – размеры трехвалентного иона практически одинаковы, разница в сотые доли ангстрема.
Трудность выделения иттрия (как, впрочем, и любого из его аналогов) привела к тому, что на протяжении десятилетий свойства этого элемента оставались почти не изученными. Первый металлический иттрий (сильно загрязненный примесями) получен Фридрихом Вёлером в 1828 г., но и через 100 лет плотность иттрия не была определена достаточно точно. Даже состав окиси иттрия никто не определил верно до появления периодического закона. Считали, что это YO; правильную формулу – Y2O3 – первым указал Менделеев.
Иттрий – химический элемент, который по своим свойствам относится к аналогам лантана. Его часто находят в составе минералов, которые содержат лантаноиды. Изредка исследователи находят редкие земли, содержащие большую или меньшую концнетрацию иттрия или церия. Чаще эти соединения трудноразделимы.
Иттрий – тридцать девятый элемент Периодической таблицы. Обозначение – Y от латинского «yttrium». Расположен в пятом периоде, IIIB группе. Относится к металлам. Заряд ядра равен 39.
Иттрий всегда встречается в природе вместе с лантаноидами, поскольку является их химическим аналогом. Главные минералы иттрия – ксенотиум YPO4, тортвейтит (Y, Sc)2Si2O7 и гадолинит Y2FeBe2Si2O10. Иттрий также содержится в виде различных солей в морской воде (0,0003 мг/л).
В виде простого вещества иттрий представляет собой светло-серый металл, существующий в двух кристаллических модификациях: α-иттрий (гексагональная решетка) и b-иттрий (кубическая объемноцентрированная решетка), первая из которых устойчива при температуре ниже 1482 °C, а вторая – выше 1482 °C.
Поскольку в свободном состоянии иттрий существует в виде одноатомных молекул Y, значения его атомной и молекулярной масс совпадают. Они равны 88,9058.
Известно, что в природе иттрий может находиться в виде единственного стабильного изотопа 89Y. Массовое число равно 89, ядро атома содержит тридцать девять протонов и пятьдесят нейтронов.
Существуют искусственные нестабильные изотопы иттрия с массовыми числами от 76-ти до 108-ми, а также двадцать восемь изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 88Y с периодом полураспада равным 106,616 суток.
На внешнем энергетическом уровне атома иттрия имеется три электрона, которые являются валентными:
1s22s22p63s23p63d104s24p64d15s2.
В результате химического взаимодействия иттрий отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Yo -3e → Y3+.
В свободном состоянии иттрий существует в виде одноатомных молекул Y.
К числу «редких земель» иттрий отнесли не случайно. Всем своим обликом и поведением он подобен лантану и лантаноидам.
Иттрий легко растворяется в минеральных кислотах, кроме, как это ни странно, плавиковой. В кипящей воде он постепенно окисляется, а на воздухе при температуре 400°C окисление иттрия идет достаточно быстро. Но при этом образуется темная блестящая пленка окиси, плотно окутывающая металл и препятствующая окислению в массе. Лишь при 760°C эта пленка теряет защитные свойства, и тогда окисление превращает светло-серый металл в бесцветную или черную (от примесей) окись.
Иттрий плотно заперт в кристаллической решетке минерала и вырвать его оттуда далеко не просто. Правда, сейчас уже во многих странах налажено попутное извлечение иттрия при переработке цериевых, урановых и ториевых руд; как источник элемента №39 используют и некоторые минералы самого иттрия, прежде всего бастнезит. Но во всех случаях извлечение этого металла – дело трудное и долгое.
Вот как, к примеру, получают иттрий из ксенотима.
Казалось бы, просто. Формула минерала – YPО4. Давно известно, что лучше всего восстанавливать иттрий из его галогенидов. Значит, нужно провести обменную реакцию: вместо фосфата иттрия получить фторид или хлорид, а затем восстановить его. Всего две производственных стадии – чего проще!
Но просто все лишь на бумаге. В действительности в ксенотиме, уже обогащенном на магнитном сепараторе, всего 36% Y2O3 (в виде фосфата) и 24% окислов других редкоземельных элементов. И здесь мешает ставшая уже притчей во языцех общность всех этих элементов.
«Вскрывают» минерал, обрабатывая его серной кислотой при высокой температуре. Полученный раствор подают на ионообменную колонну, заполненную катионообменной смолой. Избирательная способность катионита не слишком высока: он принимает почти все трехвалентные положительно заряженные ионы. Значит, на этой стадии иттрий отделяется лишь от «неродственных» элементов, а редкоземельные остаются в колонне вместе с ним.
Чтобы «смыть» иттрий с катионита, через колонку начинают пропускать элюент – раствор этилендиаминтетрауксусной кислоты. Такой «душ» полезен потому, что на этой стадии образуются комплексные соединения иттрия и других редких земель, отличающиеся одно от другого больше, чем классические соединения этих элементов, отчего ионы иттрия и ионы прочих редкоземельных элементов удерживаются катионитом с неодинаковой силой. Значит, в разных фракциях элюента будут преобладать уже разные элементы.
Отобрав иттриевую фракцию и подвергнув ее дополнительной очистке, на нее воздействуют щавелевой кислотой и получают оксалат иттрия. Его прокаливают, превращая в окись. Этим способом на 12 колоннах (высотой 3 и диаметром 0,75 м) за месяц получают чуть больше 100 кг Y2O3. Впрочем, считать месячную производительность неразумно: процесс длится два месяца. Выход 99,9%-ной окиси иттрия за два месяца – 225 кг.
Описанная схема – одна из многих; чаще всего окись иттрия получают из бастнезита совсем другим путем.
Окись иттрия находит самостоятельное применение. Известно, что она, как и окись скандия, входит в состав ферритов – элементов памяти электронно-вычислительных машин.
После того как иттрий отделен от основной массы редкоземельных элементов, его нужно восстановить. Для этого окись превращают в один из галогенидов иттрия, например, во фторид:
Y2О3 + 6HF →(700°C)→ 2YF3 + 3H2О.
Это соединение смешивают с дважды перегнанным металлическим кальцием, помещают все в танталовый тигель и закрывают перфорированной крышкой. Тигель отправляют в кварцевую индукционную печь. Печь закрывают, откачивают из нее воздух и начинают медленно нагревать. Когда температура достигнет 600°C, в печь пускают аргон, а прекращают его подачу, когда давление в печи достигнет 500 мм ртутного столба. Затем температуру повышают до 1000°C, и восстановление начинается. Реакция 2YF3 + 3Ca → 2Y + 3CaF2 – экзотермическая, и температура в печи продолжает расти. Тогда еще «поддают жару», доводят температуру до 1600°C (в этих условиях лучше разделяются металл и шлак), после чего дают печи остыть.
Шлак легко откалывается, и остается слиток иттрия чистотой до 99%. Примесь кальция без труда удаляется вакуумной переплавкой; трудное избавиться от тантала (0,5...2%) и кислорода (0,05...0,2%). Но и это можно сделать и получить слитки, пригодные для промышленного использования и для уточнения физико-химических характеристик элемента №39.
Для этого элемента неприменимо такое общее, казалось бы, понятие, как «природная смесь изотопов». Нет у него природной смеси: весь естественный иттрий – это только один стабильный изотоп иттрий-89. И только одну валентность (3+) проявляет иттрий во всех известных соединениях. Но, возможно, это утверждение не есть «истина в последней инстанции». Сложности получения элементарного иттрия и высокая цена (килограмм иттрия еще недавно стоил 440 долларов) в течение многих лет сдерживали исследования элемента №39 и его соединений. Поэтому не исключено, что когда-нибудь будут получены соединения иттрия с «нестандартной» валентностью, как это случилось, например, с алюминием. Ведь во времена, когда алюминиевая посуда была привилегией королей, ни один химик не подозревал о существовании соединений одновалентного алюминия.
На один стабильный изотоп иттрия 89Y приходятся пятнадцать радиоактивных с массовыми числами от 82 до 97 и периодами полураспада от минуты до 105 дней. Некоторые из этих изотопов образуются при спонтанном делении ядер урана. Именно поэтому в таблице Менделеева указано, что атомная масса природного иттрия равна 88,905, а не ровно 89. Наиболее изучен радиоактивный иттрий-91, образующийся, в частности, при ядерных взрывах. Наряду со стронцием-90 этот изотоп считается одним из наиболее опасных продуктов распада. Опасен и дочерний продукт стронция-90 – иттрий-90. Эти изотопы накапливались в мировом океане в результате экспериментальных ядерных взрывов и захоронения на океанском дне радиоактивных отходов. Ученые считают, что они стали причиной существенного уменьшения рыбных запасов мирового океана.
Сплавы иттрия
Сплавы на основе иттрия нашли свое применение в таких отраслях народного хозяйства как авиакосмическая промышленность, атомная техника и автомобилестроение. Помимо этого, иттрий используют в качестве легирующего компонента сплавов на основе алюминия, жаростойких сплавов никеля с хромом и др., что позволяет значительно повысить их электропроводность.
Примеры решения задач
ПРИМЕР 1
| Задание | Рассчитайте массовые доли элементов, входящих в состав оксида иттрия, если его молекулярная формула имеет вид Y2O3. |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: ω (Х) = n × Ar (X) / Mr (HX) × 100%. Найдем молекулярную массу оксида иттрия: Mr(Y2O3) = 2×Ar(Sr) + 3×Ar(O) = 2×89 + 3×16 = 178 + 48 = 226. Тогда, массовые доли иттрия и кислорода будут равны: ω (Y) = 2×Ar (Y) / Mr (Y2O3) × 100%; ω (Y) = 2×89 / 226 × 100% = 78,76%. ω (O) = 3×Ar (O) / Mr (Y2O3) × 100%; ω (O) = 3×16 / 226 × 100% = 21,24%. |
| Ответ | Массовая доля иттрия равна 78,76%, массовая доля кислорода равна 21,24%. |
Лантан ( La )
Лантан – пятьдесят седьмой элемент Периодической таблицы. Обозначение – La от латинского «lanthanum». Расположен в шестом периоде, IIIB группе. Относится к металлам. Заряд ядра равен 57.
Лантан относится к группе редкоземельных элементов, однако он, по сравнению с другими представителями этой группы более распространен в природе, так содержание лантана в земной коре составляет порядка 2,9×10-3% (масс.).
В виде простого вещества лантан представляет собой серебристо-белый (в виде порошка — серый), мягкий, пластичный пирофорный металл (рис. 1). Парамагнитен. Во влажном воздухе покрывается оксидно-гидроксидной пленкой. Пассивируется в холодной воде; не реагирует со щелочами. Сильный восстановитель; реагирует с горячей водой, разбавленными кислотами; при нагревании окисляется кислородом, азотом, хлором, серой.
Поскольку в свободном состоянии лантан существует в виде одноатомных молекул La, значения его атомной и молекулярной масс совпадают. Они равны 138,9054.
Известно, что в природе лантан может находиться в виде двух стабильных изотопов 139La (99,911%) и 138La(радиоактивный). Их массовые числа равны 138 и 139 соответственно. Ядро атома изотопа лантана 139La содержит пятьдесят семь протонов и восемьдесят два нейтрона, а изотопа 138La – такое число протонов и восемьдесят один нейтрон.
Существуют искусственные нестабильные изотопы лантана с массовыми числами от 117-ти до 155-ти, а также двенадцать изомерных состояния ядер, среди которых наиболее долгоживущим является изотоп 137La с периодом полураспада равным 60 тысяч лет.
На внешнем энергетическом уровне атома лантана имеется три электрона, которые являются валентными:
1s22s22p63s23p63d104s24p64d104f15s25р 66s2.
В результате химического взаимодействия лантан отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
La0 -3e → La3+.
В свободном состоянии лантан существует в виде одноатомных молекул La.
Самое знаменательное в элементе №57, несомненно, то, что он возглавляет шеренгу из 14 лантаноидов – элементов с чрезвычайно сходными свойствами. Лантан и лантаноиды – всегда вместе: в минералах, в нашем представлении, в металле. На Всемирной выставке в Париже в 1900 г. были впервые продемонстрированы образцы некоторых чистых, как считалось, лантаноидов. Но можно не сомневаться, что в каждом образчике, независимо от ярлыка, присутствовали и лантан, и церий, и неодим с празеодимом, и самые редкие из лантаноидов – тулий, гольмий, лютеций. Самые редкие, если не считать «вымершего» и воссозданного в ядерных реакциях элемента №61 – прометия. Впрочем, будь у прометия стабильные изотопы, он тоже присутствовал бы в любом образце любого редкоземельного элемента.
Лишь в последние десятилетия развитие науки и техники достигло того уровня, при котором человечество смогло поставить себе на службу индивидуальные качества каждого (или почти каждого) из лантаноидов, хотя, как и прежде, одним из самых массовых и дешевых редкоземельных продуктов остается мишметалл – «природный сплав» лантана и лантаноидов... Поэтому было бы логично посвятить лишь половину этого рассказа непосредственно элементу №57, а другую половину – редкоземельной «команде» в целом (лантан, лантаноиды, скандий и иттрий). Разумеется, каждый из лантаноидов – как химический индивидуум – заслуживает самостоятельного рассказа; здесь же – об их «предводителе» и об общем для всех них.
Лантан – это металл, обыкновенный по внешнему виду (серебристо-белый, покрытый сероватой окисной пленкой) и по физическим свойствам: температура плавления 920°С, кипения 3469°C; по прочности, твердости, электропроводности и прочим характеристикам металл лантан всегда оказывается в середине таблиц. Обыкновенен лантан и по химическим свойствам. В сухом воздухе он не изменяется – окисная пленка надежно защищает от окисления в массе. Но если воздух влажен (а в обычных земных условиях он влажен почти всегда), металлический лантан постепенно окисляется до гидроокиси. La(OH)3 – основание средней силы, что опять-таки характерно для металла-«середнячка».
Что еще можно сказать о химических свойствах лантана? В кислороде при нагревании до 450°C он сгорает ярким, пламенем (при этом выделяется довольно много тепла). Если же прокаливать его в атмосфере азота, образуется черный нитрид. В хлоре лантан загорается при комнатной температуре, а с бромом и йодом реагирует лишь при нагревании. Хорошо растворяется в минеральных кислотах, с растворами щелочей не реагирует. Во всех соединениях лантан проявляет валентность 3+. Словом, металл как металл – и по физическим свойствам, и по химическим.
Единственная, пожалуй, отличительная черта лантана – характер его взаимодействия с водородом. Реакция между ними начинается уже при комнатной температуре и идет с выделением тепла. Образуются гидриды переменного состава, поскольку одновременно лантан поглощает водород – тем интенсивнее, чем выше температура.
Так же взаимодействуют с водородом и лантаноиды. Один из них – церий – даже используют как газопоглотитель в электровакуумной промышленности и в металлургии.
По распространенности в природе, по масштабам производства, по широте использования лантан уступает своему ближайшему аналогу – первому из лантаноидов. «Родоначальник» и – вечно второй, таково положение лантана в его семействе. И когда редкоземельные элементы по совокупности свойств стали делить на две подгруппы, лантан был отнесен в подгруппу, название которой дали в честь церия... И открыт лантан был после церия, как примесь к церию, в минерале церите. Вот эта история, история об учителях и учениках.
В 1803 г. 24-летний шведский химик Йене Якоб Берцелиус вместе со своим учителем Хизингером исследовал минерал, известный теперь под названием церита. В этом минерале была обнаружена открытая Гадолином в 1794 г. иттриевая земля и еще одна редкая земля, очень похожая на иттриевую. Ее назвали цериевой. Почти одновременно с Берцелиусом цериевую землю открыл знаменитый немецкий химик Мартин Клапрот.
К работе с этим веществом Берцелиус вернулся через много лет, будучи уже именитым ученым. В 1826 г. Карл Мозандер – ученик, ассистент и один из близких друзей Берцелиуса – исследовал цериевую землю и заключил, что она неоднородна, что в ней, помимо церия, содержится еще один, а может быть и не один, новый элемент. Но, чтобы проверить это предположение, нужно было много церита. Доказать сложность цериевой земли Мозандеру удалось лишь в 1839 г.
Интересно, что годом раньше неизвестный среди химиков студент Эрдманн нашел в Норвегии новый минерал и назвал его в честь своего учителя Мозандера – мозандеритом. Из этого минерала также были выделены две редкие земли – цериевая и новая.
Новый элемент, обнаруженный в церите и мозандерите, по предложению Берцелиуса назвали лантаном. Название с намеком: оно происходит от греческого λανθανειν – скрываться, забываться. Лантан, содержащийся в церите, успешно скрывался от химиков в течение 36 лет!
Долгое время считали, что лантан двухвалентен, что он – аналог кальция и других щелочноземельных металлов, а его атомный вес равен 90...94. В правильности этих цифр не сомневались до 1869 г. Менделеев же увидел, что во II группе периодической системы редкоземельным элементам нет места и поставил их в III группу, приписав лантану атомный вес 138...139. Но правомерность такого перемещения еще надо было доказать. Менделеев предпринял исследование теплоемкости лантана. Полученная им величина прямо указывала на то, что этот элемент должен быть трехвалентным...
Металлический лантан, разумеется, далеко не чистый, впервые был получен Мозандером при нагревании хлористого лантана с калием.
В наше время в промышленных масштабах получают лантан чистотой более 99%. Проследим, как это делается, но прежде познакомимся с главными минералами лантана и первыми стадиями сложнейшего процесса разделения редкоземельных элементов.
Уже упоминалось, что в минералах лантан и лантаноиды неизменно сопутствуют друг другу. Есть минералы селективные, в которых доля того или иного редкоземельного элемента больше, чем обычно. Но нет минералов чисто лантановых или чисто цериевых, не говоря уже о других лантаноидах. Примером селективного лантанового минерала может служить давидит, в котором до 8,3% La2O3 и лишь 1,3% окиси церия. Но получают лантан преимущественно из монацита и бастнезита, как, впрочем, и церий, и все остальные элементы цериевой подгруппы.
Монацит – тяжелый блестящий минерал, обычно желто-бурый, но иногда и других цветов, поскольку постоянством состава он не отличается. Точнее всего его состав описывает такая странная формула: (РЗЭ)PO4. Она означает, что монацит – фосфат редкоземельных элементов (РЗЭ). Обычно в монаците 50...68% окислов РЗЭ и 22...31,5% P2O5. А еще в нем до 7% двуокиси циркония, 10% (в среднем) двуокиси тория и 0,1...0,3% урана. Эти цифры со всей очевидностью, показывают, почему так тесно переплелись пути редкоземельной и атомной промышленности.
Смешанный металл редких земель – мишметалл – и смесь их окислов начали применять в конце прошлого века, а в начале нынешнего в связи с ними был продемонстрирован выдающийся образец международного воровства. Немецкие суда, доставлявшие грузы в Бразилию, собираясь в обратный путь, заполняли трюмы песком с пляжей Атлантического побережья этой страны, причем из определенных мест. Капитаны заявляли, что песок – это просто балласт, необходимый для большей устойчивости судна. В действительности же они, выполняя заказы германских промышленников, крали ценное минеральное сырье – прибрежные пески штата Эспириту-Санту, богатые монацитом...
Монацитовые россыпи распространены по берегам рек, озер и морей на всех континентах. В начале века (данные за 1909 г.) 92% мировой добычи редкоземельного сырья, и прежде всего монацита, приходилось на долю Бразилии. Спустя десять лет центр тяжести переместился на тысячи километров к востоку (или к западу, смотря как считать) – в Индию. После 1950 г. в связи с развитием атомной промышленности гегемоном среди капиталистических стран в добыче и переработке редкоземельного сырья стали Соединенные Штаты.
Разумеется, нашей стране и другим странам социалистического содружества пришлось развивать свою редкоземельную промышленность, изыскивать свои сырьевые ресурсы.
Проследим же в общих чертах путь от монацитового песка до лантана.
Хотя песок и называют монацитовым, монацита в нем немного – доли процента. К примеру, в известных монацитовых россыпях Айдахо (США) тонна песка содержит лишь 330 г монацита. Поэтому прежде всего получают монацитовый концентрат.
Первая стадия концентрирования происходит уже на драге. Плотность монацита 4,9...5,3, а обычного песка – в среднем 2,7 г/см3. При такой разнице в весе гравитационное разделение не представляет особого труда. Но, кроме монацита, в тех же песках есть другие тяжелые минералы. Поэтому, чтобы получить монацитовый концентрат чистотой 92...96%, применяют комплекс гравитационных, магнитных и электростатических методов обогащения. В результате попутно получают ильменитовый, рутиловый, цирконовый и другие ценные концентраты.
Как и всякий минерал, монацит надо «вскрыть». Чаще всего монацитовый концентрат обрабатывают для этого концентрированной серной кислотой (распространен также щелочной способ вскрытия монацита). Образующиеся сульфаты редкоземельных элементов и тория выщелачивают обычной водой. После того как они перейдут в раствор, в осадке остаются кремнезем и не отделившаяся на предыдущих стадиях часть циркона.
На следующей стадии разделения извлекают короткоживущий мезоторий (радий-228), а затем и сам торий – иногда вместе с церием, иногда отдельно. Отделение церия от лантана и смеси лантаноидов не особенно сложно: в отличие от них, он способен проявлять валентность 4+ и в виде гидроокиси Ce(OH)4 переходить в осадок, тогда как его трехвалентные аналоги остаются в растворе. Отметим только, что операция отделения церия, как, впрочем, и предыдущие, проводится многократно – чтобы как можно полнее «выжать» дорогой редкоземельный концентрат.
После того как выделен церий, в растворе больше всего лантана (в виде нитрата La(NO3)3, так как на одной из промежуточных стадий серная кислота была заменена азотной, чтобы облегчить дальнейшее разделение). Из этого раствора и получают лантан, добавляя аммиак, нитраты аммония и кадмия. В присутствии Cd(NO3)2 разделение более полно. С помощью этих веществ все лантаноиды переходят в осадок, в фильтрате же остаются лишь кадмий и лантан. Кадмий осаждают сероводородом, отделяют осадок, а раствор нитрата лантана еще несколько раз очищают дробной кристаллизацией от примесей лантаноидов.
В конечном счете обычно получают хлорид лантана LaCl3. Электролиз расплавленного хлорида дает лантан чистотой до 99,5%. Еще более чистый лантан (99,79% и выше) получают кальциетермическим способом. Такова классическая традиционная технология.
Как видим, получение элементарного лантана – дело сложное.
Разделение лантаноидов – от празеодима до лютеция – требует еще больших затрат сил и средств, и времени, разумеется. Поэтому в последние десятилетия химики и технологи многих стран мира стремились создать новые, более совершенные методы разделения этих элементов. Такие методы – экстракционные и ионообменные – были созданы и внедрены в промышленность. Уже в начале 60-х годов на установках, работающих по принципу ионного обмена, достигли 95%-го выхода редкоземельных продуктов чистотой до 99,9%.
К 1965 г. внешнеторговые организации нашей страны могли предложить покупателям все лантаноиды в виде металлов чистотой выше 99%. Кроме прометия, разумеется, хотя радиоактивные препараты этого элемента – продукты ядерного распада урана – тоже стали вполне доступны.
В каталоги «Техснабэкспорта» вошли также около 300 химически чистых и особо чистых соединений лантана и лантаноидов. Это свидетельство высокого уровня развития советской редкоземельной промышленности.
Но вернемся к лантану.
Лантан и его команда
Сравнение лантана и лантаноидов со спортивной командой, возможно, кому-то покажется надуманным. Однако это сравнение ничуть не крамольнее таких известных определений, как «семейство лантаноидов» или «химические близнецы». Судите сами: у лантана и его команды единая форма (серебристо-белого цвета) и, как у хоккеистов, у всех есть защитная амуниция (из окисных пленок). Всем им природой отпущено примерно поровну (сходство предельно велико), но, как и в спорте, в силу разных причин «способности» реализуются в не одинаковой мере: одни «играют» лучше, другие хуже... И конечно, у каждого члена этой команды свои излюбленные «финты» и «приемы» – ферромагнитность гадолиния, например.
И по химическим свойствам лантаноиды все-таки не близнецы – иначе не удалось бы их разделить. Как в хорошей спортивной команде, они едины в главном и индивидуальны в частностях. Что же касается числа участников, то в разных играх разное число игроков, 14 – в пределах нормы...
Правда, было время, когда в эту «команду» рекомендовали почти полсотни кандидатов. Число открываемых лантаноподобных элементов росло с катастрофической быстротой. В составленном профессором Н.А. Фигуровским списке ложно открытых элементов больше всего лжелантаноидов. Ошибок не избежали даже крупные ученые – Мозандер, Лекок де Буабодран, Ауэр фон Вельсбах, Крукс, Урбен.
Непериодичность свойств лантана и его команды, выпадающей из строгой последовательности периодической системы, доставляла неприятности Менделееву. Но со временем все разрешилось. Вынести лантаноиды за пределы основной части таблицы первым предложил профессор Пражского университета Богуслав Францевич Браунер.
«Надо быть таким знатоком «редких земель», каков Б.Ф. Браунер, чтобы разобраться в этом сложном, трудном и еще едва ли сколько-либо законченном предмете, в котором проверка затруднена не только своеобразностью и сходственностью многих начальных отношений, но и трудностями в получении самого природного материала», – писал Менделеев в 1902 г.
«Что касается систематики элементов редких земель и их места в периодической системе, то в настоящее время можно с уверенностью считать, что скандий, иттрий и лантан стоят в четных рядах III группы, как это следует из их атомных весов и объема их окисей... Прочие элементы редких земель образуют, вероятно, междупериодическую группу или узел в системе, где они следуют друг за другом по величине атомных весов». Это слова Браунера из статьи «Элементы редких земель», написанной для предпоследнего (1903 г.) прижизненного издания менделеевских «Основ химии».
Распутать «узел в системе» окончательно удалось только после того, как в основу менделеевской таблицы был положен новый, физически более точный критерий – заряд атомного ядра. Тогда стало ясно, что между лантаном и танталом могут поместиться всего 15 элементов, причем последний должен быть аналогом циркония. Этот элемент – гафний – был открыт Костером и Хевоши в 1923 г.
Последний (по атомным номерам) лантаноид, лютеций, был обнаружен раньше – в 1907 г.
Причины общности свойств лантана и лантаноидов естественно искать в строении электронных оболочек их атомов.
По законам квантовой механики электроны могут вращаться вокруг ядер не по любым орбитам. Они как бы распределяются по слоям – оболочкам. Емкость этих оболочек, максимальное число электронов в них, определяется формулой ne = 2N 2, где ne – число электронов, a N – номер оболочки, считая от ядра. Отсюда следует, что на первой оболочке может быть всего два электрона, на второй – восемь, на третьей – восемнадцать, на четвертой – тридцать два и т.д.
Уже в четвертом периоде таблицы Менделеева, начиная со скандия, «очередные» электроны попадают не в наружный четвертый слой, а в предыдущий. Именно поэтому у элементов с атомными номерами от 12 до 30 разница в свойствах не такая резкая, как у более легких элементов. Подобная же картина наблюдается в пятом периоде. И здесь, начиная с иттрия, новые электроны заполняют не пятую, а предпоследнюю, четвертую оболочку – образуется еще один ряд так называемых переходных металлов.
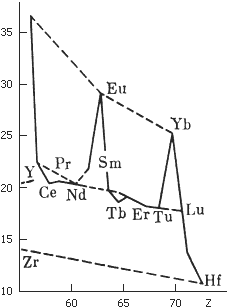
Рисунок – Кривая атомных объемов редкоземельных элементов
На кривой два максимума, образуемых элементами, проявляющими валентность 2+; напротив, элементы, которые могут быть четырехвалентными, имеют минимальные атомные объемы
Перенеся эту аналогию на шестой период, было бы логично предположить, что, начиная с лантана (он аналог скандия и иттрия), и здесь будет происходить то же самое. Электроны, однако, не считаясь с нашей логикой, заполняют здесь не предпоследнюю, а третью снаружи оболочку, благо на ней есть вакансии. Согласно формуле ne = 2N 2, на этой оболочке – четвертой от ядра – может быть 32 электрона. Сюда, за редким исключением, и попадают «новые» электроны очередных лантаноидов. А поскольку химические свойства элемента определяются прежде всего строением наружных электронных оболочек, свойства лантаноидов оказываются еще более близкими, чем свойства переходных металлов.
Как и положено элементам III группы, лантаноиды обычно трехвалентны. Но некоторые из них могут проявлять и другую валентность: церий, празеодим и тербий – 4+; самарий, европий и иттербий – 2+.
Аномальные валентности лантаноидов исследовал и объяснил немецкий химик Вильгельм Клемм. По рентгеновским спектрам он определил основные параметры их кристаллов и атомные объемы. На кривой атомных объемов явно выражены максимумы (европий, иттербий) и менее резко – минимумы (церий, тербий). Празеодим и самарий тоже выпадают, хотя и не так сильно, из ряда, определяемого плавно ниспадающей кривой. Поэтому первый «тяготеет» к малообъемным церию и тербию, а второй – к крупным европию и иттербию. Элементы с большими атомными объемами крепче удерживают электроны, и потому бывают лишь трех- или даже двухвалентными. В «малообъемных» атомах, напротив, один из «внутренних» электронов заключен в оболочке недостаточно прочно – потому атомы церия, празеодима и тербия могут быть четырехвалентными.
В работах Клемма дано и физическое обоснование давно сложившегося разделения редкоземельных элементов на две подгруппы – цериевую и иттриевую. В первую входят лантан и лантаноиды от церия до гадолиния, во вторую – иттрий и лантаноиды от тербия до лютеция. Отличие между элементами двух этих групп – направление спинов у электронов, заполняющих главную для лантаноидов четвертую оболочку.
Когда речь идет о лантаноидах, закономерности тоже порой кажутся алогичными. Пример тому – лантаноидное сжатие.
Лантаноидным сжатием называют открытое норвежским геохимиком Гольдшмидтом закономерное уменьшение размеров трехвалентного иона редкоземельных элементов – от лантана к лютецию. Казалось бы, все должно быть наоборот: в ядре атома церия на один протон больше, чем в ядре атома лантана; ядро празеодима больше, чем ядро церия, и так далее. Соответственно растет и число электронов, вращающихся вокруг ядра. И если представить атом таким, как его обычно рисуют на схемах, – в виде маленького диска, окруженного вытянутыми орбитами невидимых электронов, орбитами разных размеров, то, очевидно, прибыль электронов должна была бы увеличить размеры атома в целом. Или, если отбросить наружные электроны, число которых может быть неодинаковым, такая же закономерность должна наблюдаться в размерах трехвалентных ионов лантана и его команды.
Истинное положение вещей иллюстрирует диаграмма лантаноидного сжатия. Радиус трехвалентного иона лантана равен 1,22 Å, а такого же иона лютеция – всего 0,99 Å. Все не по логике, а как раз наоборот. Однако до физического смысла явления лантаноидного сжатия докопаться нетрудно и без квантовой механики, достаточно лишь вспомнить основные законы электромагнетизма.
Заряд ядра и число электронов вокруг него растут параллельно. Сила притяжения между разноименными зарядами тоже растет; более тяжелое ядро сильнее притягивает электроны, укорачивает их орбиты. А поскольку в атомах лантаноидов наиболее насыщены электронами глубинные орбиты, электрическое притяжение оказывает еще более сильное действие.
Близость ионных радиусов и общность химических свойств – вот главные причины совместного присутствия лантаноидов в минералах.
О минералах редких земель
О главном из них – монаците – рассказано выше. Второй по важности редкоземельный минерал – бастнезит – во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего светло-желтый). Но химически с монацитом его роднит только большое содержание лантана и лантаноидов. Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Ce)FCO3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезите 36,9...40,5% окиси церия и почти столько же (в сумме) окислов лантана, празеодима и неодима. Но, конечно, в нем есть и остальные лантаноиды.
Кроме бастнезита и монацита, практически используют, хотя и ограниченно, еще несколько редкоземельных минералов, в частности гадолинит, в котором бывает до 32% окислов РЗЭ цериевой подгруппы и 22...50% – иттриевой. В некоторых странах редкоземельные металлы извлекают при комплексной переработке лопарита и апатита.
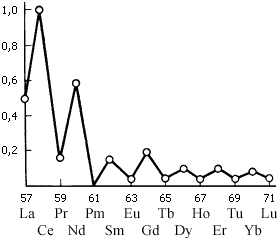
Рисунок – Относительное содержание лантаноидов в земном коре
Закономерность: четные распространены больше нечетных
Всего известно около 70 собственно редкоземельных минералов и еще около 200 минералов, в которые эти элементы входят как примеси. Это свидетельствует о том, что «редкие» земли вовсе не такие уж редкие, а это старинное общее название скандия, иттрия и лантана с лантаноидными – не более чем дань уважения прошлому. Они не редки – церия в земле больше, чем свинца, а самые редкие из редкоземельных распространены в земной коре намного больше, чем ртуть. Все дело в рассеянности этих элементов и сложности отделения их один от другого. Но, конечно, лантаноиды распространены в природе не одинаково. Элементы с четными атомными номерами встречаются значительно чаще, чем их нечетные соседи. Это обстоятельство, естественно, сказывается на масштабах производств и ценах на редкоземельные металлы. Самые труднодоступные лантаноиды – тербий, тулий, лютеций (заметьте, все это лантаноиды с нечетными атомными номерами) – стоят дороже золота и платины. А цена церия более 99%-ной чистоты – всего 55 рублей за килограмм (данные 1970 г.). Для сравнения укажем, что килограмм мишметалла стоит 6...7 рублей, а ферроцерия (10% железа, 90% редкоземельных элементов, в основном церия) – всего пять. Масштабы использования РЗЭ, как правило, пропорциональны ценам...
Реакторный яд
Природный лантан состоит из двух изотопов с массовыми числами 138 и 139, причем первый (его доля всего 0,089%) радиоактивен. Он распадается путем К-захвата с периодом полураспада 3,2·1011 лет. Изотоп лантан-139 стабилен. Между прочим, он образуется в атомных реакторах при распаде урана (6,3% массы всех осколков). Этот изотоп считается реакторным ядом, поскольку он довольно активно захватывает тепловые нейтроны, что характерно и для лантаноидов. Из искусственных изотопов лантана наибольший интерес представляет лантан-140 с периодом полураспада 40,22 часа. Этот изотоп применяют в качестве радиоактивного индикатора при изучении процессов разделения лантана и лантаноидов.
Элементы, следующие за лантаном, называют редкоземельными, или лантанидами, или лантаноидами. Какое из этих названий наиболее оправданно? Термин «редкие земли» появился в XVIII в. Теперь его относят к окислам скандия, иттрия, лантана и его аналогов; первоначально же этот термин имел более широкий смысл. «Землями» вообще называли все тугоплавкие окислы металлов. По отношению к элементам с атомными номерами от 57 до 71 это справедливо: температура плавления La2O3 – около 2600°C. В чистом виде многие из этих «земель» редки и поныне. Но о редкости редкоземельных элементов в земной коре говорить уже не приходится...
Термин «лантаниды» ввели для того, чтобы показать, что следующие четырнадцать элементов идут за лантаном. Но тогда с равным успехом фтор можно назвать кислородидом (или оксидом) – он же следует за кислородом, а хлор – сульфидом... Но в понятия «сульфид», «фосфид», «гидрид», хлорид» и так далее химия издавна вложила другой смысл. Поэтому термин «лантаниды» большинство ученых считают неудачным и пользуются им все реже.
«Лантаноиды» – более оправданно. Окончание «оид» указывает на подобие. «Лантаноиды» – значит «лантаноподобные». Видимо, этим термином и следует пользоваться для обозначения 14 элементов – аналогов лантана.
Маскируясь под крахмал
Одно из соединений лантана – его основной ацетат – ведет себя как крахмал, если к нему добавляют иод. Белый гель принимает ярко-синюю окраску. Этим свойством аналитики иногда пользуются для открытия лантана в смесях и растворах.
Двухвалентен лишь формально
Установлено, что во всех соединениях лантан проявляет одну и ту же валентность – 3+. Но как тогда объяснить существование серо-черного дигидрида LaH2 и желтого сульфида LaS? Установлено, что LaH2 – это относительно устойчивый полупродукт реакции образования LaH3 и что в обоих гидридах лантан трехвалентен. В молекуле дигидрида есть металлическая связь La – La. С сульфидом все объясняется еще проще. Это вещество обладает высокой электропроводностью, что заставляет полагать наличие в нем ионов La3+ и свободных электронов. Кстати, LaH2 тоже хорошо проводит ток, в то время как LaH3 – полупроводник.
Примеры решения задач
ПРИМЕР 1
| Задание | Осуществите ряд химических превращений: La→La(OH)3→ La2O3→ LaCl3. |
| Ответ | При растворении лантана в горячей воде образуется гидроксид этого метала: 2La + 6H2O(hot)→ 2La(OH)3 + 3Н2. При нагревании до 300 – 1100oС гидроксид лантана разлагается на оксид и воду: La(OH)3→La2O3 + H2O. Оксид лантана растворяется в разбавленной соляной кислоте с образованием хлорида лантана: La2O3 + 6HCl(dilute)→ 2LaCl3 + 3H2O. |
ПРИМЕР 2
| Задание | Рассчитайте массовые доли элементов, входящих в состав оксида лантана (III), если его молекулярная формула имеет вид La2O3. |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: ω (Х) = n × Ar (X) / Mr (HX) × 100%. Найдем молекулярную массу оксида лантана (III): Mr(La2O3) = 2×Ar(La) + 3×Ar(O) = 2×139 + 3×16 = 278 + 48 = 326 г. Тогда, массовые доли лантана и кислорода будут равны: ω (La) = 2 × Ar (La) / Mr (La2O3) × 100%; ω (м) = 2 × 139 / 326 × 100% = 85,28%. ω (O) = 3 × Ar (O) / Mr (La2O3) × 100%; ω (O) = 3 × 16 / 326 × 100% = 14,72%. |
| Ответ | Массовая доля лантана равна 85,28%, массовая доля кислорода равна 14,72%. |
Физические свойства
Лантаноиды в виде простых веществ – серебристо-белые металлы (празеодим и неодим слегка желтоватого цвета), тускнеющие во влажном воздухе.
Соединения некоторых лантаноидов имеют окраску:

Соединения лантана, гадолиния, лютеция бесцветные.
Металлы подсемейства церия пластичны, сравнительно мягки, причём их твёрдость возрастает с увеличением атомного номера, за исключением иттербия, который имеет аномально высокую проводимость; она в 3 раза больше, чем у других лантаноидов, которые по этому параметру приближаются к ртути. Все лантаноиды – парамагнетики, но лютеций обладает слабой магнитной восприимчивостью, а европий, гадолиний, диспрозий и эрбий при температуре ниже комнатной обладают ферромагнетизмом. Только гадолиний имеет наивысшую точку Кюри (16°С). Интересными магнитными свойствами обладает диспрозий, который в зависимости от температуры проявляет свойства парамагнетика, ферромагнетика и антиферромагнетика.
Наиболее тугоплавкими являются тулий и лютеций. В характере изменения Тпл лантаноидов чётко проявляется внутренняя периодичность. Минимальными Тпл обладают европий и иттербий, у которых имеются устойчивые 4f75d06s2 и 4f145d06s2 электронные конфигурации. Легкоплавкие лантан, церий и празеодим характеризуются высокими Ткип, то есть являются трудноиспаряемыми. Европий и иттербий в ряду лантаноидов имеют самые низкие Ткип – наиболее летучи. Гадолиний отличается от других лантаноидов наибольшим электрическим сопротивлением и теплопроводностью. Лист металлического гадолиния в несколько сантиметров обладает такой же надёжностью, что и многометровая толща бетона или воды. Электропроводность иттербия в 3 раза больше, чем у остальных лантаноидов.
Все лантаноиды – довольно тяжёлые металлы.
Европий – самый лёгкий из лантаноидов, его плотность равна 5,245 г/см3. У него же наибольшие из всех лантаноидов атомные радиус и объём. С этими «аномалиями» свойств европия некоторые исследователи связывают тот факт, что из всех лантаноидов европий – наиболее устойчив к корродирующему действию влажного воздуха и воды.
А вот у гадолиния максимальное по сравнению со всеми другими лантаноидами удельное электрическое сопротивление – примерно вдвое больше, чем у его аналогов. И удельная теплоёмкость этого элемента на 20% превышает удельную теплоёмкость лантана и церия. Наконец, магнитные свойства ставят гадолиний в один ряд с железом, кобальтом и никелем. В обычных условиях, когда лантан и остальные лантаноиды парамагнитны, гадолиний – ферромагнетик, причём даже более сильный, чем никель и кобальт.
Химические свойства
Ограниченная возможность возбуждения 4f-электронов определяет сходство химических свойств лантаноидов в одинаковых степенях окисления. Основные изменения в свойствах лантаноидов являются следствием f-сжатия, то есть уменьшения эффективных радиусов атомов и ионов с увеличением порядкового номера.
В свободном состоянии лантаноиды – весьма активные металлы. В ряду напряжений они находятся значительно левее водорода (электродные потенциалы лантаноидов составляют около –2,4 В). Поэтому все лантаноиды взаимодействуют с водой с выделением водорода:
|
Соединения лантаноидов со степенью окисления IV проявляют окислительные свойства (Ce, Tb):
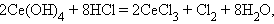
|
а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой:
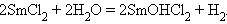
|
Лантаноиды химически активны, они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, азотом, фосфором. Разлагают воду, растворяются в соляной, серной и азотной кислотах. В плавиковой и фосфорной кислотах лантаноиды устойчивы, так как покрываются защитными пленками малорастворимых солей – фторидов и фосфатов.
При нагревании они реагируют с водородом, углеродом, азотом, фосфором, углеводородами, оксидами углерода II и IV; разлагают воду, растворяются в соляной, серной и азотной кислотах; выше 180-200°С Лантаноиды быстро окисляются на воздухе.
Т.о., Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200-400°С с образованием Э2O3, а в атмосфере азота при 750-1000°С образуют нитриды.
Церий в порошкообразном состоянии легко воспламеняется на воздухе, поэтому его используют при изготовлении кремней для зажигалок.
Лантаноиды взаимодействуют с галогенами, серой, углеродом, кремнием и фосфором. Химическая активность элементов в ряду Ce – Lu несколько уменьшается из-за уменьшения их радиусов.
С водородом лантаноиды образуют солеобразные гидриды ЭH2 и ЭH3, которые по свойствам более близки к гидридам щелочно-земельных металлов, чем к гидридам d-элементов.
С кислородом все лантаноиды образуют оксиды типа Э2O3, являющиеся химически и термически устойчивыми; так, La2O3 плавится при температуре 2000°С, а CeO2 – около 2500 °С. Самарий, европий и иттербий, кроме оксидов Э2O3, образуют также монооксиды EuO, SmO, YbO. Церий легко образует оксид CeO2. Оксиды лантаноидов в воде нерастворимы, но энергично ее присоединяют с образованием гидроксидов:
|
Гидроксиды лантаноидов по силе уступают лишь гидроксидам щелочно-земельных металлов. Лантаноидное сжатие приводит к уменьшению ионности связи Э–ОН и уменьшению основности в ряду Ce(OH)3 – Lu(OH)3.
Лантаноиды используют в металлургии для легирования сталей, что повышает прочность, жаростойкость и коррозийную устойчивость последних. Такие стали применяют для изготовления деталей сверхзвуковых самолетов и оболочек искусственных спутников Земли.
Добавление оксида лантана в стекла повышает их показатель преломления (так называемая лантаноидная оптика). Радиационно-оптическую устойчивость стекол повышает CeO2. Стекла с неодимом используются в оптических квантовых генераторах. Оксиды гадолиния, самария и европия входят в состав защитных керамических покрытий от тепловых нейтронов в ядерных реакторах. Соединения лантаноидов используются в качестве катализаторов. Способность их соединяться с атмосферными газами используется для создания высокого вакуума.
С рядом органических соединений лантаноиды образуют комплексные соединения. Важное значение для разделения лантаноидов имеют комплексы с лимонной и этилендиаминтетрауксусной кислотой (ЭДТА).
Элемент
Отличия актиноидов и лантаноидов объясняются тем, что у актиноидов энергетические уровни 5f и 6d стабилизируются по мере возрастания атомного ядра несколько иным способом, чем у лантаноидов: у легких актиноидов более устойчивы 6d-орбитали, а у тяжелых – 5f.
Для элементов с атомными номерами 90-95 энергия 5f- и 6d-подуровней примерно одинакова. Последнее затрудняет однозначное определение электронной конфигурации элемента. Так для Np одинаково возможны и 5f46d17s2, и 5f56d07s2электронные состояния.
Этим объясняются различия в химии актиноидов и лантаноидов.
У элементов с атомными номерами 91-95 (Th – Am) электронные переходы происходят легко. Эти элементы поливалентны и в этом подобны d-элементам. Более того, для них степень окисления III вообще мало характерна. Получен семивалентный нептуний, уран легко может быть переведен в шестивалентное состояние, протактиний проявляет степень окисления пять, а для тория сложно получить соединения, в которых он имел бы степень окисления меньше четырех.
Но в процессе заполнения 5f-уровней электронные конфигурации атомов стабилизируются, переход 5f-электронов в 6d-состояние становится более и более затрудненным. Поэтому элементы Bk – Lr, ведут себя как типичные f-элементы, а по свойствам близки к лантаноидам. Для них основной степенью окисления является III.
МЕТОДЫ РАЗДЕЛЕНИЯ РЗЭ
Вследствие близости свойств лантаноидов их разделение – сложная задача. Применявшиеся ранее способы разделения были основаны главным образом на различии в растворимости соединений лантаноидов. В результате большого числа дробных кристаллизаций или дробных осаждений (иногда достигавших нескольких тысяч) получали отдельные элементы большей или меньшей степени чистоты.
Для отделения некоторых элементов использовали способность их окисляться до четырехвалентного состояния (Се, Pr, Tb) или восстанавливаться до двухвалентного состояния (Sm, Eu, Yb). В этом случае разделение облегчается благодаря значительным отличиям в свойствах соединений лантаноидов со степенью окисления +4 и +2 и соединений лантаноидов со степенью окисления +3. По этому признаку легче всего разделить элементы цериевой группы. Сначала выделяют элементы, присутствующие в преобладающем количестве: Се, La, Y.
Современные схемы разделения лантаноидов основаны на использовании более эффективных методов: жидкостной экстракции и ионного обмена. Старые «классические» методы дробного осаждения и кристаллизации практически не используют в настоящее время.
Дробная кристаллизация
Метод основан на различной растворимости простых или двойных соединений РЗЭ и различии в температурных коэффициентах растворимости. Наиболее эффективна кристаллизация в виде двойных нитратов: 2Ln(NO3)3 ∙ 2Mg(NO3)2 ∙ 24H2O. Кроме двойных нитратов также используются двойные сульфаты и броматы.
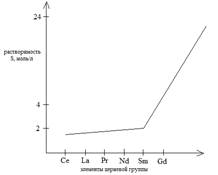
Легкие РЗЭ кристаллизуются из раствора, а тяжелые остаются в маточном растворе.
Дробное осаждение
Основано на различной растворимости соединений в растворе. Основным недостатком процесса является образование местных пересыщений в момент добавления осадителя. Для предотвращения этого вводят добавки, селективно (т.е. избирательно) повышающие растворимость.
· Наиболее эффективно осаждение гидроксидов. рН осаждения гидроксидов возрастает от Lu к La (от 6 до 8).
Недостатки метода: необходимость работать с разбавленными растворами, плохая фильтруемость осадков, высокая адсорбционная способность осадков.
· Часто в технологии используют двойные сульфаты (они имеют отрицательный температурный коэффициент). В насыщенных растворах сульфатов щелочных металлов наименьшей растворимостью обладают сульфаты элементов цериевой группы от La до Sm; плохо, но несколько лучше растворимы сульфаты от Eu до Tb. Элементы иттриевой группы от Dy до Lu, иттрий обладают наибольшей растворимостью.
Ln2(SO4)3 + Na2SO4 + 2H2O  Ln2(SO4)3 ∙ Na2SO4 + 2H2O.
Ln2(SO4)3 ∙ Na2SO4 + 2H2O.
Вследствие изоморфизма (схожести по свойствам) многие элементы иттриевой подгруппы осаждаются совместно с элементами цериевой подгруппы, и для уменьшения этого явления используют разбавленные растворы (поэтому в формуле присутствует вода).
Осадитель добавляют до полного выделения Nd (La, Ce, Pr остаются в растворе). Осадок отделяют, оставшийся раствор нагревают – в осадок выпадает средняя фракция лантаноидов (в растворе остаются элементы иттриевой группы). Остаток сульфатов цериевой группы обрабатывают раствором щелочи. Образовавшуюся пульпу гидрокисдов разбавляют, затем добавляют азотную кислоту:
2Ln(ОН)3 + 4Na2SO4 + 2H2O 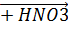 Ln2(SO4)3 ∙ Na2SO4 + 2NaNO3 + H2O.
Ln2(SO4)3 ∙ Na2SO4 + 2NaNO3 + H2O.
Эти операции повторяют 5-10 раз и таким образом разделяют иттриевую и цериевую группы.
· Кроме того, возможно осаждение оксалатов Ln2(C2O4)3. Метод основан на уменьшении растворимости от La к Lu. Оксалаты осаждают в присутсвии комплексообразователей, например, трилона Б для большего различия в рН начала осаждения.
Процесс проводят следующим образом:
Ln2O3 + HNO3 → Ln(NO3)3
Ln(NO3)3 + (NH4)2C2O4 → Ln2(C2O4)3↓ + NH4 NO3
Затем осадок растворяют в трилоне Б, образуется комплекс Na3[Ln(N(CH2COO)3)2]. При подкислении выпадает практически чистый оксалат лантана.
Ионообменная хроматография
В настоящее время жидкостная экстракция – основной способ разделения РЗЭ. Ионообменная хроматография – дополнительный метод, используемый для получения индивидуальных РЗМ высокой степени чистоты, преимущественно тяжелых.
Метод основан на сорбции сорбционных элементов смолой с последующим дифференцированным вытеснением индивидуальных ионов вымыванием раствором – десорбентом.
Для разделения лантаноидов методом ионообменной хроматографии применяют различные типы катионитовых смол (в СССР катионит марки КУ-2). Они представляют собой сильно кислотные катиониты, получаемые совместной полимеризацией стирола и дивинилбензола и содержат активные группы – SО3H. Разделение осуществляют большей частью методом элюентной хроматографии.
Сродство ионов лантаноидов к смоле убывает от La3+ к Lu3+, т. е. в порядке уменьшения размера гидра тированных ионов. Однако сродство к смоле ионов РЗЭ очень близко, что не обеспечивает достаточно эффективного разделения. Лучшее разделение достигается при использовании элюирующих растворов, содержащих органические соединения, образующие с ионами РЗЭ комплексы различной устойчивости.
Вымывание происходит в последовательности, соответствующей прочности анионных комплексов лантаноидов. По мере движения вымывающего раствора вдоль колонки (или ряда последовательно соединенных колонок) смесь катионов разделяется на отдельные сорбционные зоны (полосы), перемещающиеся с определенной скоростью к выходу колонки. Ионы, образующие более прочные комплексы, вымываются бытрее.
Кривые вымывания будут иметь вид:

Для вымывания применяют различные органические соединения, образующие комплексы с лантаноидами: лимонную кислоту, нитрилотриуксусную кислоту (НТА) и этилендиаминтетрауксусную кислоту (ЭДТА). Последнюю наиболее широко применяют при хроматографическом разделении РЗЭ. ЭДТА относится к классу α-аминокислот. Она представляет собой четырехосновную кислоту с двумя атомами азота. Двунатриевая соль этой кислоты имеет техническое название «трилон Б».
С трехзарядными ионами лантаноидов ЭДТА образует внутрикомплексные соединения (хелаты), в которых атомы азота связаны с ионом лантаноида координационными связями.
Константы устойчивости у комплексов лантаноидов с ЭДТА увеличиваются от лантана к лютецию, т.е. с возрастанием порядкового номера элемента. Константы устойчивости комплексов двух соседних РЗЭ отличаются одна от другой в среднем в 2,4 раза. Это обусловливает большую избирательность действия ЭДТА при ее применении для элюирования катионов РЗЭ со смолы.
РЗЭ разделяют в системе, состоящей из ряда последовательно соединенных колонок, заполненных смолой. Первые одна или две колонки служат для насыщения смолы катионами РЗЭ, последующие колонки – разделительные. В процессе элюирования в них образуются сорбционные полосы.
Существенную роль при разделении играет рН раствора, т.к. прочность комплексов уменьшается с увеличением кислотности. Обычно при высоких значениях рН разделяют легкие РЗЭ, при низких – тяжелые. Процесс вымывания сорбированных ионов называется элюированием, десорбирующие растворы называются элюантами (ЭДТА, NTA).
Обычно работают с вымывающим раствором (элюатом), значение рН которого доводят до 3,5-8,5 (низкие рН при разделении легких РЗЭ, более высокие – для тяжелых РЗЭ) нейтрализацией гидроксидом аммония.
На выходе из системы колонок фильтрат собирают отдельными фракциями. Для регенерации ЭДТА растворы подкисляют до рН = 0,5-1. При этом комплексные соединения лантаноидов разрушаются и осаждается малорастворимая ЭДТА.
Если начальная удельная загрузка (отношение массы сорбированной на смоле смеси разделяемых ионов к общей массе смолы) небольшая (ниже 5% массы смолы), а общая длина колонок для разделения достаточно велика, то выходящие из колонки фракции фильтрата содержат только один из разделяемых лантаноидов.
Экстракционное разделение
В настоящее время экстракционные методы стали основными в схемах разделения РЗЭ. В промышленной практике для разделения преимущественно используют фосфорорганические экстрагенты – ТБФ, Д2ЭГФК и карбоновые кислоты. Разделение основано на закономерном изменении значений коэффициентов распределения в ряду лантаноидов.
В промышленной практике разделение РЗЭ экстракцией ТБФ большей частью осуществляют из азотнокислых растворов, содержащих нитраты РЗЭ. Экстракция протекает с образованием трисольвата.
Значение коэффициента распределения в системе ТБФ – HNO3 при высоких концентрациях HNО3 (11-15 моль/л) непрерывно возрастают с увеличением атомного номера лантаноида. Однако в растворах с концентрацией HNО3 ниже 5 моль/л происходит инверсия (обращение) закономерности изменения коэффициентов распределения для ряда европий – лютеций. Это объясняется проявляющимся при низкой кислотности возрастанием энергии гидратации в ряду тяжелых РЗЭ, что затрудняет вытеснение молекул воды из гидратной оболочки иона молекулами ТБФ.
При высокой кислотности (более 12 моль/л) средняя величина коэффициента разделения для соседних элементов от лантана до тербия = 1,9; для элементов от тербия до лютеция эта величина ниже. Поэтому для всей группы РЗЭ можно принять = 1,5. Для легких РЗЭ (La, Ce(III), Рг, Nd, Pm) кэффициенты распределения мало изменяются при увеличении концентрации их в растворах от 5-10 до 70-100 г/л: для средних PЗЭ (Sm, Eu, Gd) и тяжелых элементов (иттриевая группа) коэффициенты распределения существенно зависят от концентрации РЗЭ в водной фазе.
РЗЭ хорошо экстрагируется ТБФ также из слабокислых нитратных растворов в присутствии высаливателей – нитратов алюминия, натрия, кальция, лития.
При использовании экстракции ТБФ для разделения РЗЭ на подгруппы процесс ведут из нитратных растворов с концентрацией HNО3 7-10 моль/л. При этом иттрий попадает в подгруппу тяжелых РЗЭ (Dy - Lu).
В практике разделения РЗЭ экстракций процесс большей частью проводят в каскаде экстракторов типа смеситель-отстойник.
РАЗДЕЛ 3 Редкие и рассеянные элементы III группы Периодической системы элементов Д.И. Менделеева
Дата: 2019-02-02, просмотров: 1097.