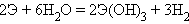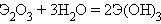Лантаноиды (РЗЭ), особенности электронных конфигураций и свойств металлов. Технология лантаноидов (РЗЭ)
Лантаноиды (лантаниды) Ln – это 15 элементов (элементов III группы 6-го периода периодической таблицы – металлов, с атомными номерами 57-71 (от лантана до лютеция), у которых к электронной конфигурации лантана последовательно добавляются 14 4f-электронов. Единственным представителем группы, у которого отсутствуют стабильные изотопы, является прометий.
У лантаноидов есть и другое название – редкоземельные элементы (РЗЭ). Действительно, это рассеянные элементы, встречающиеся в природе совместно, но редко образующие значительные рудные залежи.
В таблице ниже приведены электронные конфигурации лантаноидов и их наиболее устойчивые степени окисления. Общая электронная конфигурация лантаноидов –
4f2–14 5d0–1 6s2.
Таблица 1 – Электронные конфигурации и степени окисления 4f-элементов (лантаноидов)
| Элемент | Электронная конфигурация | Степень окисления | Элемент | Электронная конфигурация | Степень окисления | ||
| Церий | Ce | 4f26s2 | 3, 4 | Тербий | Tb | 4f96s2 | 3, 4 |
| Празеодим | Pr | 4f36s2 | 3, 4 | Диспрозий | Dy | 4f106s2 | 3, 4 |
| Неодим | Nd | 4f46s2 | 3 | Гольмий | Ho | 4f116s2 | 3 |
| Прометий | Pm | 4f56s2 | 3 | Эрбий | Er | 4f126s2 | 3 |
| Самарий | Sm | 4f66s2 | 2, 3 | Тулий | Tm | 4f136s2 | 2, 3 |
| Европий | Eu | 4f76s2 | 2, 3 | Иттербий | Yb | 4f146s2 | 2, 3 |
| Гадолиний | Gd | 4f75d16s2 | 3 | Лютеций | Lu | 4f145d16s2 | 3 |
У церия на 4f-уровне находятся два электрона – один за счет увеличения порядкового номера по сравнению с лантаном на единицу, а другой переходит с 5d-уровня на 4f. До гадолиния происходит последовательное увеличение числа электронов на 4f-уровне, а уровень 5d остается незанятым. У гадолиния дополнительный электрон занимает 5d-уровень, давая электронную конфигурацию 4f75d16s2, а у следующего за гадолинием тербия происходит, аналогично церию, переход 5d-электрона на 4f-уровень (4f96s2). Далее до иттербия наблюдается монотонное увеличение числа электронов до 4f14, а у завершающего ряд лютеция вновь появляется 5d-электрон (4f145d16s2).
Периодический характер заполнения 4f-орбиталей сначала по одному, а потом по два электрона предопределяет внутреннюю периодичность свойств лантаноидов. Периодически изменяются металлические радиусы, степени окисления, температуры плавления и кипения, величины магнитных моментов, окраска и другие свойства. Участие 4f-электронов в образовании химической связи обусловлено предварительным возбуждением на уровень 5d. Энергия возбуждения одного электрона невелика, поэтому обычно лантаноиды проявляют степень окисления 3. Однако некоторые из них проявляют так называемые аномальные степени окисления – 2, 4. Эти состояния окисления связывают с образованием наиболее устойчивых электронных конфигураций 4f0, 4f7, 4f14. Так, Ce и Tb приобретают конфигурации f0 и f7, переходя в состояние окисления +4, тогда как Eu и Yb имеют соответственно конфигурации – f7 и f14 в состоянии окисления +2. Однако существование Pr(IV), Sm(II), Dy(IV) и Tm(II) свидетельствует об относительности критерия особой устойчивости электронных конфигураций 4f0, 4f7 и 4f14. Как и для d-элементов, стабильность состояния окисления наряду с этим фактором характеризуется термодинамическими параметрами реального соединения.
Физические свойства
Лантаноиды в виде простых веществ – серебристо-белые металлы (празеодим и неодим слегка желтоватого цвета), тускнеющие во влажном воздухе.
Соединения некоторых лантаноидов имеют окраску:

Соединения лантана, гадолиния, лютеция бесцветные.
Металлы подсемейства церия пластичны, сравнительно мягки, причём их твёрдость возрастает с увеличением атомного номера, за исключением иттербия, который имеет аномально высокую проводимость; она в 3 раза больше, чем у других лантаноидов, которые по этому параметру приближаются к ртути. Все лантаноиды – парамагнетики, но лютеций обладает слабой магнитной восприимчивостью, а европий, гадолиний, диспрозий и эрбий при температуре ниже комнатной обладают ферромагнетизмом. Только гадолиний имеет наивысшую точку Кюри (16°С). Интересными магнитными свойствами обладает диспрозий, который в зависимости от температуры проявляет свойства парамагнетика, ферромагнетика и антиферромагнетика.
Наиболее тугоплавкими являются тулий и лютеций. В характере изменения Тпл лантаноидов чётко проявляется внутренняя периодичность. Минимальными Тпл обладают европий и иттербий, у которых имеются устойчивые 4f75d06s2 и 4f145d06s2 электронные конфигурации. Легкоплавкие лантан, церий и празеодим характеризуются высокими Ткип, то есть являются трудноиспаряемыми. Европий и иттербий в ряду лантаноидов имеют самые низкие Ткип – наиболее летучи. Гадолиний отличается от других лантаноидов наибольшим электрическим сопротивлением и теплопроводностью. Лист металлического гадолиния в несколько сантиметров обладает такой же надёжностью, что и многометровая толща бетона или воды. Электропроводность иттербия в 3 раза больше, чем у остальных лантаноидов.
Все лантаноиды – довольно тяжёлые металлы.
Европий – самый лёгкий из лантаноидов, его плотность равна 5,245 г/см3. У него же наибольшие из всех лантаноидов атомные радиус и объём. С этими «аномалиями» свойств европия некоторые исследователи связывают тот факт, что из всех лантаноидов европий – наиболее устойчив к корродирующему действию влажного воздуха и воды.
А вот у гадолиния максимальное по сравнению со всеми другими лантаноидами удельное электрическое сопротивление – примерно вдвое больше, чем у его аналогов. И удельная теплоёмкость этого элемента на 20% превышает удельную теплоёмкость лантана и церия. Наконец, магнитные свойства ставят гадолиний в один ряд с железом, кобальтом и никелем. В обычных условиях, когда лантан и остальные лантаноиды парамагнитны, гадолиний – ферромагнетик, причём даже более сильный, чем никель и кобальт.
Химические свойства
Ограниченная возможность возбуждения 4f-электронов определяет сходство химических свойств лантаноидов в одинаковых степенях окисления. Основные изменения в свойствах лантаноидов являются следствием f-сжатия, то есть уменьшения эффективных радиусов атомов и ионов с увеличением порядкового номера.
В свободном состоянии лантаноиды – весьма активные металлы. В ряду напряжений они находятся значительно левее водорода (электродные потенциалы лантаноидов составляют около –2,4 В). Поэтому все лантаноиды взаимодействуют с водой с выделением водорода:
|
Соединения лантаноидов со степенью окисления IV проявляют окислительные свойства (Ce, Tb):
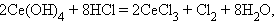
|
а соединения со степенью окисления II (Eu, Sm, Yb) – восстановительные, причем окисляются даже водой:
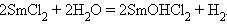
|
Лантаноиды химически активны, они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, азотом, фосфором. Разлагают воду, растворяются в соляной, серной и азотной кислотах. В плавиковой и фосфорной кислотах лантаноиды устойчивы, так как покрываются защитными пленками малорастворимых солей – фторидов и фосфатов.
При нагревании они реагируют с водородом, углеродом, азотом, фосфором, углеводородами, оксидами углерода II и IV; разлагают воду, растворяются в соляной, серной и азотной кислотах; выше 180-200°С Лантаноиды быстро окисляются на воздухе.
Т.о., Лантаноиды очень реакционноспособны и легко взаимодействуют со многими элементами периодической системы: в кислороде сгорают при 200-400°С с образованием Э2O3, а в атмосфере азота при 750-1000°С образуют нитриды.
Церий в порошкообразном состоянии легко воспламеняется на воздухе, поэтому его используют при изготовлении кремней для зажигалок.
Лантаноиды взаимодействуют с галогенами, серой, углеродом, кремнием и фосфором. Химическая активность элементов в ряду Ce – Lu несколько уменьшается из-за уменьшения их радиусов.
С водородом лантаноиды образуют солеобразные гидриды ЭH2 и ЭH3, которые по свойствам более близки к гидридам щелочно-земельных металлов, чем к гидридам d-элементов.
С кислородом все лантаноиды образуют оксиды типа Э2O3, являющиеся химически и термически устойчивыми; так, La2O3 плавится при температуре 2000°С, а CeO2 – около 2500 °С. Самарий, европий и иттербий, кроме оксидов Э2O3, образуют также монооксиды EuO, SmO, YbO. Церий легко образует оксид CeO2. Оксиды лантаноидов в воде нерастворимы, но энергично ее присоединяют с образованием гидроксидов:
|
Гидроксиды лантаноидов по силе уступают лишь гидроксидам щелочно-земельных металлов. Лантаноидное сжатие приводит к уменьшению ионности связи Э–ОН и уменьшению основности в ряду Ce(OH)3 – Lu(OH)3.
Лантаноиды используют в металлургии для легирования сталей, что повышает прочность, жаростойкость и коррозийную устойчивость последних. Такие стали применяют для изготовления деталей сверхзвуковых самолетов и оболочек искусственных спутников Земли.
Добавление оксида лантана в стекла повышает их показатель преломления (так называемая лантаноидная оптика). Радиационно-оптическую устойчивость стекол повышает CeO2. Стекла с неодимом используются в оптических квантовых генераторах. Оксиды гадолиния, самария и европия входят в состав защитных керамических покрытий от тепловых нейтронов в ядерных реакторах. Соединения лантаноидов используются в качестве катализаторов. Способность их соединяться с атмосферными газами используется для создания высокого вакуума.
С рядом органических соединений лантаноиды образуют комплексные соединения. Важное значение для разделения лантаноидов имеют комплексы с лимонной и этилендиаминтетрауксусной кислотой (ЭДТА).
Дата: 2019-02-02, просмотров: 825.