В качестве легирующего металла чистый лантан почти не применяют, используя для этого более дешевый и доступный церий или мишметалл, – легирующее действие лантана и лантаноидов практически одинаково.
Выше упоминалось, что иногда лантан из смеси извлекают методом экстракции, используя разную растворимость некоторых (в основном комплексных) соединений редкоземельных элементов в органических растворителях. Но бывает, что в качестве экстрагента используют сам элемент №57. Расплавленным лантаном экстрагируют плутоний из жидкого урана. Здесь еще одна точка соприкосновения атомной и редкоземельной промышленности.
Намного шире используют окись лантана La2O3. Этот белый аморфный порошок, нерастворимый в воде, но растворимый в кислотах, стал важным компонентом оптических стекол. Фотообъективы знаменитой фирмы «Кодак» содержат от 20 до 40% La2O3. Благодаря добавкам лантана удалось уменьшить размеры объектива при той же светосиле, намного улучшить качество цветной съемки. Известно, что во время второй мировой войны лантановые стекла применяли в полевых оптических приборах. Лучшие отечественные фотообъективы, например «Индустар-61ЛЗ», тоже сделаны из лантанового стекла, а одна из лучших наших любительских кинокамер так и называется «Лантан»... В последнее время лантановое стекло идет также на изготовление лабораторной посуды. Окись лантана придает стеклу не только ценные оптические свойства, но и большую термостойкость и кислотоупорность.
Вот, пожалуй, все главное, что можно рассказать о лантане без лантаноидов, хотя от принципа «без» кое-где нельзя было не отступить...
Лантан и его команда
Сравнение лантана и лантаноидов со спортивной командой, возможно, кому-то покажется надуманным. Однако это сравнение ничуть не крамольнее таких известных определений, как «семейство лантаноидов» или «химические близнецы». Судите сами: у лантана и его команды единая форма (серебристо-белого цвета) и, как у хоккеистов, у всех есть защитная амуниция (из окисных пленок). Всем им природой отпущено примерно поровну (сходство предельно велико), но, как и в спорте, в силу разных причин «способности» реализуются в не одинаковой мере: одни «играют» лучше, другие хуже... И конечно, у каждого члена этой команды свои излюбленные «финты» и «приемы» – ферромагнитность гадолиния, например.
И по химическим свойствам лантаноиды все-таки не близнецы – иначе не удалось бы их разделить. Как в хорошей спортивной команде, они едины в главном и индивидуальны в частностях. Что же касается числа участников, то в разных играх разное число игроков, 14 – в пределах нормы...
Правда, было время, когда в эту «команду» рекомендовали почти полсотни кандидатов. Число открываемых лантаноподобных элементов росло с катастрофической быстротой. В составленном профессором Н.А. Фигуровским списке ложно открытых элементов больше всего лжелантаноидов. Ошибок не избежали даже крупные ученые – Мозандер, Лекок де Буабодран, Ауэр фон Вельсбах, Крукс, Урбен.
Непериодичность свойств лантана и его команды, выпадающей из строгой последовательности периодической системы, доставляла неприятности Менделееву. Но со временем все разрешилось. Вынести лантаноиды за пределы основной части таблицы первым предложил профессор Пражского университета Богуслав Францевич Браунер.
«Надо быть таким знатоком «редких земель», каков Б.Ф. Браунер, чтобы разобраться в этом сложном, трудном и еще едва ли сколько-либо законченном предмете, в котором проверка затруднена не только своеобразностью и сходственностью многих начальных отношений, но и трудностями в получении самого природного материала», – писал Менделеев в 1902 г.
«Что касается систематики элементов редких земель и их места в периодической системе, то в настоящее время можно с уверенностью считать, что скандий, иттрий и лантан стоят в четных рядах III группы, как это следует из их атомных весов и объема их окисей... Прочие элементы редких земель образуют, вероятно, междупериодическую группу или узел в системе, где они следуют друг за другом по величине атомных весов». Это слова Браунера из статьи «Элементы редких земель», написанной для предпоследнего (1903 г.) прижизненного издания менделеевских «Основ химии».
Распутать «узел в системе» окончательно удалось только после того, как в основу менделеевской таблицы был положен новый, физически более точный критерий – заряд атомного ядра. Тогда стало ясно, что между лантаном и танталом могут поместиться всего 15 элементов, причем последний должен быть аналогом циркония. Этот элемент – гафний – был открыт Костером и Хевоши в 1923 г.
Последний (по атомным номерам) лантаноид, лютеций, был обнаружен раньше – в 1907 г.
Причины общности свойств лантана и лантаноидов естественно искать в строении электронных оболочек их атомов.
По законам квантовой механики электроны могут вращаться вокруг ядер не по любым орбитам. Они как бы распределяются по слоям – оболочкам. Емкость этих оболочек, максимальное число электронов в них, определяется формулой ne = 2N 2, где ne – число электронов, a N – номер оболочки, считая от ядра. Отсюда следует, что на первой оболочке может быть всего два электрона, на второй – восемь, на третьей – восемнадцать, на четвертой – тридцать два и т.д.
Уже в четвертом периоде таблицы Менделеева, начиная со скандия, «очередные» электроны попадают не в наружный четвертый слой, а в предыдущий. Именно поэтому у элементов с атомными номерами от 12 до 30 разница в свойствах не такая резкая, как у более легких элементов. Подобная же картина наблюдается в пятом периоде. И здесь, начиная с иттрия, новые электроны заполняют не пятую, а предпоследнюю, четвертую оболочку – образуется еще один ряд так называемых переходных металлов.
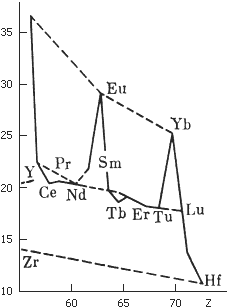
Рисунок – Кривая атомных объемов редкоземельных элементов
На кривой два максимума, образуемых элементами, проявляющими валентность 2+; напротив, элементы, которые могут быть четырехвалентными, имеют минимальные атомные объемы
Перенеся эту аналогию на шестой период, было бы логично предположить, что, начиная с лантана (он аналог скандия и иттрия), и здесь будет происходить то же самое. Электроны, однако, не считаясь с нашей логикой, заполняют здесь не предпоследнюю, а третью снаружи оболочку, благо на ней есть вакансии. Согласно формуле ne = 2N 2, на этой оболочке – четвертой от ядра – может быть 32 электрона. Сюда, за редким исключением, и попадают «новые» электроны очередных лантаноидов. А поскольку химические свойства элемента определяются прежде всего строением наружных электронных оболочек, свойства лантаноидов оказываются еще более близкими, чем свойства переходных металлов.
Как и положено элементам III группы, лантаноиды обычно трехвалентны. Но некоторые из них могут проявлять и другую валентность: церий, празеодим и тербий – 4+; самарий, европий и иттербий – 2+.
Аномальные валентности лантаноидов исследовал и объяснил немецкий химик Вильгельм Клемм. По рентгеновским спектрам он определил основные параметры их кристаллов и атомные объемы. На кривой атомных объемов явно выражены максимумы (европий, иттербий) и менее резко – минимумы (церий, тербий). Празеодим и самарий тоже выпадают, хотя и не так сильно, из ряда, определяемого плавно ниспадающей кривой. Поэтому первый «тяготеет» к малообъемным церию и тербию, а второй – к крупным европию и иттербию. Элементы с большими атомными объемами крепче удерживают электроны, и потому бывают лишь трех- или даже двухвалентными. В «малообъемных» атомах, напротив, один из «внутренних» электронов заключен в оболочке недостаточно прочно – потому атомы церия, празеодима и тербия могут быть четырехвалентными.
В работах Клемма дано и физическое обоснование давно сложившегося разделения редкоземельных элементов на две подгруппы – цериевую и иттриевую. В первую входят лантан и лантаноиды от церия до гадолиния, во вторую – иттрий и лантаноиды от тербия до лютеция. Отличие между элементами двух этих групп – направление спинов у электронов, заполняющих главную для лантаноидов четвертую оболочку.
Когда речь идет о лантаноидах, закономерности тоже порой кажутся алогичными. Пример тому – лантаноидное сжатие.
Лантаноидным сжатием называют открытое норвежским геохимиком Гольдшмидтом закономерное уменьшение размеров трехвалентного иона редкоземельных элементов – от лантана к лютецию. Казалось бы, все должно быть наоборот: в ядре атома церия на один протон больше, чем в ядре атома лантана; ядро празеодима больше, чем ядро церия, и так далее. Соответственно растет и число электронов, вращающихся вокруг ядра. И если представить атом таким, как его обычно рисуют на схемах, – в виде маленького диска, окруженного вытянутыми орбитами невидимых электронов, орбитами разных размеров, то, очевидно, прибыль электронов должна была бы увеличить размеры атома в целом. Или, если отбросить наружные электроны, число которых может быть неодинаковым, такая же закономерность должна наблюдаться в размерах трехвалентных ионов лантана и его команды.
Истинное положение вещей иллюстрирует диаграмма лантаноидного сжатия. Радиус трехвалентного иона лантана равен 1,22 Å, а такого же иона лютеция – всего 0,99 Å. Все не по логике, а как раз наоборот. Однако до физического смысла явления лантаноидного сжатия докопаться нетрудно и без квантовой механики, достаточно лишь вспомнить основные законы электромагнетизма.
Заряд ядра и число электронов вокруг него растут параллельно. Сила притяжения между разноименными зарядами тоже растет; более тяжелое ядро сильнее притягивает электроны, укорачивает их орбиты. А поскольку в атомах лантаноидов наиболее насыщены электронами глубинные орбиты, электрическое притяжение оказывает еще более сильное действие.
Близость ионных радиусов и общность химических свойств – вот главные причины совместного присутствия лантаноидов в минералах.
О минералах редких земель
О главном из них – монаците – рассказано выше. Второй по важности редкоземельный минерал – бастнезит – во многом похож на него. Бастнезит тоже тяжелый, тоже блестящий, тоже не постоянен по окраске (чаще всего светло-желтый). Но химически с монацитом его роднит только большое содержание лантана и лантаноидов. Если монацит – фосфат, то бастнезит – фторокарбонат редких земель, его состав обычно записывают так: (La, Ce)FCO3. Но, как часто бывает, формула минерала не полностью отражает его состав. В данном случае она указывает лишь на главные компоненты: в бастнезите 36,9...40,5% окиси церия и почти столько же (в сумме) окислов лантана, празеодима и неодима. Но, конечно, в нем есть и остальные лантаноиды.
Кроме бастнезита и монацита, практически используют, хотя и ограниченно, еще несколько редкоземельных минералов, в частности гадолинит, в котором бывает до 32% окислов РЗЭ цериевой подгруппы и 22...50% – иттриевой. В некоторых странах редкоземельные металлы извлекают при комплексной переработке лопарита и апатита.
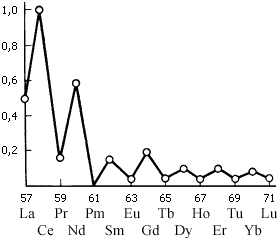
Рисунок – Относительное содержание лантаноидов в земном коре
Закономерность: четные распространены больше нечетных
Всего известно около 70 собственно редкоземельных минералов и еще около 200 минералов, в которые эти элементы входят как примеси. Это свидетельствует о том, что «редкие» земли вовсе не такие уж редкие, а это старинное общее название скандия, иттрия и лантана с лантаноидными – не более чем дань уважения прошлому. Они не редки – церия в земле больше, чем свинца, а самые редкие из редкоземельных распространены в земной коре намного больше, чем ртуть. Все дело в рассеянности этих элементов и сложности отделения их один от другого. Но, конечно, лантаноиды распространены в природе не одинаково. Элементы с четными атомными номерами встречаются значительно чаще, чем их нечетные соседи. Это обстоятельство, естественно, сказывается на масштабах производств и ценах на редкоземельные металлы. Самые труднодоступные лантаноиды – тербий, тулий, лютеций (заметьте, все это лантаноиды с нечетными атомными номерами) – стоят дороже золота и платины. А цена церия более 99%-ной чистоты – всего 55 рублей за килограмм (данные 1970 г.). Для сравнения укажем, что килограмм мишметалла стоит 6...7 рублей, а ферроцерия (10% железа, 90% редкоземельных элементов, в основном церия) – всего пять. Масштабы использования РЗЭ, как правило, пропорциональны ценам...
Реакторный яд
Природный лантан состоит из двух изотопов с массовыми числами 138 и 139, причем первый (его доля всего 0,089%) радиоактивен. Он распадается путем К-захвата с периодом полураспада 3,2·1011 лет. Изотоп лантан-139 стабилен. Между прочим, он образуется в атомных реакторах при распаде урана (6,3% массы всех осколков). Этот изотоп считается реакторным ядом, поскольку он довольно активно захватывает тепловые нейтроны, что характерно и для лантаноидов. Из искусственных изотопов лантана наибольший интерес представляет лантан-140 с периодом полураспада 40,22 часа. Этот изотоп применяют в качестве радиоактивного индикатора при изучении процессов разделения лантана и лантаноидов.
Элементы, следующие за лантаном, называют редкоземельными, или лантанидами, или лантаноидами. Какое из этих названий наиболее оправданно? Термин «редкие земли» появился в XVIII в. Теперь его относят к окислам скандия, иттрия, лантана и его аналогов; первоначально же этот термин имел более широкий смысл. «Землями» вообще называли все тугоплавкие окислы металлов. По отношению к элементам с атомными номерами от 57 до 71 это справедливо: температура плавления La2O3 – около 2600°C. В чистом виде многие из этих «земель» редки и поныне. Но о редкости редкоземельных элементов в земной коре говорить уже не приходится...
Термин «лантаниды» ввели для того, чтобы показать, что следующие четырнадцать элементов идут за лантаном. Но тогда с равным успехом фтор можно назвать кислородидом (или оксидом) – он же следует за кислородом, а хлор – сульфидом... Но в понятия «сульфид», «фосфид», «гидрид», хлорид» и так далее химия издавна вложила другой смысл. Поэтому термин «лантаниды» большинство ученых считают неудачным и пользуются им все реже.
«Лантаноиды» – более оправданно. Окончание «оид» указывает на подобие. «Лантаноиды» – значит «лантаноподобные». Видимо, этим термином и следует пользоваться для обозначения 14 элементов – аналогов лантана.
Маскируясь под крахмал
Одно из соединений лантана – его основной ацетат – ведет себя как крахмал, если к нему добавляют иод. Белый гель принимает ярко-синюю окраску. Этим свойством аналитики иногда пользуются для открытия лантана в смесях и растворах.
Двухвалентен лишь формально
Установлено, что во всех соединениях лантан проявляет одну и ту же валентность – 3+. Но как тогда объяснить существование серо-черного дигидрида LaH2 и желтого сульфида LaS? Установлено, что LaH2 – это относительно устойчивый полупродукт реакции образования LaH3 и что в обоих гидридах лантан трехвалентен. В молекуле дигидрида есть металлическая связь La – La. С сульфидом все объясняется еще проще. Это вещество обладает высокой электропроводностью, что заставляет полагать наличие в нем ионов La3+ и свободных электронов. Кстати, LaH2 тоже хорошо проводит ток, в то время как LaH3 – полупроводник.
Примеры решения задач
ПРИМЕР 1
| Задание | Осуществите ряд химических превращений: La→La(OH)3→ La2O3→ LaCl3. |
| Ответ | При растворении лантана в горячей воде образуется гидроксид этого метала: 2La + 6H2O(hot)→ 2La(OH)3 + 3Н2. При нагревании до 300 – 1100oС гидроксид лантана разлагается на оксид и воду: La(OH)3→La2O3 + H2O. Оксид лантана растворяется в разбавленной соляной кислоте с образованием хлорида лантана: La2O3 + 6HCl(dilute)→ 2LaCl3 + 3H2O. |
ПРИМЕР 2
| Задание | Рассчитайте массовые доли элементов, входящих в состав оксида лантана (III), если его молекулярная формула имеет вид La2O3. |
| Решение | Массовая доля элемента в составе какой-либо молекулы определяется по формуле: ω (Х) = n × Ar (X) / Mr (HX) × 100%. Найдем молекулярную массу оксида лантана (III): Mr(La2O3) = 2×Ar(La) + 3×Ar(O) = 2×139 + 3×16 = 278 + 48 = 326 г. Тогда, массовые доли лантана и кислорода будут равны: ω (La) = 2 × Ar (La) / Mr (La2O3) × 100%; ω (м) = 2 × 139 / 326 × 100% = 85,28%. ω (O) = 3 × Ar (O) / Mr (La2O3) × 100%; ω (O) = 3 × 16 / 326 × 100% = 14,72%. |
| Ответ | Массовая доля лантана равна 85,28%, массовая доля кислорода равна 14,72%. |
Дата: 2019-02-02, просмотров: 815.