Получив задачу, обратить внимание на окраску раствора, наличие осадка, рН раствора и сделать соответствующие предварительные выводы. Небольшую часть задачи оставить для повторения реакций обнаружения некоторых катионов. В процессе разделения катионов на группы нужно пробирки снабжать соответствующими этикетками.
Анализируемая смесь включает
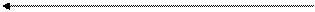 Сu2+; Co2+; Ni2+; K+; NH4+
Сu2+; Co2+; Ni2+; K+; NH4+
Сu2+ + [Fe(CN)6]→ Cu[Fe(CN)6]↓
K+
 NH4+
NH4+
реакции Na2CO3 сухой;
с реактивом Несслера t0

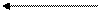 и NаOH р-р Ni2+ + диметилглиоксим +NH3 /пары/
и NаOH р-р Ni2+ + диметилглиоксим +NH3 /пары/
в газовой камере /капельная реакция/
осадок 1 раствор 1
 (СuOH)2CO3↓
(СuOH)2CO3↓
(CoOH)2CO3↓ CH3COOH Co2+ + изоамиловый спирт
(NiOH)2CO3↓ pH≈4-5 KSCN

 Na3[Co(NO2)6]
Na3[Co(NO2)6]
t0
K2Na[Co(NO2)6] [Co(SCN)4]2-
Схема анализа смеси катионов V и VI аналитических групп
23.1. Дробное обнаружение некоторых катионов.
23.1.1. Открытие Bi3+.
Наличие в задаче осадка свидетельствует о присутствии иона Bi3+, который в результате гидролиза образует осадок хлористого висмута BiOCl↓ белого цвета. Задачу центрифугировать – отделить раствор 1 от осадка 1. В осадке 1 после растворения в HNO3 (2н) двумя способами открыть катион Bi3+.
23.1.2. Открыть ион аммония NH4+ согласно 21.2.
23.1.3. Открыть ион калия следующим образом: к пяти каплям исходного раствора прибавить сухой соли Na2СO3 до рН > 7, перемешать палочкой, нагреть, центрифугировать (в осадке остаются все катионы, кроме шестой группы). Центрифугат подкислить уксусной кислотой до рН < 7 и в случае отсутствия иона аммония открыть К+ согласно 21.1. Если ион NH4+ был открыт, то до подкисления CH3COOH центрифугат нужно прокипятить для удаления аммиака, а затем подкислить уксусной кислотой и открыть ион калия.
23.1.4. Открыть ион Mn2+ капельной реакцией с бензидином. Реактивы наносить в следующей последовательности:
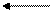 испытуемый раствор
испытуемый раствор
 | |||
 | |||
NH3(2-3 мин)
NH4Cl
бензидин
синее или зеленое окрашивание.
Аммиак нужен, чтобы создать щелочную среду, а NH4Cl – для того, чтобы связать ион кобальта в комплекс.
23.1.5. Открыть ион Fe2+: к трем каплям исходного раствора (рН=2-3) добавить K3[Fe(CN)6]. Выпадение синего осадка говорит о наличии иона Fe2+. В присутствии ионов Mn2+, Zn2+, Co2+, Ni2+ осадок может иметь не синий, а зеленый цвет, так как все эти ионы образуют осадки от желтого до бурого цвета. При встряхивании пробирки заметны крупицы синего осадка.
23.1.6. Обнаружение Cu2+
2-3 капли задачи подкислить разбавленной H2SO4 до рН ≤ 7 и прилить 2-3 капли K4[Fe(CN)6].
23.1.7. Открыть Fe3+ и Со2+: к трем каплям задачи (рН < 7) прилить изоамиловый спирт и прибавить сухой роданид калия (KSCN), встряхнуть. Окрашивание верхнего слоя в синий цвет указывает на наличие иона Co2+. Однако в присутствии ионов Fe3+ и Сu2+ реакция осложняется появлением красной (Fe(SCN)3) и черной (Cu(SCN)2) окрасок. Обесцвечивание красной окраски осуществляется прибавлением сухого NaF (встряхивать); удаление черной окраски - прибавлением сухого Na2SO3(встряхивать). В первом случае образуется бесцветный устойчивый комплекс [FeF6]3-, а во втором случае роданид двухвалентной меди восстанавливается до бесцветного CuSCN.
На этом основании можно сделать вывод о наличии или отсутствии ионов Fe3+ и Сu2+ (открытие таким методом меди (II) ненадежно).
34.1.8. Открыть ион Ni2+ капельной реакцией согласно 18.3. В отсутствие никеля можно открыть ион меди в исходном растворе добавлением избытка аммиака. Появление сине-фиолетового окрашивания подтверждает наличие Cu (II).
23.2. Систематический ход анализа.
23.2.1. Обнаружение Mg2+
К раствору 1 добавить ложечку сухого NH4Cl, NH4OH, H2O2, перемешать, нагреть, центрифугировать. В полученном центрифугате открыть ион Mg2+ действием Na2HPO4. Появление мути или осадка MgNH4PO4 говорит о наличии Mg2+.
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Дата: 2019-02-02, просмотров: 343.