Все катионы пятой группы можно открыть дробным методом.
19.1. Открыть ион никеля капельной реакцией с реактивом Чугаева.
19.2. Открыть ион кобальта роданидом калия. Появление черного окрашивания указывает на наличие ионов меди.
19.3. Открыть ион меди гексацианоферратом (II) калия.
По выполненной работе составить подробный отчет, сделать вывод о составе полученной смеси ионов.
Вопросы для повторения
1. Написать уравнения реакций, происходящих при добавлении раствора щёлочи к смеси катионов пятой группы.
2. Какие вещества получатся, если к смеси катионов пятой группы прибавить небольшое количество аммиака? Написать уравнения реакций.
3. Какие вещества получаются при добавлении избытка аммиака к смеси катионов пятой группы?
4. Написать уравнения реакций, происходящих при добавлении растворов щёлочи и перекиси водорода.
5. Напишите уравнения реакций ионов V группы с эквивалентным количеством и избытком раствора аммиака.
6. При действии на смесь катионов пятой группы избытка аммиака образуется сине-фиолетовый раствор. Какой ион присутствует в смеси? Напишите уравнение реакции.
7. При действии щёлочи на смесь катионов пятой группы выпал осадок голубого цвета. Какие ионы могут быть в смеси, если при нагревании осадок:
а) чернеет; б) розовеет? Напишите уравнения реакций.
8. Предложите схему анализа смеси катионов V группы.
9. Напишите реакцию растворения основного карбоната никеля в избытке раствора аммиака.
10. Каких катионов пятой группы нет в растворе, если при добавлении тиосульфата натрия к кислому раствору и нагревании не образуется чёрного осадка?
11. Подберите коэффициенты: t
CuSO4 + Na2S2O3 +H2O ® Cu2S¯ + S¯ + H2SO4
12. Какой осадок выпадает при добавлении раствора соды к соли меди? Напишите уравнение реакции. Дайте объяснение.
13. Объясните, почему раствор смеси катионов пятой группы имеет кислую реакцию? Напишите уравнения реакций.
14. Какая реакция происходит при открытии иона никеля диметилглиоксимом? Почему нужна щелочная среда?
15. Напишите реакции взаимодействия иона кобальта с перекисью водорода в щелочной среде и растворения получившегося осадка в соляной кислоте.
16. Напишите реакцию, позволяющую открыть и замаскировать ион меди (II).
Шестая группа катионов
Шестую группу образуют катионы К+, NH4+ которые не осаждаются ни кислотами, ни щелочами. Эта группа не имеет группового реагента. Открывают их дробным методом в начале анализа.
Общая характеристика катионов шестой группы
Ионы К+ и NH4+ не вступают в окислительно-восстановительные реакции (т.е. не меняют степени окисления). Растворы их солей бесцветны.
Соли сильных кислот и иона К+ имеют нейтральную реакцию, так как не подвергаются гидролизу.
Комплексный ион аммония NH4+ даёт соли, подвергающиеся гидролизу по катиону - кислая реакция:
NH4+ + H2O « NH4OH + H+
Соли слабых кислот и иона К+ за счёт гидролиза по аниону имеют щелочную реакцию:
I K2CO3 + H2O « KHCO3 + KOH
II KHCO3 + H2O « H2CO3 + KOH
Лабораторная работа № 6
«Изучение свойств катионов VI аналитической группы и анализ их смеси»
Цель работы: изучение свойств солей, гидроксидов ионов К+, NH4+ ; знакомство с методами разделения и обнаружения.
Реакции обнаружения катионов шестой группы
Калий
Реакция с гексанитрокобальтатом (III) натрия Na3[Co(NO2)6]. Данный реагент с катионами калия образует жёлтый кристаллический осадок двойной комплексной соли кобальта (III):
2KCl + Na3[Co(NO2)6] ® K2Na[Co(NO2)6]¯ + 2NaCl
гексанитрокобальтат (III)
калия-натрия
2K+ + Na+ + [Co(NO2)6]3- ® K2Na[Co(NO2)6]¯
ярко-жёлтый
Реакцию можно проводить в пробирке или на стекле. Выполнение реакции: к капле раствора соли калия приливают 1-2 капли раствора Na3[Co(NO2)6], дают постоять, образуется хорошо различимый осадок ярко-жёлтого цвета, нерастворимый в уксусной кислоте.
Аммоний
Реакция со щёлочью NaOH. Взаимодействие солей аммония с NaOH или КОН приводит к выделению аммиака при нагревании:
t
NH4Cl + NaOH ® NH3 + H2O + NaCl
Выполнение реакции рассмотрено ниже.
Реакция с реактивом Несслера. Реактив Несслера - щелочной раствор комплексной соли тетраиодомеркурата (II) калия K2[HgI4]+KOH. При взаимодействии реагента с солями аммония образуется красно-бурый осадок по реакции:
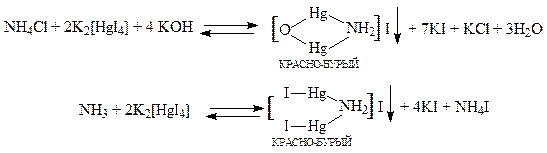
Реактив Несслера содержит щёлочь, которая с большинством катионов даёт осадок труднорастворимых гидроксидов, многие из которых окрашены.
Их образование мешает наблюдению осадка, образующегося в присутствии иона NH4+. Для устранения этого недостатка реакцию проводят в газовой камере.
Выполнение реакции:
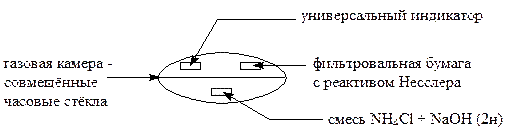
На одно часовое стекло нанести 2 капли соли аммония и 2 капли 2н раствора NaOH; на другое стекло поместить универсальный индикатор, смоченный водой, и фильтровальную бумагу, смоченную реактивом Несслера. Бумажки не должны соприкасаться. Накрыть вторым стеклом первое, камеру поместить на ладонь. Через некоторое время фильтровальная бумага, смоченная реактивом Несслера, окрашивается в бурый цвет, а универсальный индикатор синеет вследствие образования гидроксид - ионов по реакции
NH3 + H2O ® NH4OH ® NH4+ + OH-
Дата: 2019-02-02, просмотров: 636.