Проделать реакции на катионы Cu2+, Co2+, Ni2+ согласно табл.6:
Таблица 6
| Реактив | Условия реакции | Катионы | ||
| Cu2+ | Co2+ | Ni2+ | ||
| 1 | 2 | 3 | 4 | 5 |
| NaOH | Cu(OH)2¯ голубой | Со(ОН)Cl¯ cиний, Со(ОН)2 ¯ розовый | Ni(OH)2¯ зелёный | |
| NaOH + H2O2 | нагреть | CuO¯ чёрный | Co(OH)3¯ тёмно-бурый | Ni(OH)2¯ зелёный |
Продолжение табл.6
| 1 | 2 | 3 | 4 | 5 |
| NH4OH | избыток до растворения осадков | [Cu(NH3)4]2+ лазурно-синий | [Co(NH3)6]2+ грязно-жёлтый | [Ni(NH3)6]2+ сиреневый |
| Na2CO3* | раствор | (CuOH)2CO3¯ зелёный | (CoOH)2CO3¯ розовый | (NiOH)2CO3¯ зелёный |
| K4[Fe(CN)6] | Cu2[Fe(CN)6] ¯ красно-бурый | Co[Fe(CN)6] ¯ серо-зелёный | Ni2[Fe(CN)6]¯ жёлто-зелёный | |
| KSCN или NH4SCN | Cu(SCN)2¯ чёрный, со временем белеет | [Co(SCN)4]2- синий в избытке реактива | Ni(SCN)2¯ светло-зелёный, растворим в избытке реактива | |
| Na2HPO4 | Cu3(PO4)2¯ голубой | Co3(PO4)2¯ фиолетовый, растворяется в аммиаке | Ni3(PO4)2¯ зелёный, растворяется в аммиаке | |
| *Все гидроксокарбонаты растворяются в концентрированном растворе аммиака с образованием комплексов. | ||||
Реакции обнаружения катионов V группы
Медь
Реакция с гексацианоферратом (II) калия K4[Fe(CN)6]. Данная реакция очень чувствительна. Другие катионы пятой группы также образуют с этим реагентом осадки (см. табл. 6).
Выполнение реакции 2-3 капли раствора соли меди (II) подкислить 2н H2SO4 до рН<7 и прилить 2-3 капли K4[Fe(CN)6]. В присутствии меди (II) выпадает красно - бурый осадок гексацианоферрата (II) меди:
2Сu2+ + [Fe(CN)6]4- ® Cu2[Fe(CN)6]¯
Реакция с роданидом калия KSCN или аммония NH4SCN. Соль меди (II) с KSCN образует чёрный осадок роданида двухвалентной меди Cu(SCN)2¯:
Сu(NO3)2 + 2KSCN ® Cu(SCN)2¯ + 2KNO3
чёрный
В ходе анализа черный осадок Cu(SCN)2 превращают в белый CuSCN, применяя восстановитель Na2SO3. Это проводят для маскировки Сu2+ при обнаружении Co2+.
Выполнение реакции. 2-3 капли соли меди (II) подкислить до рН£7 и присыпать несколько кристалликов KSCN или NH4SCN. При этом выпадает чёрный осадок роданида меди (II), затем в пробирку присыпать несколько кристалликов сухого сульфита натрия Na2SO3. Происходящая ОВ реакция приводит к образованию белого осадка CuSCN¯:
2Cu(SCN)2¯ + Na2SO3 + H2O ® 2CuSCN¯ + Na2SO4 + 2HSCN
чёрный сухой белый
 2 Cu2+ + е ® Cu1+
2 Cu2+ + е ® Cu1+
1 SO32- + H2O - 2e ® SO42- + 2H+
Кобальт
Реакция с роданидом калия KSCN или аммония NH4SCN. Соль кобальта (II) при рН=4-5 с сухим роданидом калия или аммония даёт неустойчивый в воде комплекс синего цвета:
СoCl2 + 4KSCN ® K2[Co(SCN)4] + 2KCl
синий раствор
Образующийся комплекс более устойчив в органическом растворителе - изоамиловом спирте. Реакции мешают ионы Fe3+ и Cu2+, дающие с роданидом комплексы соответственно красного и чёрного цвета. Роданид железа можно замаскировать прибавлением NaF или NH4F, а роданид меди обесцветить восстановлением Na2SO3.
Выполнение реакции: к 2 каплям соли кобальта (II) добавить 3-4 капли изоамилового спирта и несколько кристалликов роданида калия, пробирку встряхнуть и дать расслоиться жидкости. Верхний (органический) слой окрашивается в синий цвет. Нижний (водный) окрашивается в розовый вследствие разложения комплекса. Реакцию можно применять для дробного обнаружения кобальта в смеси с другими катионами.
Никель
Реакция с диметилглиоксимом (реактивом Чугаева). Диметилглиоксим образует с ионом Ni2+ в аммиачной среде (рН»9) характерный ало-красный осадок внутрикомплексной соли. Аммиак связывает выделяющиеся ионы водорода и равновесие сдвигается вправо:
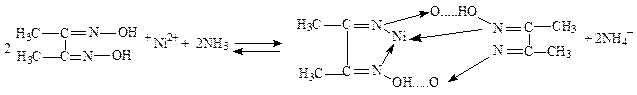
Реакции мешают ионы Cu2+, Fe3+. Если проводить её капельным методом, то она очень специфична.
Выполнение реакции. В центр фильтровальной бумаги помещают:
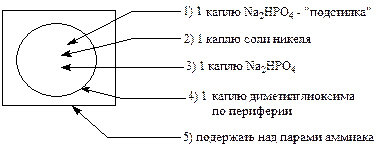
В присутствии Ni2+ образуется ярко-розовое окрашивание.
Роль Na2HPO4 заключается в том, что он связывает мешающие катионы в труднорастворимые фосфаты (Сu3(PO4)2; FePO4), которые остаются в центре пятна. А более растворимый Ni3(PO4)2 располагается по периферии пятна, где и открывается диметилглиоксимом.
 Анализируемая смесь включает
Анализируемая смесь включает
Ni 2+ , Co 2+ , Cu 2+
Дробно из исходного раствора

Ni2+- + 2H2Dm → Ni[HDm]2
/капельно/ диметиглиоксим комплекс розового цвета
/реактив Чугаева/
 Сo2++4SCN- → [Co(SCN)4]2-
Сo2++4SCN- → [Co(SCN)4]2-
голубой комплекс
 Сu2+ + [Fe(CN)6]4-→ Cu2[Fe(CN)6]↓
Сu2+ + [Fe(CN)6]4-→ Cu2[Fe(CN)6]↓
«шоколад»
Схема анализа катионов V аналитической группы
Дата: 2019-02-02, просмотров: 376.