21. Медь → Cu(NO3)2 → Cu(OH)2 → сульфат меди (II) → CuCl2 → CuS
22. Na → гидроксид натрия → NaHCO3 → Na2CO3 → NaCl → нитрат натрия
23. Al → хлорид алюминия → Al2(SO4)3 → Al(OH)3 → хлорид алюминия → Al(NO3)3
24. Ca → Ca(OH)2 → хлорид кальция → Ca(NO3)2 = > Ca3(PO4)2
25. Магний → хлорид магния → Mg(OH)2 → сульфат магния → → карбонат магния
26. Цинк → хлорид цинка → ZnSO4 → нитрат цинка → гидроксид цинка → цинкат натрия.
27. Железо → хлорид железа(II) → гидроксид железа(II)→ FeSO4 = > хлорид железа(II) → железо.
28. Оксид кальция → Ca(OH)2 → карбонат кальция → оксид кальция → нитрат кальция.
29. Алюминий → гидроксид алюминия → хлорид алюминия → Al(OH)3 → алюминат натрия.
30. Углерод → оксид углерода (IV) → Na2CO3 → карбонат кальция → CaO → сульфат кальция.
31. Цинк → ZnO → ZnCl2 → Zn(OH)2 → ZnO → Na2ZnO2.
32. Фосфор → оксид фосфора(V) → фосфорная кислота → фосфат калия → фосфат кальция.
33. CuSO4 → медь → CuO → CuCl2 → гидроксид меди (II) → Cu(NO3)2.
34. S → диоксид серы → SO3 → сульфат калия → BaSO4
35. Алюминий → сульфат алюминия → Al(NO3)3 → гидроксид алюминия → хлорид алюминия.
36. Zn → Zn(NO3)2 → гидроксид цинка → ZnSO4 → ZnCl2 → сульфид
37. K → гидроксид калия → KHCO3 → K2CO3 → хлорид калия → KNO3
38. Fe → сульфат железа (II) → Fe(NO3)3 → Fe(OH)3 → FeCl3
39. Ba → Ba(OH)2 → хлорид бария → Ba(NO3)2 = > Ba3(PO4)2
40. Sn(OH)2 → оксид олова → SnCl2 → Sn(NO3)2 → гидроксид олова.
Расчет молярной массы и массовой доли.
Важным навыком в освоении дисциплины «Химия» является умение работать с атомарной, молекулярной и молярной массой вещества. Атомрная масса – масса одного атома (а.е.м). Молекулярная масса – это масса одной молекулы (а.е.м). Молярная масса – масса одного моля (г/моль). Нельзя сказать, что это одно и то же, однако их цифровые значения эквивалентны. Массовая доля – это то количество элемента (вещества), которое содержится в общей массе вещества, выраженное в долях или в процентах.
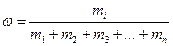 ;
; 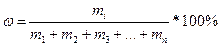
Для задач и практических расчетов необходимо находить молярные массы простых и сложных веществ (S, O2, H2O, CuSO4*5H2O). Для верного определения молярной массы нужно знать, что формулы простых веществ соответствуют одному атому (P, Mg, Zn), а их молярная масса будет соответствовать значению, указанному в периодической таблице (M(P)=30,97; M(Mg)=24,30; M(Zn)=65,39). Такая же картина наблюдается и для благородных газов, когда молекула принимается равной атому и молярная масса соответствует значению, указанному в периодической таблице (M(He)= 4; M(Ne)= 20,18; M(Ar)=39,95). Важно запомнить, что для большинства газов картина совершенно иная. Так водород, кислород и галогены (F, Cl, Br, J) представляют собой двухатомные молекулы и записываются в виде: H2, O2, Cl2, I2. Таким образом, их молярные массы записываются следующим образом: M(H2)=2; M(O2)=32; M(N2)=28; M(Cl2)=71.
Для нахождения молярной массы сложного вещества необходимо пользоваться простыми правилами математики: сложение и умножение.
На самом деле все задачи на нахождение молярной массы выглядят следующим образом:
Стоят три мешка красных яблок и два – зеленых яблок. Мешок красных яблок весит 5 килограммов, а зеленых – 3 килограмма. Найти массу всех яблок.
3*5+2*3=15+6=21 (килограмм).
Рассмотрим примеры:
Пример 1.
Дано вещество H2O, нужно найти его молярную массу.
Рассматриваем формулу и определяем, что молекула состоит из 2 атомов водорода и 1 атома кислорода. Тогда масса молекулы воды будет равна:
M(H2O) = M(H)*2+M(O)
Теперь в периодической таблице (см. Приложение №1) находим массы указанных атомов и подставляем значения в уравнение.
M(H2O) = M(H)*2+M(O)=1*2+16=18 (а.е.м. – для молекулы и г/моль – для 1 моля воды)
M(H2O)=18 г/моль.
Пример 2.
Дано вещество CuSO4, нужно найти его молярную массу.
Рассматриваем формулу и определяем, что молекула состоит из 2 атомов водорода 1 атома серы и 4 атомов кислорода. Тогда масса молекулы этого вещества будет равна:
M(CuSO4) = M(Cu)+M(S)+M(O)*4
Теперь в периодической таблице (см. Приложение №1) находим массы указанных атомов и подставляем значения в уравнение.
M(CuSO4) = M(Cu)+ M(S)+M(O)*4=63,55+32+16*4=159,55 (а.е.м. – для молекулы и г/моль – для 1 моля)
M(CuSO4)=159,55 г/моль.
Пример 3.
Дано вещество CuSO4*5H2O, нужно найти его молярную массу.
Представленное вещество является кристаллогидратом, и состоит из связанных молекул CuSO4 и H2O. Для нас важно, что одна молекула CuSO4 связывает 5 молекул воды. Это нужно принимать во внимание при составлении уравнения.
M(CuSO4*5H2O) = M(CuSO4)+5*M(H2O)
Сделав такое представление, можно увидеть, что представленная задача распалась на две предыдущие. Решение этой задачи будет комбинированием действий из примеров 1 и 2.
M(CuSO4*5H2O)=M(CuSO4)+5*M(H2O)=63,55+32,07+16*4+5*(1*2+16)
M(CuSO4*5H2O)= 249,62 г/моль.
Пример 4.
Дано вещество Арктит Na5BaCa7(PO4)6F3, нужно найти его молярную массу.
Подход для решения поставленной задачи такой же, как в первых двух примерах.
M(Na5BaCa7(PO4)6F3)=M(Na)*5+M(Ba)+M(Ca)*7+(M(P)+M(O)*4)*6+M(F)*3.
После записи такого уравнения обращаемся к периодической таблице (см. Приложение №1) и используем массы указанных веществ.
M(Na5BaCa7(PO4)6F3)=M(Na)*5+M(Ba)+M(Ca)*7+(M(P)+M(O)*4)*6+M(F)*3 M(Na5BaCa7(PO4)6F3)=22,99*5+137,33+40,08*7+30,97+16*4=627,81.
M(Na5BaCa7(PO4)6F3)=627,81 г/моль
Следующим этапом расчетных задач является определение того или иного вещества, содержащегося в какой либо смеси или минерале. Например, сколько цинка можно извлечь из 245 килограммов ганита (Ганит ‑ ZnAl2O4)? Для решения таких задач, необходимо определить молярные массы цинка (заданного элемента) и самого минерала (вещества).
Пример 5
Сколько цинка можно извлечь из 245 килограммов ганита (Ганит - ZnAl2O4)?
1. Определить молярную массу цинка. Находим ее в периодической таблице.
2. Определить молярную массу всего вещества. Делаем это аналогично предыдущим примерам.
M(Zn)=65,39
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
3. Следующий наш шаг – это использование пропорции.
По расчету определили, что в 183,35 граммах ганита содержится 65,39 граммов цинка.
Тогда в 245 килограммах содержится X килограммов цинка.
Эти рассуждения представим в виде пропорции:
| 183,35 г ZnAl2O4 | ~ | 65,39 г. Zn |
| 245 кг ZnAl2O4 | ~ | X кг Zn |
| 183,35 г | = | 65,39 г |
| 245 кг | X кг |
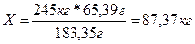
Решая данную пропорцию, мы получаем искомый ответ: 87,37 кг цинка можно получить из 245 кг ганита.
В случае, если нужно определить содержание алюминия в ганите, нужно учесть, что в отличие от цинка, алюминия содержится 2 в соответствии с формулой. Тогда для учета этого отличия рассмотрим следующий пример.
Пример 6
Сколько алюминия можно извлечь из 245 килограммов ганита. (Ганит - ZnAl2O4)?
В целом все операции те же, что и в предыдущем примере.
1. Определить молярную массу алюминия. Находим ее в периодической таблице .
2. Определить молярную массу всего вещества. Делаем это аналогично предыдущим примерам.
M(Al)=26,98
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
3. Следующий наш шаг – учесть, что нужно использовать удвоенную массу алюминия, так как после алюминия в формуле ганита стоит индекс 2 (ZnAl2O4).
4. После этого можно приступать к составлению пропорции
По расчету определили, что в 183,35 граммах ганита содержится 26,98*2 граммов алюминия.
Тогда в 245 килограммах содержится X килограммов цинка.
Эти рассуждения представим в виде пропорции:
| 183,35 г ZnAl2O4 | ~ | 26,98*2 г. Al |
| 245 кг ZnAl2O4 | ~ | X кг Al |
| 183,35 г | = | 26,98*2 г |
| 245 кг | X кг |
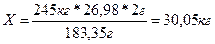
Решая данную пропорцию, мы получаем искомый ответ: 30,05 кг алюминия можно получить из 245 кг ганита.
В каждом из последних двух примеров можно определить массовую долю цинка или алюминия в ганите. Рассмотрим такую задачу отдельно.
Пример 7.
Определите массовую долю цинка и алюминия в ганите (ZnAl2O4)
1. Определить молярную массу цинка. Находим ее в периодической таблице.
Определить молярную массу всего вещества.
M(Zn)=65,39
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
Разделить молярную массу алюминия на молярную массу всего соединения.
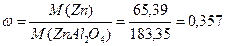 ;
;
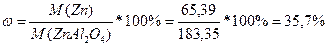
2. Определить молярную массу алюминия. Находим ее в периодической таблице.
Определить молярную массу всего вещества.
M(Al)=26,98
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
Разделить молярную массу всего алюминия на молярную массу всего соединения.
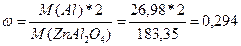 ;
;
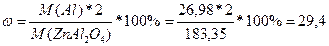 %
%
* Примечание: можно округлять до целых.
Дата: 2018-12-28, просмотров: 405.