И контрольных работ по химии
для студентов инженерных специальностей Уральского ГАУ
Направление подготовки
15.03.02 Технологические машины и оборудование
Направленность (профиль) программы
Машины и аппараты пищевых производств
Составители: Ст. преподаватель Суслов Е.А.
Ст. преподаватель Саетова Н.С.
Екатеринбург, 2018
УДК 546 (0758)
Учебно-методическое пособие для самостоятельного разбора задач и контрольных работ по химии для студентов инженерных специальностей Уральского ГАУ по направление подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств.
Составители: Старший преподаватель кафедры химии, почвоведения и агроэкологии УрГАУ Суслов Е.А., Старший преподаватель кафедры химии, почвоведения и агроэкологии УрГАУ Саетова Н.С. Екатеринбург, УрГАУ, 2018г., с. 66
Утверждено методической комиссией Инженерного факультета
«_08_»_апреля_ 2018г. Учебно-методическое пособие составлено в соответствии с программой по химии и предназначено для самостоятельного разбора задач и контрольных работ по химии по направлению подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств
Уральский государственный аграрный университет, 2018г.
ПРЕДИСЛОВИЕ
Данные учебное пособие разработано в соответствии с программой курса химии и в соответствии с Государственным образовательным стандартом для дисциплины «Химия» по профилю: Машины и аппараты пищевых производств. Пособие направлено на самостоятельное получение навыков решения простых задач по дисциплине «Химия» и является вспомогательным материалом для усвоения теоретического отдельных тем, а также для подготовки к зачету или экзамену. Данные учебное пособие содержит примеры решения типовых задач и блоки заданий для самостоятельного решения или контрольных работ. Пособие может быть использовано для самостоятельного усвоения, домашних заданий и формирования контрольных работ. Вариант задания определяется по последним двум цифрам шифра (номер студенческого билета или зачетной книжки) и приведен в таблице на страницах 4-5. Например, для студента с номером студенческого билета 2018-28 (или 028-12) вариант будет 28 и задачи, соответствующие номеру этого варианта:
| № блока | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 28 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
СОДЕРЖАНИЕ
Классы неорганических соединений. 6
Блок №1. Взаимодействие классов. 10
Блок №2 Цепочки превращений. 12
Расчет молярной массы и массовой доли. 12
Блок №3 Расчеты молярных масс. 16
Химическая термодинамика. 16
Блок №4 Химическая термодинамика. 20
Химическая кинетика. 22
Блок №5. 25
Растворы.. 28
Блок №6. 32
Электролитическая диссоциация. 33
Блок №7. Электролитическая диссоциация. 36
Окислительно-восстановительные реакции. 38
Блок № 8 Окислительно-восстановительные реакции. 42
Гальванический элемент. 44
Блок №9. Гальванический элемент. 48
Коррозия металлов. 49
Блок №10. 52
Электролиз. 53
Блок №11. Процессы при электролизе. 54
Законы электролиза Фарадея. 55
Блок №12. Задачи по законам Фарадея. 56
Приложения. 58
Приложение 1. Периодическая таблица химических элементов. 58
Приложение 2. Названия важнейших кислот и их солей. 59
Приложение 3. Таблица растворимости кислот, солей и оснований в воде. 60
Приложение 4. Стандартные энтальпии (ΔH0298), энтропии (S0298) и энергии Гиббса (ΔG0298) образования некоторых веществ при 298 К. 61
Приложение 5. Стандартные электродные потенциалы. 63
Приложение 6. Элекрохимический ряд напряжений металлов. 65
НОМЕРА ЗАДАНИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
| № варианта | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 01 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 201 | 221 |
| 02 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 202 | 222 |
| 03 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 203 | 223 |
| 04 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 204 | 224 |
| 05 | 5 | 25 | 45 | 65 | 85 | 105 | 125 | 145 | 165 | 185 | 205 | 225 |
| 06 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 206 | 226 |
| 07 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 207 | 227 |
| 08 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 208 | 228 |
| 09 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 209 | 229 |
| 10 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 210 | 230 |
| 11 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 211 | 231 |
| 12 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
| 13 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 213 | 233 |
| 14 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 234 |
| 15 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 215 | 235 |
| 16 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 216 | 236 |
| 17 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 217 | 237 |
| 18 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 218 | 238 |
| 19 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 219 | 239 |
| 20 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 | 220 | 240 |
| 21 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 219 | 239 |
| 22 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 218 | 238 |
| 23 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 217 | 237 |
| 24 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 216 | 236 |
| 25 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 215 | 235 |
| 26 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 234 |
| 27 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 213 | 233 |
| 28 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
| 29 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 211 | 231 |
| 30 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 210 | 230 |
| 31 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 209 | 229 |
| 32 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 208 | 228 |
| 33 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 207 | 227 |
| 34 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 206 | 226 |
| 35 | 5 | 25 | 45 | 65 | 85 | 105 | 125 | 145 | 165 | 185 | 205 | 225 |
| 36 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 204 | 224 |
| 37 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 203 | 223 |
| 38 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 201 | 222 |
| 39 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 202 | 221 |
| 40 | 5 | 25 | 45 | 70 | 90 | 105 | 125 | 150 | 175 | 185 | 203 | 222 |
| 41 | 6 | 26 | 46 | 71 | 89 | 106 | 126 | 151 | 176 | 186 | 204 | 223 |
| 42 | 7 | 27 | 47 | 72 | 88 | 107 | 127 | 152 | 177 | 187 | 205 | 224 |
| 43 | 8 | 28 | 48 | 73 | 87 | 108 | 128 | 153 | 178 | 188 | 206 | 225 |
| 44 | 9 | 29 | 49 | 74 | 86 | 109 | 129 | 154 | 179 | 189 | 207 | 226 |
| 45 | 10 | 30 | 50 | 75 | 85 | 110 | 130 | 155 | 180 | 190 | 208 | 227 |
| 46 | 15 | 35 | 41 | 65 | 95 | 111 | 135 | 141 | 161 | 195 | 209 | 228 |
| 47 | 16 | 36 | 42 | 66 | 94 | 112 | 136 | 142 | 162 | 196 | 210 | 229 |
| 48 | 17 | 37 | 43 | 67 | 93 | 113 | 137 | 143 | 163 | 197 | 211 | 230 |
| 49 | 18 | 38 | 44 | 68 | 92 | 114 | 138 | 144 | 164 | 198 | 212 | 231 |
| 50 | 19 | 39 | 45 | 69 | 91 | 115 | 139 | 145 | 165 | 199 | 213 | 232 |
| 51 | 20 | 40 | 50 | 70 | 85 | 101 | 140 | 155 | 170 | 200 | 214 | 233 |
| 52 | 1 | 21 | 51 | 61 | 84 | 102 | 121 | 156 | 171 | 181 | 215 | 234 |
| 53 | 2 | 22 | 52 | 62 | 83 | 103 | 122 | 157 | 172 | 182 | 216 | 235 |
| 54 | 3 | 23 | 53 | 63 | 82 | 104 | 123 | 158 | 173 | 183 | 217 | 236 |
| 55 | 4 | 24 | 54 | 64 | 81 | 105 | 124 | 159 | 174 | 184 | 218 | 237 |
| 56 | 5 | 25 | 55 | 65 | 100 | 115 | 125 | 160 | 175 | 185 | 219 | 238 |
| 57 | 10 | 26 | 50 | 75 | 99 | 116 | 130 | 145 | 165 | 190 | 220 | 239 |
| 58 | 11 | 30 | 49 | 76 | 98 | 117 | 131 | 146 | 166 | 191 | 219 | 240 |
| 59 | 12 | 31 | 48 | 77 | 97 | 118 | 132 | 147 | 167 | 192 | 218 | 239 |
| 60 | 13 | 32 | 47 | 78 | 96 | 119 | 133 | 148 | 168 | 193 | 217 | 238 |
| 61 | 14 | 33 | 46 | 79 | 95 | 120 | 134 | 149 | 169 | 194 | 216 | 237 |
| 62 | 15 | 34 | 45 | 80 | 85 | 110 | 135 | 150 | 170 | 195 | 215 | 236 |
| 63 | 20 | 35 | 55 | 70 | 86 | 109 | 14 | 145 | 177 | 185 | 214 | 235 |
| 64 | 19 | 40 | 54 | 69 | 87 | 108 | 139 | 144 | 174 | 184 | 213 | 234 |
| 65 | 18 | 39 | 53 | 68 | 88 | 107 | 138 | 143 | 173 | 183 | 212 | 233 |
| 66 | 17 | 38 | 52 | 67 | 89 | 106 | 137 | 142 | 172 | 182 | 211 | 232 |
| 67 | 16 | 37 | 51 | 66 | 90 | 105 | 136 | 141 | 171 | 181 | 210 | 231 |
| 68 | 15 | 36 | 50 | 65 | 81 | 120 | 135 | 150 | 170 | 195 | 209 | 230 |
| 69 | 10 | 35 | 60 | 75 | 82 | 119 | 125 | 149 | 180 | 194 | 208 | 229 |
| 70 | 9 | 25 | 59 | 74 | 83 | 118 | 124 | 148 | 179 | 193 | 207 | 228 |
| 71 | 8 | 24 | 58 | 73 | 84 | 117 | 123 | 147 | 178 | 192 | 206 | 227 |
| 72 | 7 | 23 | 57 | 72 | 85 | 116 | 122 | 146 | 177 | 191 | 205 | 226 |
| 73 | 6 | 22 | 56 | 71 | 95 | 115 | 121 | 145 | 176 | 200 | 204 | 225 |
| 74 | 5 | 21 | 55 | 70 | 96 | 105 | 130 | 155 | 175 | 199 | 203 | 224 |
| 75 | 15 | 35 | 42 | 80 | 97 | 104 | 129 | 154 | 165 | 198 | 201 | 223 |
| 76 | 14 | 34 | 44 | 79 | 98 | 103 | 128 | 144 | 164 | 197 | 202 | 222 |
| 77 | 13 | 33 | 46 | 78 | 99 | 102 | 127 | 143 | 163 | 196 | 203 | 221 |
| 78 | 12 | 32 | 48 | 77 | 100 | 101 | 126 | 142 | 162 | 195 | 215 | 222 |
| 79 | 11 | 31 | 50 | 76 | 90 | 115 | 125 | 141 | 161 | 190 | 205 | 223 |
| 80 | 10 | 30 | 52 | 75 | 91 | 114 | 135 | 150 | 170 | 189 | 214 | 224 |
| 81 | 5 | 29 | 54 | 65 | 92 | 113 | 134 | 160 | 169 | 188 | 219 | 225 |
| 82 | 4 | 28 | 56 | 64 | 93 | 112 | 133 | 159 | 168 | 187 | 217 | 226 |
| 83 | 3 | 27 | 58 | 63 | 94 | 111 | 132 | 158 | 167 | 186 | 204 | 227 |
| 84 | 2 | 26 | 60 | 62 | 95 | 102 | 131 | 157 | 166 | 185 | 216 | 228 |
| 85 | 1 | 25 | 59 | 61 | 82 | 104 | 122 | 156 | 165 | 182 | 214 | 229 |
Таблица 1. Названия кислот и оснований.
основные
кислотные
амфотерные
Гидроксиды или основания – важная группа многоэлементных соединений, в состав которых входят металл и гидроксильные группы ОН.
Названия основных гидроксидов образуются из слова «гидроксид» и названия элемента в родительном падеже, после которого, в случае необходимости, римскими цифрами в скобках указывается степень окислеиности элемента. Например, LiOH — гидроксид лития, Fe(OH)2 — гидроксид железа (II).
Согласно теории электролитической диссоциации к ним относятся вещества, способные диссоциировать в растворе с образованием гидроксид-ионов, т. е. основные гидроксиды. Характерным свойством оснований является их способность взаимодействовать с кислотами, кислотными или амфотерными оксидами с образованием солей, например:
КOН + НСl ↔ КСl + Н2O,
Ва(ОН)2 + СO2 ↔ ВаСO3+Н2O,
2NaOH + Al2O3 ↔ 2NaAlO2+H2O.
С точки зрения протолитической (протонной) теории основаниями считают вещества, которые могут быть акцепторами протонов, т. е. способны присоединять ион водорода. С этих позиций к основаниям следует относить не только основные гидроксиды, но и некоторые другие вещества, например аммиак, молекула которого может присоединять протон, образуя ион аммония:
NH3+H+ ↔ NH4+.
Действительно, аммиак, подобно основным гидроксидам, способен реагировать с кислотами с образованием солей:
NH3+HCl ↔ NH4Cl.
В зависимости от числа протонов, которые могут присоединяться к основанию, различают основания однокислотные (например, LiOH, КОН, NH3), двукислотные (Са(ОН)2, Fe(OH)2) и т. д. Амфотерные гидроксиды способны диссоциировать в водных растворах как по типу кислот (с образованием катионов водорода), так и по типу оснований (с образованием гидроксильных анионов); они могут быть и донорами, и акцепторами протонов. Поэтому амфотерные гидроксиды образуют соли при взаимодействии как с кислотами, так и с основаниями. При взаимодействии с кислотами амфотерные гидроксиды проявляют свойства оснований, а при взаимодействии с основаниями — свойства кислот:
Zn(OH)2 + 2HCl = ZnCl2+2H2O,
Zn(OH)2+2NaOH = Na2ZnO2+2H2O
Кислоты ‑ HNO3, H2SO4 и др., а также вещества, способные проявлять как кислотные, так и основные свойства (амфотерные гидроксиды). По наличию кислорода в своем составе кислоты делятся на кислородсодержащие (например, H2SO4, HNO3) и бескислородные (например, HBr, H2S). По числу содержащихся в молекуле кислоты атомов водорода, способных замещаться атомами металла, различают кислоты одноосновные, двухосновные, трехосновные и т. д. Названия кислот производят от элемента, образующего кислоту. В случае бескислородных кислот к названию элемента, образующего кислоту, добавляют суффикс «о» и слово «водород»: HF ‑ фтороводород. Названия кислородсодержащих кислот зависят от степени окиcления кислотообразующего элемента. Максимальной степени окисления элемента соответствует суффикс «...-н(ая)» или «...-ов(ая)», например, HNO3 ‑ азотная кислота, НСlO4 ‑ хлорная кислота, Н2СгO4 ‑ хромовая кислота). По мере понижения степени окисления суффиксы изменяются в следующей последовательности: «...-оват(ая)», «...-ист(ая)», «...-оватист(ая)»; например, НСlO3 ‑ хлорноватая, НСlO2 — хлористая, НОС1 — хлорноватистая кислоты. Если элемент образует кислоты только в двух степенях окисления, то для названия кислоты, соответствующей низшей степени окисления элемента, используется суффикс «...-ист(ая)»; например, HNO2 ‑ азотистая кислота. Если элемент, находясь в одной и той же степени окисления, образует несколько кислот, содержащих по одному атому данного элемента в молекуле (например, НРO3 и Н3РO4), то название кислоты, содержащей наименьшее число атомов кислорода, снабжается приставкой «мета-…», а название кислоты с наибольшим числом атомов кислорода — приставкой «орто-…» (НРO3 — метафосфорная кислота, Н3РO4 — ортофосфорная кислота).
|
Таблица 2. Названия кислот. | |||
| Формула | Образующий элемент | Степень окисления | название |
| HCl H2S | Хлор (Cl) Сера (S) | ‑1 ‑2 | Хлороводородная Сероводородная |
| НОСl | Хлор (Cl) | +1 | Хлорноватистая |
| НClO2 HNO2 | Хлор (Cl) Азот (N) | +3 +3 | Хлористая Азотистая |
| НСlO3 | Хлор (Cl) | +5 | Хлорноватя |
| H2SO4 HNO3 НСlO4 Н2СгO4 | Сера (S) Азот (N) Хлор (Cl) Хром (Cr) | +6 +5 +7 +6 | Серная Азотная Хлорная Хромовая |
| НРO3 Н3РO4 | Фосфор (P) Фосфор (P) | +5 +5 | Метафосфорная Ортофосфорная |
Важный класс неорганических соединений, выделяемый по функциональным признакам, составляют кислоты. С позиций теории электролитической диссоциации к кислотам относятся вещества, способные диссоциировать в растворе с образованием ионов водорода. С точки зрения протолитической (протонной) теории кислот и оснований кислотами называются вещества, которые могут быть донорами протонов, т. е. способны отдавать ион водорода.
Характерным свойством кислот является их способность взаимодействовать с основаниями, основными и амфотерными оксидами с образованием солей, например:
2HNO3 + Cu(OH)2 ↔ Cu(NO3)2 + 2H2O,
2НС1 + СаО ↔ СаС12 + Н2O,
Н2SO4 + ZnО ↔ ZnSO4 + Н2О
Соли можно рассматривать как продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла или как продукты полного или частичного замещения гидроксогрупп в молекуле основного гидроксида кислотными остатками. При полном замещении атомов водорода в молекуле кислоты образуются средние (нормальные) соли, при неполном ‑ кислые соли (гидросоли). Кислые соли образуются многоосновными кислотами. При частичном замещении гидроксогрупп в молекуле основного гидроксида кислотными остатками образуются основные соли (гидроксосоли). Основные соли могут быть образованы только многокислотными гидроксидами. Кислые соли получаются при взаимодействии кислот с основаниями в тех случаях, когда количество взятого основания недостаточно для образования средней соли, например:
H2SO4 + NaOH ↔ NaHSO4 + H2O.
Основные соли образуются в тех случаях, когда взятого количества кислоты недостаточно для образования средней соли, например:
Fe(OH)3+H2SO4 ↔ FeOHSO4+2H2O.
Названия солей составляют из названия аниона кислоты в именительном падеже и названия катиона в родительном падеже (хлорид натрия, сульфат меди и т. п.). При этом название аниона производят от корня латинского наименования кислотообразующего элемента. Степень окислениости металла, образующего катион, указывают, если необходимо, римскими цифрами в скобках. В случае бескислородных кислот, анион получает окончание «ид». Например, соли NaBr, FeS, KCN соответственно называются бромид натрия, сульфид железа (II), цианид калия. Названия анионов кислородсодержащих кислот получают окончания и приставки в соответствии со степенью окислениости кислотообразующего элемента. Высшей степени окислениости («... ная» или «... овая» кислота) отвечает окончание «ат»; так, соли серной кислоты называются сульфатами, хромовой — хроматами и т. д. Более низкой степени окислениости («... истая» кислота) соответствует окончание «ит»; например, соли сернистой кислоты — сульфиты, азотистой — нитриты и т. д. Если существует кислота с еще более низкой степенью окислениости кислотообразующего элемента «... оватистая» кислота), ее анион получает приставку «гипо» и окончание «ит»; так соли хлорноватистой кислоты НОСl называют гипохлоритами. Соли некоторых кислот в соответствии с исторически сложившейся традицией сохранили названия, отличающиеся от систематических. Так, соли марганцовой (НМnO4), хлорной (НСlO4), йодной (НIO4) кислот называют соответственно перманганатами (KМnO4), перхлоратами (NaСlO4) и перйодатами (KIO4).
Названия важнейших кислот и их солей приведены в Приложении 2.
Названия кислых солей образуют так же, как и средних, но при этом добавляют приставку «гидро», указывающую на наличие незамещенных атомов водорода, число которых обозначают греческими числительными (ди, три и т. д.). Например, Ва(НСО3)2 ‑ гидрокарбонат бария, NaH2AsO4 ‑ дигидроортоарсенат натрия, LiHS ‑ гидросульфид лития. Названия основных солей тоже образуют подобно названиям средних солей; но при этом добавляют приставку «гидроксо», указывающую на наличие незамещенных гидроксогрупп. Так, FeOHCl ‑ хлорид гидроксожелеза (II), (NiOH)2SO4 ‑ сульфат гидроксоникеля (II), Al(OH)2NO3 ‑ нитрат дигидроксоалюминия.
Существуют соединения элементов с кислородом, которые по составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды, или перекиси. Пероксидами называются соли пероксида водорода Н2O2, например, Na2O2, CaO2. Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода («кислородный мостик»): ‑-O-O-.
| Таблица 3. Сводная таблица взаимодействий между классами неорганических соединений | ||||||||
| Металл | Неметалл | Основной оксид | Кислотный оксид | Кислота | Гидроксид | Соль | Вода | |
 Металл Металл
| Сплав | Соль Или оксид | Соль | Соль + H2 | Метал + гидроксид | Соль + металл | гидроксид + H2 | |
| Неметалл | Соль Или оксид | Соль + H2O | ||||||
| Основной оксид | Соль | Соль + H2O | Основание | |||||
| Кислотный оксид | Соль | Соль | кислота | |||||
| Кислота | Соль + H2 | Соль + H2O | Соль + H2O | Соль + кислота | ||||
| Гидроксид | Метал + гидроксид | Соль + H2O | Соль + H2O | |||||
| Соль | Соль + металл | Соль + кислота | Новые соли | Гидролиз по кислоте или по основанию | ||||
| Вода | гидроксид + H2 | Основание | кислота | Гидролиз по кислоте или по основанию | ||||
Пример 1.
Дано вещество H2O, нужно найти его молярную массу.
Рассматриваем формулу и определяем, что молекула состоит из 2 атомов водорода и 1 атома кислорода. Тогда масса молекулы воды будет равна:
M(H2O) = M(H)*2+M(O)
Теперь в периодической таблице (см. Приложение №1) находим массы указанных атомов и подставляем значения в уравнение.
M(H2O) = M(H)*2+M(O)=1*2+16=18 (а.е.м. – для молекулы и г/моль – для 1 моля воды)
M(H2O)=18 г/моль.
Пример 2.
Дано вещество CuSO4, нужно найти его молярную массу.
Рассматриваем формулу и определяем, что молекула состоит из 2 атомов водорода 1 атома серы и 4 атомов кислорода. Тогда масса молекулы этого вещества будет равна:
M(CuSO4) = M(Cu)+M(S)+M(O)*4
Теперь в периодической таблице (см. Приложение №1) находим массы указанных атомов и подставляем значения в уравнение.
M(CuSO4) = M(Cu)+ M(S)+M(O)*4=63,55+32+16*4=159,55 (а.е.м. – для молекулы и г/моль – для 1 моля)
M(CuSO4)=159,55 г/моль.
Пример 3.
Дано вещество CuSO4*5H2O, нужно найти его молярную массу.
Представленное вещество является кристаллогидратом, и состоит из связанных молекул CuSO4 и H2O. Для нас важно, что одна молекула CuSO4 связывает 5 молекул воды. Это нужно принимать во внимание при составлении уравнения.
M(CuSO4*5H2O) = M(CuSO4)+5*M(H2O)
Сделав такое представление, можно увидеть, что представленная задача распалась на две предыдущие. Решение этой задачи будет комбинированием действий из примеров 1 и 2.
M(CuSO4*5H2O)=M(CuSO4)+5*M(H2O)=63,55+32,07+16*4+5*(1*2+16)
M(CuSO4*5H2O)= 249,62 г/моль.
Пример 4.
Дано вещество Арктит Na5BaCa7(PO4)6F3, нужно найти его молярную массу.
Подход для решения поставленной задачи такой же, как в первых двух примерах.
M(Na5BaCa7(PO4)6F3)=M(Na)*5+M(Ba)+M(Ca)*7+(M(P)+M(O)*4)*6+M(F)*3.
После записи такого уравнения обращаемся к периодической таблице (см. Приложение №1) и используем массы указанных веществ.
M(Na5BaCa7(PO4)6F3)=M(Na)*5+M(Ba)+M(Ca)*7+(M(P)+M(O)*4)*6+M(F)*3 M(Na5BaCa7(PO4)6F3)=22,99*5+137,33+40,08*7+30,97+16*4=627,81.
M(Na5BaCa7(PO4)6F3)=627,81 г/моль
Следующим этапом расчетных задач является определение того или иного вещества, содержащегося в какой либо смеси или минерале. Например, сколько цинка можно извлечь из 245 килограммов ганита (Ганит ‑ ZnAl2O4)? Для решения таких задач, необходимо определить молярные массы цинка (заданного элемента) и самого минерала (вещества).
Пример 5
Сколько цинка можно извлечь из 245 килограммов ганита (Ганит - ZnAl2O4)?
1. Определить молярную массу цинка. Находим ее в периодической таблице.
2. Определить молярную массу всего вещества. Делаем это аналогично предыдущим примерам.
M(Zn)=65,39
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
3. Следующий наш шаг – это использование пропорции.
По расчету определили, что в 183,35 граммах ганита содержится 65,39 граммов цинка.
Тогда в 245 килограммах содержится X килограммов цинка.
Эти рассуждения представим в виде пропорции:
| 183,35 г ZnAl2O4 | ~ | 65,39 г. Zn |
| 245 кг ZnAl2O4 | ~ | X кг Zn |
| 183,35 г | = | 65,39 г |
| 245 кг | X кг |
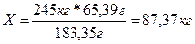
Решая данную пропорцию, мы получаем искомый ответ: 87,37 кг цинка можно получить из 245 кг ганита.
В случае, если нужно определить содержание алюминия в ганите, нужно учесть, что в отличие от цинка, алюминия содержится 2 в соответствии с формулой. Тогда для учета этого отличия рассмотрим следующий пример.
Пример 6
Сколько алюминия можно извлечь из 245 килограммов ганита. (Ганит - ZnAl2O4)?
В целом все операции те же, что и в предыдущем примере.
1. Определить молярную массу алюминия. Находим ее в периодической таблице .
2. Определить молярную массу всего вещества. Делаем это аналогично предыдущим примерам.
M(Al)=26,98
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
3. Следующий наш шаг – учесть, что нужно использовать удвоенную массу алюминия, так как после алюминия в формуле ганита стоит индекс 2 (ZnAl2O4).
4. После этого можно приступать к составлению пропорции
По расчету определили, что в 183,35 граммах ганита содержится 26,98*2 граммов алюминия.
Тогда в 245 килограммах содержится X килограммов цинка.
Эти рассуждения представим в виде пропорции:
| 183,35 г ZnAl2O4 | ~ | 26,98*2 г. Al |
| 245 кг ZnAl2O4 | ~ | X кг Al |
| 183,35 г | = | 26,98*2 г |
| 245 кг | X кг |
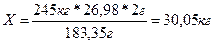
Решая данную пропорцию, мы получаем искомый ответ: 30,05 кг алюминия можно получить из 245 кг ганита.
В каждом из последних двух примеров можно определить массовую долю цинка или алюминия в ганите. Рассмотрим такую задачу отдельно.
Пример 7.
Определите массовую долю цинка и алюминия в ганите (ZnAl2O4)
1. Определить молярную массу цинка. Находим ее в периодической таблице.
Определить молярную массу всего вещества.
M(Zn)=65,39
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
Разделить молярную массу алюминия на молярную массу всего соединения.
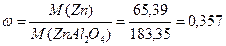 ;
;
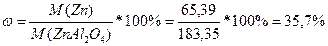
2. Определить молярную массу алюминия. Находим ее в периодической таблице.
Определить молярную массу всего вещества.
M(Al)=26,98
M(ZnAl2O4)=M(Zn)+M(Al)*2+M(O)*4=65,39+26,98*2+16*4=183,35
Разделить молярную массу всего алюминия на молярную массу всего соединения.
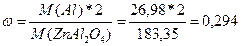 ;
;
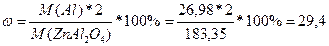 %
%
* Примечание: можно округлять до целых.
Химическая термодинамика.
К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия Н, энтропия S и энергия Гиббса (изобарно-изотермический потенциал) G. Все эти величины представляют собой функции состояния, т. е. зависят только от состояния системы, но не от способа, которым это состояние достигнуто.
Протекание химической реакции связано с разрушением старых химических связей и образованием новых. Каждой химической связи отвечает определенная энергия. Соответственно протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (ΔU < 0), то реакция протекает с выделением энергии (экзотермические реакции). Если же внутренняя энергия системы возрастает (ΔU > 0), то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
Изменение внутренней энергии или энтальпии принято относить к тому случаю, когда все исходные вещества и все продукты реакции находятся в стандартных состояниях. Стандартным состоянием вещества при данной температуре называется его состояние в виде чистого вещества при давлении (в случае газов — при парциальном давлении данного газа), равном нормальному атмосферному давлению (101325 Па). Условия, при которых все участвующие в реакции вещества находятся в стандартных состояниях, называются стандартными условиями протекания реакции. (ΔU° — стандартное изменение внутренней энергии при химической реакции, ΔН° — стандартное изменение энтальпии при химической реакции или стандартная энтальпия реакции).
Стандартная энтальпия реакции образования 1 моля данного вещества из простых веществ называется стандартной энтальпией образования этого вещества. Эту величину обычно выражают в килоджоулях на моль (кДж/моль).
Энтальпия и внутренняя энергия образования простых веществ, согласно приведенному определению, равны нулю. Если элемент образует несколько простых веществ (графит и алмаз, белый и красный фосфор и т. п.), то стандартным считается состояние элемента в виде наиболее устойчивой при данных условиях модификации (например, при обычных условиях — графит в случае углерода, О2 в случае кислорода и т. д.); энтальпия и внутренняя энергия образования этой, наиболее устойчивой модификации принимаются равными нулю. Химические уравнения, в которых указаны изменения энтальпии (тепловые эффекты реакций), называются термохимическими уравнениями. Например, уравнение
РЬО(к.) + СО(г.) = РЬ(к.) + СO2(г.), ΔH° = ‑ 64 кДж
означает, что при восстановлении 1 моля РЬО оксидом углерода (II) выделяется количество теплоты, равное 64 кДж. Сокращения «к.», «ж.» и «г.» в таких уравнениях указывают соответственно на кристаллическое, жидкое или газообразное состояние вещества.
В основе термохимических расчетов лежит следствие закона сохранения энергии (закон Гесса):
Тепловой эффект химической реакции (т.е. изменение энтальпии или внутренней энергии системы в результате реакции) зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса.
Важным для расчетов является еще одно следствие из закона Гесса:
Пример 1.
Исходя из теплоты образования газообразного диоксида углерода (ΔH° = —393,5 кДж/моль) и термохимического уравнения
| С(графит) | + | 2N2O(г.) | → | СO2(г.), | + | 2N2(г.) | ΔHo1=‑557,5 кДж | (1) |
вычислить теплоту образования N2O(г.).
Для решения этой задачи обозначим искомую величину через X и запишем термохимическое уравнение образования N2O из простых веществ:
| N2(r.) | + | 1/2O2(r.) | → | N2O(r.), | ΔHo2=X кДж | (2) |
Для решения задачи так же понадобится теплота образования CO2 из простых веществ:
| С(графит) | + | O2(г.) | СO2(г.) | ΔН°3 = ‑393,5 кДж | (3) |
Для простоты понимания введем замену так, чтобы получить привычный математический вид:
| C(графит) | – | A |
| N2O(г.) | – | B |
| CO2(г.) | – | C |
| N2(г.) | – | D |
| O2(г.) | – | E |
Тогда мы получим систему уравнений:
A+2*B=C+2*D (1)
D+1/2E=B (2)
A+E=C (3)
Искомым в этом случае является уравнение (2), значит, комбинируя уравнения (1) и (3) нам нужно получить уравнение (2).
Нужно помнить, что правую часть складываем с правой частью, а левую ‑ с левой.
Вычтем из уравнения (1) уравнение (3):
(A+2*B) ‑ (A+E) = (C+2*D) ‑ C
2*B ‑ E =2*D
2*D+E=2*B
Разделим полученное уравнение на 2 и получим:
D+1/2E=B
Таким образом, получаем:
((1) – (3))/2 = (2)
Разделив разность уравнений (1) и (3) на 2, получим термохимическое уравнение интересующей нас реакции (2):
| N2(r.) | + | 1/2O2(r.) | → | N2O(r.), | ΔHo2=X кДж | (2) |
Тогда проделаем те же действия с энтальпиями этих реакций:
(ΔH1 – ΔH3)/2 =ΔH2.
(‑557,5 – (–393,5))/2 = X
Что равнозначно обозначениям разбираемой задачи: Тогда, используя данные задачи, для искомой величины найдем:
ΔH2° = (‑557,5 кДж – (–393, 5 кДж))/2 = 82,0 кДж .
ΔH°N2O(г.) = 82,0 кДж/моль.
Пример 2.
Определить стандартное изменение энтальпии ΔH° реакции горения метана
СН4 (г.) + 2O2 (г.) = СO2 (г.) + 2Н2О (г.) (ΔH1 – ?) (1)
Зная, что энтальпии образования O2(г.), СO2 (г.), Н2O (г.) и СН4 (г.).
| ΔHO2(г.) | = | 0 | кДж/моль |
| ΔHСO2(г.) | = | -393,5 | кДж/моль |
| ΔHН2O(г.) | = | -241,8 | кДж/моль |
| ΔHСН4(г.) | = | -74,9 | кДж/моль |
Для решения запишем термохимические уравнения реакций образования СO2, Н2О и СН4:
| С(графит) | + | O2(г.) | → | СO2(г.), | ΔHCO2=‑393,5 кДж | (2) |
| Н2(г.) | + | 1/2 O2(г.) | → | Н2O(г.), | ΔHH2O= ‑241,8кДж | (3) |
| С(графит) | + | 2Н2 (г.) | → | СН4(г.), | ΔHCH4=‑74,9 кДж | (4) |
Для простоты понимания введем замену так, чтобы получить привычный математический вид:
| C(графит) | = | A |
| O2(г.) | = | B |
| CO2(г.) | = | C |
| H2(г.) | = | D |
| H2O(г.) | = | E |
| CH4(г.) | = | F |
Тогда мы получим систему уравнений:
A+B=C (2)
D+1/2B=E (3)
A+2D=F (4)
Из этих трех уравнений нужно получить следующее:
F+2B=C+2E (1)
Нужно помнить, что правую часть складываем с правой, а левую ‑ с левой.
(A+B) + 2*(D+1/2B) ‑ (A+2D)=C + 2*E ‑ F
A+B+2*D+B‑A‑2*D=C+2*E – F
2*B+F=C+2*E
Таким образом, получаем:
(2)+2*(3) – (4) = (1)
Сложив уравнение (2) с удвоенным уравнением (3) и вычтя из найденной суммы уравнение (4), получим термохимическое уравнение интересующей нас реакции (1). Тогда проделаем те же действия с энтальпиями этих реакций:
ΔH1 = ΔH2 + 2*ΔH3 – ΔH4.
Что равнозначно обозначениям разбираемой задачи:
ΔH1 = ΔHCO2 + 2*ΔHH2O – ΔHCH4.
Тогда, используя данные задачи, для искомой величины найдем:
X = –393, 5 – 241, 8 * 2 + 74,9 = –802,2.
Что соответствует следующему уравнению:
ΔH1° = –393,5 кДж – 241, 8 * 2 кДж + 74,9 кДж = –802,2 кДж.
Последний пример иллюстрирует важное следствие закона Гесса, применение которого упрощает многие термохимические расчеты:
Стандартное изменение энтальпии химической реакции равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
В связи с тем, что теплоты образования важных и часто используемых собраны в специальные таблицы, то следует научиться самим пользоваться такими таблицам. Разберем следующий пример используя Таблицу 5 в Приложении.
Пример 3. Пользуясь данными Приложения 4 приложения, вычислить ΔH° реакции:
2 Mg (к.) + СO2 (г.) = 2 MgО (к.) + С (графит).
Решение. Находим в Приложении 4 стандартные энтальпии образования СО(г) и MgO равны соответственно кДж/моль. Запишем стандартные энтальпии образования для указанного уравнения:
2 ΔH°Mg (к.) + ΔH°СO2 (г.) = 2 ΔH°MgО (к.) + ΔH°С (графит).
Для нахождения ΔH° реакции вычтем из энтальпий продуктов энтальпии исходных веществ этой реакции. То есть вычтем из правой части левую. Учтем, что ΔH° простых веществ равна нулю. И подставим значения ΔH°СO2 (г.) и ΔH°MgО (к.) из таблицы. Перепишем предыдущее уравнение в математическом цифровом виде и преобразуем:
ΔH°=(2ΔH°MgО (к.) + ΔH°С (графит)) – (2 ΔH°Mg (к.) + ΔH°СO2 (г.))
ΔH°=(2*(‑601,8) кДж/моль + 0 кДж/моль) – (2*0 кДж/моль + (‑393,5) кДж/моль).
ΔH°=2*(‑601,8) кДж/моль ‑ (‑393,5) кДж/моль
ΔH°= ‑1203,6 кДж/моль+393,5 кДж/моль
ΔH°=‑810,1 кДж/моль.
Химическая кинетика
В данном разделе речь пойдет о скорости химической реакции. Скорость характеризует направление и быстроту перемещения, то есть изменение координаты в единицу времени. В зависимости от выбранного направления скорость можно представить:
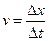 , или в обратном направлении:
, или в обратном направлении: 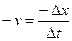
Скорость также может характеризовать изменение какой-либо величины: массы, объема в единицу времени. Химическая реакция как любой процесс происходит во времени, поэтому также характеризуется скоростью и направлением. В этом случае будет изменяться количество вещества в единицу времени. Количество вещества характеризуется концентрацией. Следовательно, скорость химической реакции определяется изменением концентрации в единицу времени:
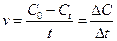 ,
,
здесь C0 – концентрация вещества в начальный момент времени, Ct – концентрация в момент времени t.
В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (молекул, атомов), зависимость скорости реакции от концентраций определяется законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Так, для реакции типа
А + В2 → АВ2
закон действия масс выражается следующим образом:
v = k*[A]*[B2].
В этом уравнении [А] и [В2] ‑ концентрации вступающих в реакцию веществ, а коэффициент пропорциональности k ‑ константа скорости реакции, значение которой зависит от природы реагирующих веществ.
В тех случаях, когда для протекания реакции необходимо столкновение трех реагирующих частиц (молекул, атомов), Гораздо реже реакция осуществляется путем столкновения трех реагирующих частиц. Например, реакция типа
А + 2В → АВ2
может протекать по механизму тройных столкновений:
А + В + В → АВ2 .
В этом случае, в соответствии с законом действия масс, можно записать
v = k*[A]*[В]*[В], т. е. v = k*[А]*[В]2 .
Одновременное столкновение более чем трех частиц крайне маловероятно. Поэтому реакции, в уравнения которых входит большое число частиц, протекают в несколько стадий. В подобных случаях закон действия масс применим к отдельным стадиям процесса, но не к реакции в целом.
В реакционной среде происходит конкуренция прямой и обратной реакций:
А + В ↔ C+D,
которые можно представить так:
А + В → C+D – прямая реакция
C+D → А + В – обратная реакция.
Здесь возникают понятия конкуренции реакций и направления протекания реакции. Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения концентраций, участвующих в реакции веществ не происходит.
В случае обратимой химической реакции
A+B↔C+D
зависимость скоростей прямой (v→) и обратной (v←) реакций от концентраций реагирующих веществ выражается соотношениями:
v→ = k→*[А]*[В]; v←= k←*[С]*[D].
В состоянии химического равновесия v→=v←, т. е.
k→*[А]*[В] = k←*[С]*[D]
В условиях равновесия, пользуясь правилом пропорциональных отношений, можно записать следующее:
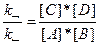 ;
; 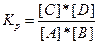
Здесь Кр — константа равновесия реакции.
Концентрации, входящие в выражение константы равновесия, называются равновесными концентрациями. Константа равновесия — постоянная при данной температуре величина, выражающая соотношение между равновесными концентрациями продуктов реакции и исходных веществ.
В тех случаях, когда для протекания реакции необходимо столкновение трех реагирующих частиц (молекул, атомов). Например, реакция типа
A + 2B → C+2D
может протекать по механизму тройных столкновений:
A+B+B → C+D+D
В этом случае, константу равновесия в соответствии, можно записать так:
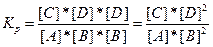
Тогда аналогично можно записать химическую реакцию и константу равновесия для нее в общем виде:
aА + bВ → cС+dD
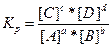
В выражение константы равновесия гетерогенной реакции, как и в выражение закона действия масс, входят только концентрации веществ, находящихся в жидкой или газообразной фазе, так как концентрации твердых веществ остаются, как правило, постоянными.
Если имеется равновесие химической реакции, то его модно сместить в сторону прямой или обратной реакции. Для этого можно изменить следующие факторы:
1 ‑ концентрация веществ;
2 – давление;
3 – температура.
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Рассмотрим на примерах, как смещается равновесие.
Пример 1. Влияние концентрации на химическое равновесие.
2 NO(г) + O2(г) ↔ 2NO2(г); ΔHo298= ‑ 113,4 кДж/моль.
При введении в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличиваем концентрации NO или O2, значит, увеличиваем количество столкновений исходных веществ, увеличиваем скорость прямой реакции, смещаем равновесие в сторону образования NO2.
Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Пример 2. Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону. В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два.
2 NO(г) +1 O2(г) ↔ 2NO2(г);
При увеличении давления равновесии сместится в сторону меньшего объема (меньшего числа молей), то есть в сторону образования NO2. Уменьшение давления сместит равновесие в обратную сторону.
Если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Пример 3. Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции. Это согласуется с принципом Ле Шателье. Если в ходе прямой реакции выделяется тепло, а мы отводим тепло, по равновесие сместится в сторону продуктов. Если нагреваем реакционную зону, то равновесие сместится в сторону исходных веществ.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
2 NO(г) + O2(г) ↔ 2NO2(г); ΔHo298= ‑ 113,4 кДж/моль.
ΔHo298= ‑ 113,4 кДж/моль, значит, в ходе реакции выделяется тепло, повышается температура. Соответственно повышение температуры сместит равновесие в сторону исходных веществ.
Пример 4. Влияние температуры на скорость химической реакции.
Растворение образца сульфида цинка в соляной кислоте при 18оС заканчивается через 2,25 минуты, а при 38оС такой же образец соли растворяется за 0,25 минуты. За какое время данный образец растворится при 48оС?
Для решения воспользуемся уравнением Вант-Гоффа. Переведем все значения в систему Си.
2,25 минут = 135 секунд
0,25 минут = 15 секунд
18оС = 291 К
38оС = 311 К
48оС = 321 К
Вспомним, что скорость химической реакции равна обратному времени реакции:
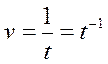
Подставим данные из задачи в уравнение:
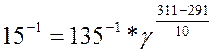
Найдем отсюда значение коэффициента γ:
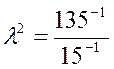
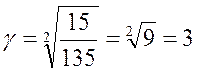
Зная коэффициент γ, легко найдем скорость реакции при температуре 48 оС:
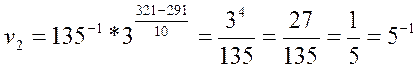
Растворение образца сульфида цинка в соляной кислоте при 48оС протекает со скоростью v=0,2 с-1.
Блок №5.
81. Напишите выражение для константы равновесия экзотермической реакции:
СО+Cl2 → COCl2; ΔHo = ‑111 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
82. Напишите выражение для константы равновесия экзотермической реакции:
S + O2 → SO2 + 279 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
83. Напишите выражение для константы равновесия:
2CO+O2 → 2CO2, ΔHo = ‑571 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
84. Напишите выражение для константы равновесия:
SO2 + 1/2O2→SO3, ΔHo = ‑96,3 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
85. Напишите выражение для константы равновесия:
С + H2O→CO + H2 ‑ 117 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
86. Напишите выражение для константы равновесия:
2NO + O2→2NO2 + 70,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
87. Напишите выражение для константы равновесия:
СН4 + 2O2 →CO2 + H2O (г), ΔН =‑802,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
88. Напишите выражение для константы равновесия экзотермической реакции:
СО + H2O→CO2 + H2; ΔHo= 2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 3 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
89. Напишите выражение для константы равновесия:
С + 2N2O → CO2 + 2 N2 + 557,5 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
90. Напишите выражение для константы равновесия:
FeO + CO →CO2 + Fe + 18,2 кДж/моль.
Как изменится скорость прямой реакции при увеличении концентрации реагирующих веществ в 2 раза? В какую сторону сместится равновесие при увеличении давления и уменьшении температуры?
91. Напишите выражение для константы равновесия экзотермической реакции:
СО + Cl2→COCl2; ΔHo = ‑111 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
92. Напишите выражение для константы равновесия:
S + O2→SO2 + 279кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
93. Напишите выражение для константы равновесия:
2CO + O2→2 CO2, ΔH =‑571 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
94. Напишите выражение для константы равновесия:
SO2 + 1/2 O2→SO3, Δ H =‑96,3 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
95. Напишите выражение для константы равновесия:
С + H2O→CO + H2 ‑ 117 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
96. Напишите выражение для константы равновесия:
2NO + O2→2NO2 + 70,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
97. Напишите выражение для константы равновесия:
СН4 + 2 O2→CO2 + H2O(г), Δ Н =‑802,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
98. Напишите выражение для константы равновесия экзотермической реакции:
СО + H2O→CO2 + H2 ΔHo= 2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
99. Напишите выражение для константы равновесия:
С + 2N2O→CO2 + 2N2 + 557,5 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
100.Напишите выражение для константы равновесия:
FeO + CO→CO2 + Fe + 18,2 кДж/моль.
Как изменится скорость обратной реакции при уменьшении объема системы в 2 раза? Как следует изменить температуру, давление, чтобы сместить равновесие в сторону прямой реакции?
Растворы
К расчетным задачам также относятся и задачи на приготовление растворов. Содержание растворенного вещества в растворе может быть выражено либо безразмерными единицами — долями или процентами, либо величинами размерными — концентрациями. (Концентрация – это содержание чего-либо в чем-либо: соли в воде, кислоты в воде, воды в кислоте и т.д.). Массовая доля более широкое понятие, и его мы ввели выше:
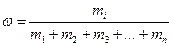 ;
; 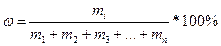
Это понятие также справедливо и для растворов:
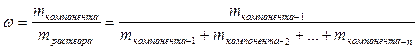 ;
; 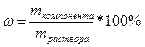
Таким образом, встречается понятие растворов 10 %-ной (25 %-ной, 12 %-ной и т.д.) концентрации.
Для практических расчетов по изменению концентрации раствора или по приготовлению раствора заданной концентрации удобно использовать «правило креста». Суть этого правила или метода расчета сводится к графической записи задачи, из которой смешиваем раствор и воду (растворитель), смешиваем раствор и чистое вещество, с которым готовим раствор (сухую навеску соли, чистое жидкое вещество)
Случай 1
Нужно приготовить раствор KOH с концентрацией 15% из растворов KOH с концентрациями 5% и 60%.
 W1 W1
| 
| |w2-w3| | 15-5=10 |
|  W3 W3
| ||
| W2 | |w1-w3| | 60-15=45 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 10 массовых частей раствора с концентрацией 60% и 45 частей с концентрацией 5%. Далее нам поможет применение пропорции:
45+10=55 - пусть 250 граммов раствора, тогда
10 ‑ х
45 – у
Х=10*250/55=45,45 г.
У=45*250/55=204,54 г.
Случай 2
Нужно приготовить раствор KOH с концентрацией 15% из раствора KOH с концентрацией 60%. В этом случае подразумевается, что этот раствор нужно разбавить водой до нужной концентрации. В этом случае в качестве второго раствора будет выступать раствор с концентрацией ω=0% (содержание вещества в чистой вожже = 0).
 W1 W1
| 
| |w2-w3| | 15-0=15 |

|  W3 W3
| ||
| W2 | |w1-w3| | 60-15=45 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 15 массовых частей раствора с концентрацией 60% и 45 частей с концентрацией 5%. Далее нам поможет применение пропорции:
45+15=60 - пусть 250 граммов раствора, тогда
15 ‑ х
45 – у
Х=15*250/60=62,5 г
У=45*250/60=187,5 г
Случай 3
Нужно приготовить раствор KOH с концентрацией 15% из раствора KOH с концентрацией 5% и сухой навески KOH. Здесь сухой гидроксид калия KOH не содержит воды, то есть его концентрация ω=100%.
 W1 W1
| 
| |w2-w3| | 15-5=10 |
|  W3 W3
| ||
| W2 | |w1-w3| | 100-15=85 |
Таким образом, мы нашли, что для приготовления раствора с концентрацией 15 % нам нужно взять 85 массовых частей раствора с концентрацией 5% и 10 частей с концентрацией 100%. Далее нам поможет применение пропорции:
10+85=95 - пусть 250 граммов раствора, тогда
10- х
85 – у
Х=10*250/95=26,31 г.
У=85*250/95=223,68 г.
Массовая доля завязана на массу, а работать удобнее с объемами. Поэтому нужно ввести и использовать понятие плотности. Фактически, плотность – это масса фиксированного объема (масса одного литра, масса одного миллилитра).
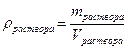
Рассмотрим использование плотности и массовой доли на следующем примере:
Пример 1
Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл) необходим для приготовления 300 мл 15%-ного раствора с плотностью 1,09 г/мл.
Для решения данной задачи нужно понимать, что в ней два присутствуют раствора с разными параметрами.
«Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл)» ‑ первый раствор.
«300 мл 15%-ного раствора с плотностью 1,09 г/мл» ‑ второй раствор.
Кроме того, задачу удобно решить с конца.
Так как для второго раствора фиксировано количество, то мы можем найти массу растворенного вещества (KOH), которое нужно для его приготовления.
У нас есть плотность и объем, а из них находится масса раствора:
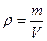 ;
; 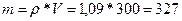 ;
; 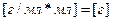
Масса раствора 327 граммов, в котором 15% ‑ это масса KOH, а 85% ‑ это вода.
Для определения массы чистого KOH нужно воспользоваться формулой массовой доли:
15% ~ 0,15
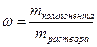 ;
; 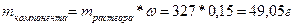
Так определена масса вещества, необходимая для приготовления второго раствора. А берем мы ее из первого. Однако это масса чистого вещества, а у нас есть только раствор. Тогда нужно вычислить массу раствора через массовую долю:
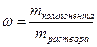 ;
; 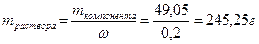
На этом этапе нужно провести оценку разумности результатов. Обратим внимание на концентрации и массы растворов, принимая во внимание, что количество растворенного вещества одинаково. Раствор с большей концентрацией (ω=20%) имеет меньшую массу m=245,25г, чем раствор с меньшей концентрацией (ω=15%) m=327г. Такое соотношение разумно и логично, значит, ход решения идет верно. Если же возникла обратная зависимость, то следует проверить решение на наличие ошибок.
Следующий шаг – вычислить объем первого раствора, зная его массу и плотность:
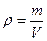 ;
; 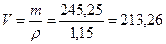 ;
; 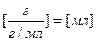
Таким образом, ответ в данной задаче:
213,26 мл 20%-ного раствора гидроксида натрия необходим для приготовления 300 мл 15%-ного раствора.
Рассмотрим для наглядности эту задачу в виде таблицы:
Шаг 1:
Заполним таблицу данными из задачи. Обозначим искомую величину за X. Заметим, что последняя строка mвещества – имеет одинаковые значения по условию задачи. То есть, mвещества1=mвещества2
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | --- |
| mвещества, г | --- | --- |
Шаг 2:
Вычисляем массу раствора 2:
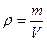 ;
; 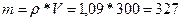 ;
; 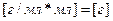
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | 327 |
| mвещества, г | (одно значение) | |
Шаг 3:
Вычисляем массу растворенного вещества:
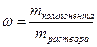 ;
; 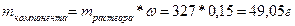
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | --- | 327 |
| mвещества, г | ||
49,05
Шаг 4:
Вычисляем массу первого раствора:
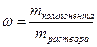 ;
; 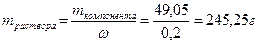
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | X | 300 |
| mраствора, г | 245,25 | 327 |
| mвещества, г | 49,05 | |
Шаг 5 :
Вычисляем искомый объем первого раствора:
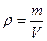 ;
; 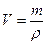 ;
; 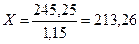 ;
; 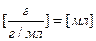
| Параметры | Раствор 1 | Раствор 2 |
| ω, % | 20% | 15% |
| ρ, г/мл | 1,15 | 1,09 |
| V, мл | 213,26 | 300 |
| mраствора, г | 245,25 | 327 |
| mвещества, г | 49,05 | |
Обозначим искомую величину за X
Искомое значение X (объем первого раствора с ω=20%) найдено: X=213,26 мл.
Блок №6.
101.К 0.5 литрам 15 % раствора серной кислоты (плотность 1.1 г/мл) добавили 60 мл воды. Определить концентрацию полученного раствора.
102.Вычислить массовую долю в процентах раствора хлорида калия, если в 2 литрах раствора содержится 10 г соли. Плотность раствора принять за единицу.
103.Какой объем 96 %-ного раствора серной кислоты с плотностью 1,84 г/мл необходим для приготовления 250 мл 20 % раствора.
104.Определить массовую долю в % раствора гидроксида калия, полученного смешением 100 мл 10 %-ного раствора (плотность 1,08 г/мл) и 200 мл 30%-ного раствора с плотностью 1,29 г/мл.
105.Определить массовую долю в процентах раствора серной кислоты, если к 200 мл 50%-ного раствора с плотностью 1,43 г/мл прибавили 500 мл воды.
106.Какую массу соли и какой объем воды нужно взять для приготовления 2 литров 20 %-ного раствора (плотность 1,1 г/мл ).
107.Какой объем 20%-ного раствора гидроксида натрия (плотность 1,15 г/мл ) необходим для приготовления 300 мл 15%-ного раствора с плотностью 1,09 г/мл.
108. Вычислить процентную концентрацию раствора хлорида натрия, если в 500 мл раствора содержится 50 грамм соли. Плотность раствора принять за единицу.
109.Какой объем 25%-ного раствора серной кислоты (плотность 1,18 г/мл ) надо взять для приготовления 1 л 12%-ного раствора с плотностью 1,08 г/мл?
110.Вычислить процентную концентрацию раствора соляной кислоты, полученного смешением 200 г 10% раствора и 250 мл 25% раствора с плотностью 1,17 г/мл.
111.Какой объем 10% раствора гидроксида натрия (плотность 1.1 г/мл) необходим для приготовления 5% раствора массой 100г.
112.Какова процентная концентрация раствора гидроксида натрия, полученного смешением 500 мл 5% раствора (плотность 1,05 г/мл) и 200 г 10% раствора.
113.Из 400 г 20% (по массе) раствора при охлаждении выделилось 50 г растворенного вещества. Чему равна массовая доля этого вещества в оставшемся растворе?
114.Определите массу гидроксида натрия, который надо взять для приготовления 200 мл раствора с массовой долей NaOH 30% (плотность раствора 1,33 г/мл).
115.Какой объем раствора с массовой долей серной кислоты 88% (плотность 1,8 г/мл) надо взять для приготовления 300 мл раствора с массовой долей кислоты 40% (плотность 1,3г/мл).
116.Сколько мл 74% серной кислоты (плотность 1,664 г/мл) потребуется для приготовления 250 г 20% раствора серной кислоты?
117.До какого объёма надо разбавить 500 мл 20% (по массе) раствора хлорида натрия (плотность 1.152 г/мл), чтобы получить 4.5%-ный раствор (плотность 1.029 г/мл).
118.Определите массовую долю вещества в растворе НСl, полученном смешением 300г 25%- ного и 400 г 40% - ного (по массе) растворов этого вещества.
119.Сколько воды надо прибавить к 100 мл 20 % раствора серной кислоты с плотностью 1.14 г/мл, чтобы получить 5 % раствор серной кислоты?
120.Из 400 г 50% (по массе) раствора серной кислоты выпариванием удалили 100г воды. Чему равна массовая доля серной кислоты в оставшемся растворе?
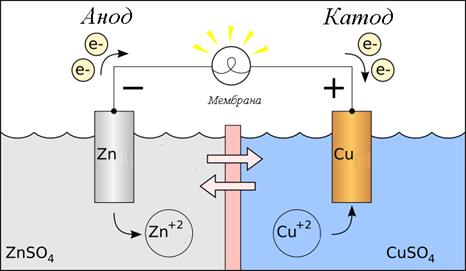
Гальванический элемент
Гальванический элемент – это устройство или система, где химическая энергия превращается в электрическую. Существует множество вариантов гальванических элементов, где суть сведена к тому, что есть два электрода, разделенные электролитом. И внутри системы происходит окислительно-восстановительная реакция.
Электрод ‑ электронно-проводящая фаза (материал), контактирующий с ионным проводником (электролитом). Переносит заряд без переноса вещества, носители заряда – электроны. В упрощенном виде электрод – это система, состоящая из металла, погруженного в раствор собственной соли (электролит) см. рис. 1.
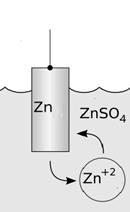
| Рис. 1. Пример электрода. Металлическая пластина (Zn) опущена в раствор соли (ZnSO4). |
На границе металл – раствор устанавливается равновесие:
Zn0 ↔ Zn2++2e‑
Электрод характеризуется электродной реакцией и стандартным электродным потенциалом (φ0). В зависимости от направления выбранной реакции будет меняться знак стандартного электродного потенциала.
Zn0 → Zn2++2e‑; φ0= + 0,76 В.
Zn2++2e‑ → Zn0; φ0= ‑ 0,76 В.
Если есть стандартный электродный потенциал, то есть и нестандартный электродный потенциал, который зависит от концентрации (давления) и температуры и определяется уравнением Нернста (при условии, что активность равна концентрации):
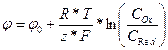 ;
;
где: φ ‑ электродный потенциал (В), φ0 – стандартный электродный потенциал (В), R – универсальная газовая постоянная (8,314 Дж/моль*К), T – абсолютная температура (К), F – постоянная Фарадея (96485,55 Кл/моль), z – число электронов, участвующих в процессе, COx и CRed – концетнрации окисленной и восстановленной форм вещества участвующего в реакции.
Электролит – это фаза (материал), которая проводит электрический ток при переносе вещества. Носителями заряда здесь являются ионы, а перенос электронов через эту фазу пренебрежимо мал. В упрощенном виде электролит – это ионпроводящее вещество. Электролитом может быть раствор, расплав или твердое вещество, отвечающее заявленным требованиям.
Гальванический элемент (химический источник тока) – система, состоящая из двух электродов, разделенных электролитом. На одном электроде будет происходить окисление (Анод), на втором – восстановление (катод).
Для работы с гальваническим элементом нужно уметь записать его схему, рассчитать его разность потенциалов (ЭДС – электродвижущую силу), определить и записать потенциал-образующую реакцию, записать уравнения электродных процессов.
Схемы гальванических элементов могут быть записаны так:
Zn|Zn2+||Cu2+|Cu
(‑) А Zn|ZnSO4||CuSO4|Cu К (+)
При записи схемы гальванического элемента руководствуются следующими правилами:
1 слева записываем того, кто окисляется, справа того – кто восстанавливается.
2 окислителем будет более электроположительный элемент (см. ряд напряжений металлов)
3 граница электрод/электролит (твердое/жидкое) обозначается одной вертикальной чертой: Zn|Zn2+; Cu2+|Cu.
4 разделение электролитов (жидкое/жидкое, мембрана, солевой мостик) – обозначается двумя вертикальными чертами: Zn2+||Cu2+; ZnSO4||CuSO4.
Подход 1.
Принимается, что ЭДС равна разнице потенциалов катода и анода, то есть:
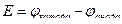
Запишем для гальванического элемента Zn|Zn2+||Cu2+|Cu:
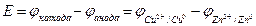
В этом случае используются уравнения и потенциалы, приведенные в таблицах стандартных электродных потенциалов (Приложение 5):
Анод: Zn2++2e‑ → Zn0; 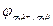 = ‑ 0,76 В.
= ‑ 0,76 В.
Катод: Cu2++2e‑ → Cu0; 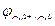 = + 0,52 В.
= + 0,52 В.
Е = 0,52 – (‑0,76)=0,52+0,76=1,28 В.
Подход 2.
Для расчета ЭДС запишем анодный и катодный процессы для гальванического элемента Zn|Zn2+||Cu2+|Cu в том виде, в котором они протекают:
Анод: Zn0 → Zn2++2e‑; 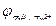 = + 0,76 В.
= + 0,76 В.
Катод: Cu2++2e‑ → Cu0; 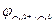 = + 0,52 В.
= + 0,52 В.
Тогда нужно просто сложить значения потенциалов реакций:
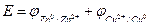
Е = 0,52+0,76=1,28 В.
Если ЭДС>0, значит, реакция протекает самопроизвольно, а схема гальванического элемента и решение верны. Если ЭДС<0, значит, в решении присутствует ошибка.
Пример 1. Цинк-медный гальванический элемент.
Составьте схему, напишите уравнения электродных процессов, вычислите ЭДС гальванического элемента, образованного стандартными электродами цинка и меди.
Нужно заметить, что здесь не указаны растворы, поэтому выберем растворы растворимых солей: ZnSO4 и CuSO4.
Для простоты восприятия можно нарисовать рисунок, этот рисунок можно использовать как основу для записи схему гальванического элемента:
| Рис. 2. Цинк-медный гальванический элемент. Для разделения пространств вблизи электродов используют мембрану или солевой мостик, суть которых не допустить смешивания раствором. На этой границе происходит смена носителя заряда. | |
|
| |
| Здесь происходит окисление цинка в соответствии с уравнением: Zn0 → Zn2++2e‑; φ0= + 0,76 В. Значит, здесь анод и анодное пространство. | Здесь происходит восстановление меди в соответствии с уравнением: Cu2++2e‑ → Cu0; φ0= + 0,52 В. Значит, здесь катод и катодное пространство. |
| Уравнения для электродных реакций можно найти в справочниках, и в Приложении 5, там же можно посмотреть значения стандартных электродных потенциалов (Приложении 6). | |
| На границе происходит растворение цинка, т.е. металлический цинк переходит в раствор сульфата цинка (ZnSO4) в виде иона (Zn2+). Это можно записать так: Zn|Zn2+ Zn|ZnSO4 | На границе происходит осаждение меди, т.е. медь из раствора сульфата меди (CuSO4) переходит в металлическое состояние и оседает на электроде в виде металла (Cu0). Это можно записать так: Cu2+|Cu CuSO4|Cu |
| Эти два процесса разделены пространственно мембраной, то есть их нужно записать в одну строку и разделить двумя чертами: | |
| Zn|Zn2+||Cu2+|Cu Zn|ZnSO4||CuSO4|Cu | |
| Теперь добавим обозначение анода и катода: | |
| (‑) А Zn|Zn2+||Cu2+|Cu К (+) (‑) А Zn|ZnSO4||CuSO4|Cu К (+) | |
Таким образом, записана схема гальванического элемента. Уравнения электродных процессов были определены в самом начале:
Zn0 → Zn2++2e‑; φ0= + 0,76 В;
Cu2++2e‑ → Cu0; φ0= + 0,52 В.
Теперь нужно вычислить разность потенциалов этого элемента (или ЭДС). Для этого нужно воспользоваться простой математической формулой:
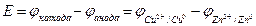
В этом случае используются следующие реакции и их потенциалы:
Zn2++2e‑ → Zn0; 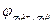 = ‑ 0,76 В.
= ‑ 0,76 В.
Cu2++2e‑ → Cu0; 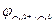 = + 0,52 В.
= + 0,52 В.
Е = 0,52 – (‑0,76)=0,52+0,76=1,28 В.
Пример 2. Концентрационный гальванический элемент.
Вычислите ЭДС гальванического элемента Ni|Ni(NO3)2(0,001 Н)||NiCl2(0,1 Н)|Ni. Напишите уравнения электродных процессов.
В задаче дана схема элемента – это половина задачи.
Распишем анодный процесс:
Ni0→Ni2++2e‑; φ0=0,25 В.
В задаче указана концентрация раствора, что говорит об отклонении от стандартного электродного потенциала. Тогда используем уравнение Нернста и рассчитаем значение потенциала для анода:
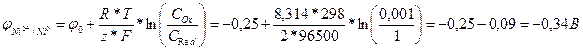 ;
;
Распишем катодный процесс:
Ni2++2e‑ →Ni0; φ0=‑0,25 В.
Используя уравнение Нернста, рассчитаем значение потенциала для катода:
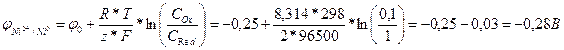 ;
;
Следующим этапом вычислим ЭДС представленного гальванического элемента:
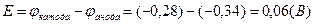
Коррозия металлов
Коррозия – это самопроизвольное окисление металла в результате взаимодействия с окружающей средой. Коррозия возникает в результате окисления металла кислородом воздуха, водородом, водой или другим металлом. Тема коррозии имеет довольно большой практический аспект, так как встречается практически во всех сферах, где имеет место металлическое изделие: от заборов и опор мостов до корпусов кораблей и автомобилей.
Интересным случаем является коррозия сплавов во влажной среде или при непосредственно контакте с жидкостями (растворы солей, кислот, щелочей).
Тогда образуется гальваническая пара (локальный гальванический элемент) и возникает электрохимическая коррозия.
Наиболее распространенными окислителями (деполяризаторами) являются молекулы растворенного в воде кислорода (О2), сами молекулы воды (Н2О) и катионы водорода (Н+). Как правило, в коррозионной среде присутствуют все три деполяризатора. Какой из них будет определять протекание катодного процесса, зависит от соотношения их концентраций, что обусловлено реакцией среды (кислая, нейтральная, щелочная).
Для анализа покрытия, расчета коррозионной защиты и определения, какой материал окисляется в первую очередь, рассматривают работу гальванической пары.
1. Составляют схему гальванической пары:
Me1 | среда | Me2.
2. Выписывают стандартные потенциалы металлов и окислителей коррозионной среды (Приложение 5), определяют восстановитель (меньший потенциал), окислитель (больший потенциал).
3. Записывают уравнения процессов окисления и восстановления и суммарное уравнение окислительно-восстановительной реакции, протекающей при электрохимической коррозии.
4. Указывают направление движения электронов.
Пример 1. Окисление железа во влажной среде. Окислитель – кислород. Результат – образование ржавчины Fe(OH)3.
4Fe+ 6Н2О + ЗО2 → 4Fe(OH)3
Пример 2. Напишите уравнения электродных процессов коррозии пары алюминий – олово с кислородной деполяризацией
Для того чтобы понять, какой элемент будет восстановителем и какой окислителем, нужно посмотреть на электрохимический ряд напряжений металлов. Для нас важно, что правый элемент будет окислять левый, или более электроположительный элемент окисляет более электроотрицательный. Так алюминий стоит левее олова (Приложение 6). По условию в процессе коррозии могут участвовать алюминий, олово и кислород, выпишем уравнения электродных процессов для каждого элемента и сравним потенциалы этих реакций.
Al3++3e‑→Al0; φ= ‑ 1,6 В;
Sn2++2e‑→Sn0; φ= ‑ 0,14В.
O2 + 2H2O + 4e‑ → 4OH‑; φ= 0,4В.
Очевидно, что на аноде будет происходить окисление алюминия. Поскольку в задаче речь идет о кислородной деполяризации, то на катоде будет происходить восстановление кислорода. Тогда можно записать следующие реакции:
Анодный процесс: Al0 – 3e‑ → Al3+;
Катодный процесс: O2 + 2H2O + 4e‑ → 4OH‑.
Так как ионы Al3+ с гидроксид-ионами ОН‑ образуют нерастворимый гидроксид (см. таблицу растворимости ‑ Приложение 3), то продуктом коррозии будет Al(OH)3.
Для защиты изделий от коррозии по механизму защиты различают анодные и катодные металлические покрытия. Металл анодных покрытий имеет электродный потенциал более отрицательный, чем потенциал защищаемого металла (железо, покрытое цинком). Соответственно, металл катодных покрытий имеет электродный потенциал более положительный, чем потенциал защищаемого металла (железо, покрытое медью.)
В обоих случаях образуется гальваническая пара или гальванический элемент:
Анодное покрытие: (‑) А Zn|Zn2+||Fe2+|Fe К (+)
Катодное покрытие: (‑) А Fe|Fe2+||Cu2+|Cu К (+)
В первом случае железо является катодом и принимает электроны, а значит, конструкция будет устойчива, пока сохраняется какое-либо количество цинка. Во втором же случае железо будет расходоваться в первую очередь, так как медь оттягивает электроны. Здесь важна целостность покрытия.
Пример 3. Железное изделие покрыли свинцом. Что происходит при коррозии этого изделия в морской воде? Напишите уравнения электродных процессов.
Сравним потенциалы желез и свинца (см. Приложение табл №):
Fe2++2e‑→Fe0; φ= ‑0,44 В.
Pb2++2e‑→Pb0; φ= ‑0,12 В.
В состав морской воды входят соли щелочных и щелочноземельных металлов (K+, Na+, Mg2+, Ca2+, Cl‑, SO42‑), которые не могут окислить железо или свинец. Окислителем будет выступать кислород воздуха или кислород, растворенный в воде.
O2 + 2H2O + 4e‑ → 4OH‑; φ= 0,4В.
Очевидно, что на аноде будет происходить окисление железа. Поскольку задача аналогична предыдущему примеру, а речь идет о кислородной деполяризации, то на катоде будет происходить восстановление кислорода. Тогда можно записать следующие реакции:
Анодный процесс: Fe0 – 2e‑ → Fe2+;
Катодный процесс: O2 + 2H2O + 4e‑ → 4OH‑.
Продуктами коррозии будут хлорид и сульфат железа (FeCl2, FeSO4).
Особенность влияния морской воды заключается в том, что хлорид-ионы (Cl‑) снимают пассивирующую оксидную пленку с изделий и ускоряют коррозию.
Пример 4. Коррозия в разных средах. Железное изделие покрыли хромом. Что происходит при коррозии этого изделия в щелочной среде? Напишите уравнения электродных процессов.
Сравним потенциалы желез и хрома (Приложение 5):
Fe2++2e‑→Fe0; φ= ‑0,44 В.
Cr3++3e‑→Cr0; φ= ‑0,74 В.
В аэрированной (насыщенной кислородом) нейтральной и щелочной среде (рН>7) деполяризация протекает с участием кислорода и воды (Приложение 5):
О2 + 2Н2О + 4е‑ → 4ОН‑, φ= 0,4 В.
В деаэрированной (освобожденной от кислорода) нейтральной и щелочной среде (рН>7) деполяризация протекает с участием воды (Приложение 5):
2Н2О + 2е‑ → Н2 ↑ +2ОН‑, φ= ‑0,83 В.
Определим, насыщенная ли кислородом среда, и выберем катодный процесс из возможных:
O2 + 2H2O + 4e‑ → 4OH‑; φ= 0,4В.
Теперь сравним потенциалы реакций и определим анодный и катодный процессы:
Анодный процесс: Cr0 → Cr3++3e‑;
Катодный процесс: O2 + 2H2O + 4e‑ → 4OH‑.
В избытке гидроксид-ионов (OH‑) будет образовываться нерастворимый гидроксид хрома (Cr(OH)3).
Пример 5. Коррозия в разных средах. Железное изделие покрыли хромом. Что происходит при коррозии этого изделия в кислой среде? Напишите уравнения электродных процессов.
Сравним потенциалы желез и хрома (Приложение 5):
Fe2++2e‑→Fe0; φ= ‑0,44 В.
Cr3++3e‑→Cr0; φ= ‑0,74 В.
Подберем уравнение восстановления кислорода для кислой среды (Приложение 5)
O20+ 4H+ + 4e‑ → 2H2O; φ= +1,23 В.
Кроме того, может также восстанавливаться водород:
2H+ + 2e‑ → H20; φ= 0,00 В.
Теперь сравним потенциалы реакций, определим реакцию среды по условиям эксплуатации изделия и определим анодный и катодный процессы. Допустим, что изделие находится открытой зоне и при избытке кислорода. Самый отрицательный потенциал у хрома, а самый положительный у кислорода:
Анодный процесс: Cr0 → Cr3++3e‑;
Катодный процесс: O20+ 4H+ + 4e‑ → 2H2O ‑.
| Среда | Кислая, pH<7 | Щелочная, нейтральная. pH≥7 |
| Насыщенная кислородом | O20+ 4H+ + 4e‑ → 2H2O; φ= +1,23 В. | О2 + 2Н2О + 4е‑ → 4ОН‑; φ= 0,4 В. |
| Освобожденная от кислорода | 2H+ + 2e‑ → H20; φ= 0,00 В. | 2Н2О + 2е‑ → Н2 ↑ +2ОН‑; φ= ‑0,83 В. |
Блок №10.
181.Назовите несколько металлов, которые могут служить для анодного покрытия железа. Что произойдет при нарушении защитного покрытия в растворе щелочи?
182.Составьте электронные уравнения анодного и катодного процессов с кислородной деполяризацией при коррозии пары никель – медь.
183.В раствор соляной кислоты поместили цинковую пластинку, частично покрытую медью. Напишите уравнения электродных процессов.
184.Железное изделие покрыто хромом. Как будет корродировать это изделие при нарушении покрытия во влажном воздухе?
185.Какой металл целесообразнее взять для протекторной защиты трубопровода, изготовленного из железа: никель, хром, цинк, олово? Напишите уравнения электродных процессов.
186.Как происходит атмосферная коррозия луженой меди при нарушении защитного покрытия? Напишите уравнения электродных процессов.
187.Выберите металлы для анодного покрытия кобальта: цинк, медь, олово, никель.
188.Приведите пример протекторной защиты железа от коррозии в электролите, содержащем растворенный кислород.
189.Железное изделие покрыли кадмием. Что происходит при коррозии этого изделия в морской воде? Напишите уравнения электродных процессов.
190.Как происходит коррозия хрома, находящегося в контакте с оловом в кислом растворе? Напишите уравнения электродных процессов.
191.Составьте электронные уравнения анодного и катодного процессов с водородной деполяризацией при коррозии пары магний – хром.
192.В раствор щелочи поместили пластинку никеля, частично покрытую кадмием. Напишите уравнения электродных процессов.
193.Железное изделие покрыли свинцом. Что происходит при коррозии этого изделия в растворе щелочи? Напишите уравнения электродных процессов.
194.Какой металл целесообразней взять для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, медь, магний, хром? Напишите уравнения электродных процессов.
195.Выберите металлы для катодного покрытия кадмия: магний, никель, хром, цинк, железо? Что произойдет при нарушении защитного покрытия в щелочной среде? Напишите уравнения электродных процессов.
196.Назовите несколько металлов, которые могут служить для катодного покрытия железа. Что произойдет при нарушении защитного покрытия в кислой среде?
197.Напишите уравнения электродных процессов коррозии пары алюминий – никель с кислородной деполяризацией.
198.Как происходит коррозия цинка, находящегося в контакте с кадмием в нейтральном растворе? Напишите уравнения электродных процессов.
199.Составьте электронные уравнения анодного и катодного процессов с водородной деполяризацией при коррозии пары магний – хром.
200.Какой металл целесообразней взять для протекторной защиты от коррозии железа: никель, цинк, магний, хром? Напишите уравнения электродных процессов.
Электролиз
Электролиз – это окислительно‑восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиз сегодня широко применяется для очистки металлов, нанесения покрытий и изготовления изделий. Во время электролиза происходит превращения электрической энергии в химическую.
На практике имеет значение правильная сборка схемы и подбор материала электродов. Важно помнить, что на аноде происходит окисление, на катоде ‑ восстановление. В зависимости от состава электролита и материала электрода, на электродах будут происходить разные процессы. Электроды могут участвовать в процессе и расходоваться или же не участвовать (инертные электроды).
Результирующую электрохимических потенциалов при электролизе называют поляризацией. Ее можно определить аналогично ЭДС, то есть:
E= φкатода ‑ φанода
или же, если реакции электродные процессы записаны в прямом направлении:
E= φкатодного процесса + φанодного процесса
Пример 1. Электролиз расплава хлорида натрия. Составьте уравнения электродных процессов, протекающих при электролизе раствора хлорида натрия и расплава хлорида натрия. Электроды инертны.
В расплаве присутствуют только ионы натрия (Na+) и хлора (Cl‑). Тогда справедливо будет записать анодный и катодный процессы так:
(А): Cl−‑2e‑→Cl20↑, φ= ‑1,36 В.
(К): Na++e‑→Na0↓, φ= ‑2,71 В.
Обе реакции записаны в прямом направлении, тогда можно определить напряжение электролиза:
E= φкатодного процесса + φанодного процесса= ‑2,71+(‑1,36)= ‑4,07 В.
Пример 2. Электролиз расплава хлорида натрия.
В растворе хлорида натрия присутствуют следующие ионы: Na+, Cl‑, H+, OH‑. Поэтому на электродах могут происходить параллельные реакции:
(А): Cl−‑2e‑→Cl20↑, φ= ‑1,36 В.
4OH‑→ O20↑ + 2H2O + 4e‑, φ= ‑0,4 В.
(К): Na++e‑→Na0↓, φ= ‑2,71 В.
2H+ + 2e‑ = H20↑, φ= 0,00 В.
2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Все реакции записаны в прямом направлении. Первыми на электродах начнутся те реакции, чьи потенциалы больше ( ‑0,4 В > ‑1,36 В; 0,83 >0,00 > ‑2,71 В)
(А): 4OH‑→ O20↑ + 2H2O + 4e‑, φ= ‑0,4 В.
(К): 2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Определим напряжение электролиза:
E= φкатодного процесса + φанодного процесса= ‑0,4+(0,83)= 0,43 В.
Пример 3. Составьте уравнения электродных процессов, протекающих при электролизе раствора нитрат никеля с угольными электродами; с никелевым анодом.
В растворе нитрата никеля присутствуют следующие ионы: Ni+, NO3‑, H+, OH‑. Поэтому на электродах могут происходить параллельные реакции.
При условии угольных электродов могут происходить следующие электродные реакции:
(А): 4OH‑→ O20↑ + 2H2O + 4e‑, φ= ‑0,4 В.
(К): Ni2++2e‑→Ni0↓, φ= ‑0,25 В.
2H+ + 2e‑ = H20↑, φ= 0,00 В.
2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Все реакции записаны в прямом направлении. Первыми на электродах начнутся те реакции, чьи потенциалы больше (0,83 >0,00 > ‑0,25 В).
(А): 4OH‑→ O20↑ + 2H2O + 4e‑, φ= ‑0,4 В.
(К): 2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Определим напряжение электролиза:
E= φкатодного процесса + φанодного процесса= ‑0,4+(0,83)= 0,43 В.
При условии никелевого анода могут происходить следующие электродные реакции:
(А): 4OH‑→ O20↑ + 2H2O + 4e‑, φ= ‑0,4 В.
Ni0→ Ni2++2e‑, φ= 0,25 В.
(К): Ni2++2e‑→Ni0↓, φ= ‑0,25 В.
2H+ + 2e‑ = H20↑, φ= 0,00 В.
2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Все реакции записаны в прямом направлении. Первыми на электродах начнутся те реакции, чьи потенциалы больше (0,25 > ‑0,4 В; 0,83 >0,00 > ‑0,25 В)
(А): Ni0→ Ni2++2e‑, φ= 0,25 В.
(К): 2H2O + 2e‑ = H20↑ + 2OH‑, φ= 0,83 В.
Определим напряжение электролиза:
E= φкатодного процесса + φанодного процесса= 0,25+0,83= 1,08 В.
Законы электролиза Фарадея
Первый закон электролиза Фарадея: масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод.
m~q или m=K*q,
где m ‑ масса вещества, q – количество электричества (электрический заряд, измеряемый в кулонах; q=I*t, сила тока, прошедшая через электролизер и умноженная на время пропускания тока), K – электрохимический эквивалент вещества.
Второй закон электролиза Фарадея: для данного количества электричества масса химического элемента, осаждённого на электроде, прямо пропорциональна эквивалентной массе элемента. Эквивалентной массой вещества является его молярная масса, делённая на целое число, зависящее от химической реакции, в которой участвует вещество.
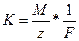 ,
,
где K – электрохимический эквивалент вещества; M – молярная масса элемента; z – заряд элемента; F – постоянная Фрадея (96485 Кл/моль≈96500 Кл/моль).
Для решения практических и теоретических задач используют объединенное выражение законов Фарадея:
При электролизе также имеет место выход по току. Выход по току – это выраженное в процентах отношение количества фактически затраченного электричества (Qфакт) к теоретически необходимому(Qтеор). Также может быть использована степень отклонения от массы фактически прореагировавшего на электроде вещества (mфакт) к теоретически рассчитанной по закону Фарадея(mтеор):
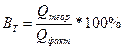 ;
; 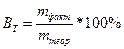 ;
; 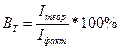
Для решения расчетных задач на тему законов электролиза Фардея необходимо пользоваться объединенным выражением и корректно записать все элементы выражения в системе СИ.
Важно помнить, что mтеор>mфакт; Iфакт>Iтеор
Пример 1. При электролизе в течении 1 часа водного раствора нитрата висмута (Bi(NO3)3) на катоде выделилось 14 грамм висмута (Bi). Выход по току составляет 94 %. Вычислите силу тока.
В этой задаче необходимо использовать оба выражения, приведенные выше. Сначала придется определить теоретическую силу тока:
m = 14 граммов.
z = 3 (Bi3+)
F = 96500 Кл/моль
I = ? А
t = 3600 секунд
M = 208,98 г/моль
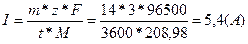
В задаче приводится BT=94%. Используем выражения для выхода по току и рассчитаем фактическую силу тока:
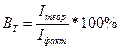 ;
; 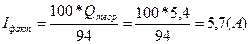
Приложения.
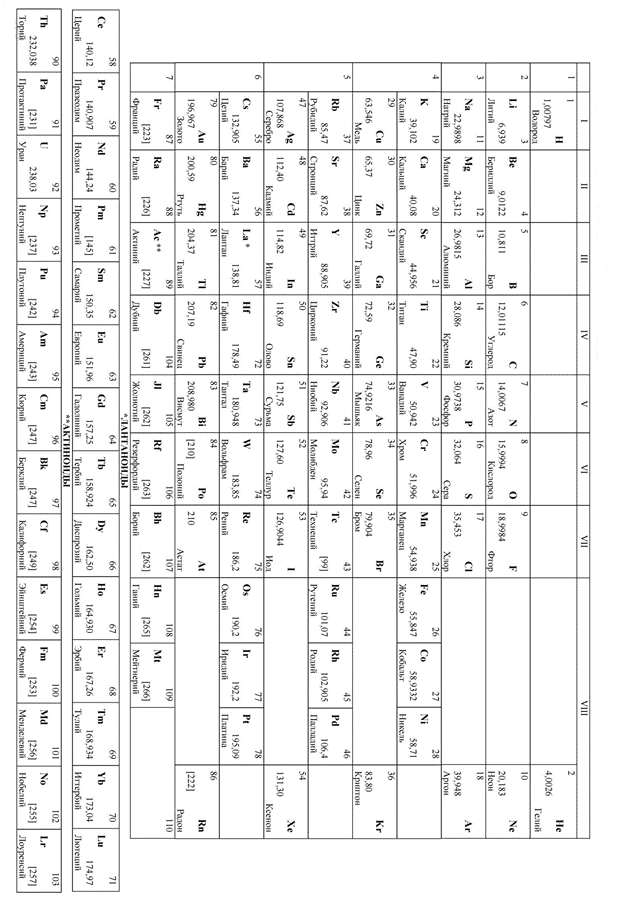
| Приложение 1. Периодическая таблица химических элементов. |
Приложение 2. Названия важнейших кислот и их солей.
| Формула | Образующий элемент | Степень окисления | название | соль |
| HF | Фтор (F) | -1 | Фтороводородная (Плавиковая) | Фторид |
| HBr | Бром (Br) | -1 | Бромоводородная | Бромид |
| HJ | Йод (J) | -1 | Йодоводородная | Йодид |
| HJO3 | Йод (J) | +5 | Йодноватая | Йодат |
| HCl | Хлор (Cl) | ‑1 | Хлороводородная (Соляная) | Хлорид |
| НСlO3 | Хлор (Cl) | +5 | Хлорноватя | Хлорат |
| НClO4 | Хлор (Cl) | +7 | Хлорная | Перхлорат |
| H2S | Сера (S) | ‑2 | Сероводородная | Сульфид |
| H2SO3 | Сера (S) | +4 | Сернистая | Сульфит |
| H2SO4 | Сера (S) | +6 | Серная | Сульфат |
| H2S2O3 | Сера (S) | +6 (‑2) | Тиосерная | Тиосульфат |
| HNO2 | Азот (N) | +3 | Азотистая | Нитрит |
| HNO3 | Азот (N) | +5 | Азотная | Нитрат |
| Н2СгO4 | Хром (Cr) | +6 | Хромовая | Хромат |
| НРO3 Н3РO4 | Фосфор (P) Фосфор (P) | +5 +5 | Метафосфорная Ортофосфорная | Метафосфат Ортофосфат |
| HMnO4 | Марганец(Mn) | +7 | Марганцовая | Перманганат |
| H3BO3 | Бор (B) | +3 | Отоборная | Ортоборат |
| H2CO3 | Углерод (C) | +4 | Угольная | Карбонат |
| H2SiO3 | Кремний (Si) | +4 | Кремниевая | Силикат |
| HCN | Циановодородная | Цианид | ||
| HSCN | Родановодородная | Роданид | ||
| HCOOH | Муравьиная | Формиат | ||
| CH3COOH | Уксусная | Ацетат | ||
| COOH-COOH | Щавелевая | Оксолат | ||
| C2H5OH | Этиловый спирт | Этилат |
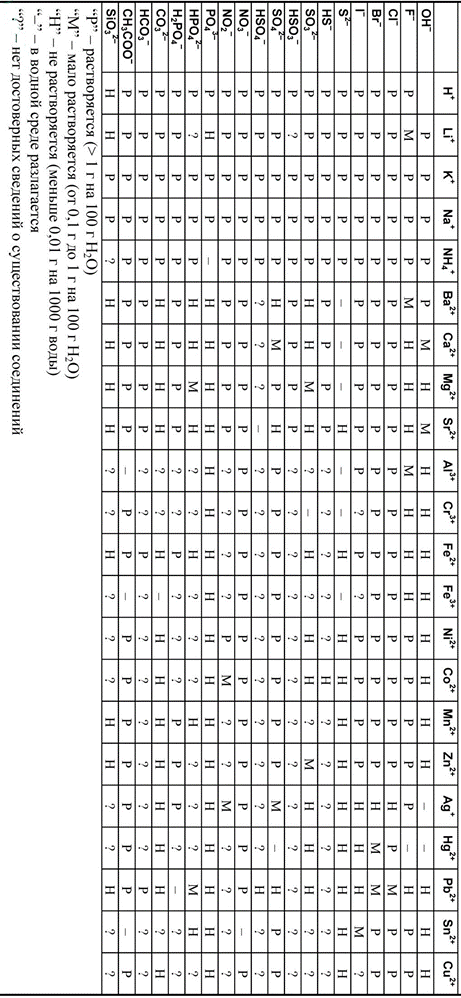
| Приложение 3. Таблица растворимости кислот, солей и оснований в воде. |
| Приложение 4. Стандартные энтальпии (ΔH0298), энтропии (S0298) и энергии Гиббса (ΔG0298) образования некоторых веществ при 298 К. | |||
| Вещество | ΔH0298, кДж/моль | S0298, кДж/моль | ΔG0298, кДж/моль |
| Al2O3 (к.) | -1676,0 | 50,9 | -1582,0 |
| C (графит) | 0 | 5,7 | 0 |
| CCl4 (ж.) | -132,8 | 216,2 | -62,7 |
| CH4 (г.) | -74,9 | 186,3 | -50,8 |
| C2H2 (г.) | 226,8 | 200,8 | 209,2 |
| C2H4 (г.) | 52,3 | 219,4 | 68,1 |
| C2H6 (г.) | -89,7 | 229,5 | -32,9 |
| C6H6 (ж.) бензол | 49,1 | 173,3 | 124,4 |
| C6H6 (г.) бензол | 82,9 | 269,2 | 129,7 |
| CH3OH (ж.) | – 238,6 | 126,8 | -166,3 |
| C2H5OH (ж.) | -277,0 | 160,7 | -174,2 |
| C2H5OH (г.) | -234,8 | 281,4 | -167,9 |
| D-C6H12O6 (глюкоза р-р.) | -1264,0 | 269,0 | -917,0 |
| CH3COOH (ж.) | -484,9 | 159,8 | -389,4 |
| (CH3)2CO (ж.) ацетон | -248,1 | 200,4 | -155,4 |
| (CH3)2CO (г.) ацетон | -217,6 | 294,9 | -153,1 |
| CO (г.) | -110,5 | 197,5 | -137,1 |
| CO2 (г.) | -393,5 | 213,7 | -394,4 |
| CS2 (г.) | 116,7 | 237,8 | 66,6 |
| CS2 (ж.) | 88,7 | 151,0 | 64,4 |
| CaCO3 (к.) | -1207,0 | 88,7 | -1127,4 |
| CaF2 (к.) | -1214,6 | 68,9 | -1161,9 |
| Ca3N2 (к.) | -431,8 | 105 | -368,6 |
| CaO (к.) | -635,5 | 39,7 | -604,2 |
| Ca(OH)2 (к.) | -986,6 | 76,1 | -896,8 |
| Cl2 (г.) | 0 | 222,9 | 0 |
| Cl2O (г.) | 76,6 | 266,2 | 94,2 |
| ClO2 (г.) | 105,0 | 257,0 | 122,3 |
| Cr2O3 (к.) | -1440,6 | 81,2 | -1050,0 |
| CuO (к.) | -162,0 | 42,6 | -129,9 |
| FeO (к.) | -264,8 | 60,8 | -244,3 |
| Fe2O3 (к.) | -822,2 | 87,4 | -740,3 |
| Fe3O4 (к.) | -1117,1 | 146,2 | -1014,2 |
| H2 (г.) | 0 | 130,5 | 0 |
| HBr (г.) | -36,3 | 198,6 | -53,3 |
| HCN (г.) | 135,0 | 113,1 | 125,5 |
| HCl (г.) | -92,3 | 186,8 | -95,2 |
| HF (г.) | -270,7 | 178,7 | -272,8 |
| HJ (г.) | 26,6 | 206,5 | 1,8 |
| H2O (г.) | -241,8 | 188,7 | -228,6 |
| H2O (ж.) | -285,8 | 70,1 | -237,3 |
| H2S (г.) | -21,0 | 205,7 | -33,8 |
| KCl (к.) | -435,9 | 82,6 | -408,0 |
| KClO3 (к.) | -391,2 | 143,0 | -289,9 |
| MgCl2 (к.) | -641,1 | 89,9 | -591,6 |
| MgO (к.) | -601,8 | 26,9 | -569,6 |
| N2 (г.) | 0 | 191,5 | 0 |
| NH3 (г.) | -46,2 | 192,6 | -16,7 |
| NH4Cl (к.) | -314,2 | 95,8 | 203,2 |
| NH4NO3 (к.) | -365,4 | 151 | -183,8 |
| N2O (г.) | 82,0 | 219,9 | 104,1 |
| NO (г.) | 90,3 | 210,6 | 86,6 |
| N2O3 (г.) | 83,3 | 307,0 | 140,5 |
| NO2 (г.) | 33,5 | 240,2 | 51,5 |
| N2O4 (г.) | 9,6 | 303,8 | 98,4 |
| N2O5 (к.) | -42,7 | 178 | 114,1 |
| NiO (к.) | -239,7 | 38,0 | -211,6 |
| O2 (г.) | 0 | 205,0 | 0 |
| OF2 (г.) | 25,1 | 247,0 | 42,5 |
| P2O3 (к.) | -820,0 | 173,5 | --- |
| P2O5 (к.) | -1492,0 | 114,5 | -1348,8 |
| PbO (к.) | -219,3 | 66,1 | -189,1 |
| PbO2 (к.) | -276,6 | 74,9 | -218,3 |
| SO2 (г.) | -296,9 | 248,1 | -300,2 |
| SO3 (г.) | -395,8 | 256,7 | -371,2 |
| SiCl4 (г.) | -687,8 | 204,6 | 57,2 |
| SiO2 (кварц) | -910,9 | 41,8 | -856,7 |
| SnO (к.) | -286,0 | 56,5 | -256,9 |
| SnO2 (к.) | -580,8 | 52,3 | -519,3 |
| Ti (к.) | 0 | 30,6 | 0 |
| TiCl4 (ж.) | -804,2 | 252,4 | -737,4 |
| TiO2 (к.) | -943,9 | 50,3 | -888,6 |
| WO3 (к.) | -842,7 | 75,9 | -763,9 |
| ZnO (к.) | -350,6 | 43,6 | -320,7 |
Приложение 5. Стандартные электродные потенциалы.
Cr
Al
Au
B
Cu
Be
Bi
Br
H
Hg
Ce
Cl
Mn
| Приложение 5. Стандартные электродные потенциалы. | |||||
| Реакция | E0, В | Реакция | E0, В | ||
| Mo | Mo3+ + 3e− → Mo | −0,200 | S | SO42− + H2O + 2e− → SO32− + 2OH− | −0,93 |
| N | NO3− + 7H2O + 8e− → NH4OH + 9OH− | −0,12 | 2SO42− +5H2O + 8e− → S2O32− + 10OH− | −0,76 | |
| NO3− + H2O + 2e− → NO2− + 2OH− | 0,01 | SO32− + 3H2O + 4e− → S + 6OH− | −0,66 | ||
| 2NO2− + 4H2O + 6e− → N2 + 8OH− | 0,41 | S2O32− + 6H+ + 8e− → 2S2− + 3H2O | −0,006 | ||
| NO3− + 2H+ + e− → NO2 + H2O | 0,80 | SO42− + 8H+ + 8e− → S2− + 4H2O | 0,149 | ||
| NO3− + 10H+ + 8e− → NH4+ + 3H2O | 0,87 | SO42− + 4H+ + 2e− → H2SO3 + H2O | 0,17 | ||
| NO3− + 3H+ + 2e− → HNO2 + H2O | 0,94 | SO32− + 6H+ + 6e− → S2− + 3H2O | 0,231 | ||
| NO3− + 4H+ + 3e− → NO + 2H2O | 0,957 | 2SO42− + 10H+ + 8e− → S2O32− + 5H2O | 0,29 | ||
| NO3− + 4H+ + 3e− → NO +2H2O | 0,96 | SO42− + 10H+ + 8e− → H2S + 4H2O | 0,311 | ||
| HNO2 + H+ + e− → NO + H2O | 1,00 | SO42− + 8H+ + 6e− → S + 4H2O | 0,357 | ||
| 2NO3− + 10H+ + 8e− → N2O + 5H2O | 1,116 | Sc Si | Sc3+ + 3e− → Sc | −2,077 | |
| 2NO3− + 12H+ + 10e− → N2 + 6H2O | 1,246 | SiO32− + 3H2O + 4e− → Si + 6OH− | −1,7 | ||
| 2HNO2 + 4H+ + 4e− → N2O + 3H2O | 1,297 |
Sn | SiO32− + 6H+ + 4e− → Si + 3H2O | −0,455 | |
| 2HNO2 + 6H+ + 6e− → N2 + 4H2O | 1,45 | SnO2 + 2H+ + 2e− → SnO + H2O | −0,108 | ||
| Na | Na+ + e− → Na | −2,714 |
| SnO2 + 4H+ + 4e− → Sn + 2H2O | −0,106 |
| Ni | Ni2+ + 2e− → Ni | −0,25 | SnO + 2H+ + 2e− → Sn + H2O | −0,104 | |
| O | O2 + 2H2O + 4e− → 4OH− | 0,401 |
Sr | Sn4+ + 2e− → Sn2+ | 0,151 |
| O2 + 2H+ +2e− → H2O2 | 0,682 | Sr2+ + 2e− → Sr | −2,888 | ||
| O2 + 4H+ + 4e− → 2H2O | 1,229 | Ti | Ti2+ + 2e− → Ti | −1,63 | |
| Pb | PbO + H2O + 2e− → Pb + 2OH− | −0,58 | TiO2 + 4H+ + 4e− → Ti + 2H2O | −0,86 | |
| PbSO4 + 2e− → Pb + SO42− | −0,356 |
V | Ti3+ + e− → Ti2+ | −0,368 | |
| Pb2+ + 2e− → Pb | −0,126 | V2+ + 2e− → V | −1,175 | ||
| PbO + 2H+ + 2e− → Pb + H2O | 0,248 |
Y | V3+ + e− → V2+ | −0,255 | |
| Pb(OH)2 + 2H+ + 2e− → Pb + H2O | 0,277 | Y3+ + 3e− → Y | −2,372 | ||
| PbO2 + H2O + 2e− → PbO + 2OH− | 0,28 | Zn | Zn(OH)2 + 2e− → Zn + 2OH− | −1,245 | |
| PbO2 + 4H+ + 2e− → Pb2+ + 2H2O | 1,455 | ZnO22− + 2H2O + 2e− → Zn + 4OH− | −1,216 | ||
| PbO2+ SO42− +4H+ +2e− → → PbSO4 + 2H2O | 1,685 |
| Zn2+ + 2e− → Zn | −0,763 | |
| Pb4+ + 2e− → Pb2+ | 1,694 | ZnO22− + 4H+ + 2e− → Zn + 2H2O | 0,441 | ||
| Pt | Pt2+ + 2e− → Pt | 1,188 | Zr | ZrO2 + 4H+ + 4e− → Zr + 2H2O | −1,553 |
| Rb | Rb+ + e− → Rb | −2,925 | Zr4+ + 4e− → Zr | −1,539 | |
|
Приложение 6. Элекрохимический ряд напряжений металлов. | |||||||||||||||||||||||
|
Окислительная способность металлов увеличивается
| |||||||||||||||||||||||
| - | |||||||||||||||||||||||
| Men+ | Li+ | K+ | Ba2+ | Ca2+ | Na+ | Mg2+ | Al3+ | Al3+ | Mn2+ | Zn2+ | Cr3+ | Fe2+ | Cd2+ | Co2+ | Ni2+ | Sn2+ | Pb2+ | H+ | Cu2+ | Ag+ | Hg2+ | Pt2+ | Au3+ |
| φ0, В | −3,05 | −2,92 | −2,91 | −2,87 | −2,71 | −2,38 | −1,66 | −1,66 | −1,18 | −0,78 | −0,74 | −0,44 | −0,4 | −0,28 | −0,25 | −0,14 | −0,13 | 0,00 | 0,34 | 0,8 | 0,85 | 1,19 | 1,5 |
| Me | Li | K | Ba | Ca | Na | Mg | Al | Al | Mn | Zn | Cr | Fe | Cd | Co | Ni | Sn | Pb | H | Cu | Ag | Hg | Pt | Au |
| Взаимодействуют с водой. Вытесняют водород из кислот. | Не взаимодействуют с водой. Вытесняют водород из кислот. | Не взаимодействуют с водой. Не вытесняют водород из кислот. | |||||||||||||||||||||
Литература
1. Глинка, Н. Л. Общая химия в 2 т. Том 1: учебник для академического бакалавриата / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 20-е изд., пер. и доп. — М.: Издательство Юрайт, 2018. — 353 с. — (Серия : Бакалавр. Академический курс). — ISBN 978-5-9916-9353-0. — Режим доступа: www.biblio-online.ru/book/736D053E-E77C-4726-8CC5-F8E756E674A5.
2. Глинка, Н. Л. Общая химия в 2 т. Том 2 : учебник для академического бакалавриата / Н. Л. Глинка ; под ред. В. А. Попкова, А. В. Бабкова. — 20-е изд., пер. и доп. — М. : Издательство Юрайт, 2018. — 379 с. — (Серия : Бакалавр. Академический курс). — ISBN 978-5-9916-9355-4. — Режим доступа : www.biblio-online.ru/book/EBE718FD-189B-494E-A633-DCA7F607FCC9
3. Коровин Н.В. Общая химия. – М.: Высшая школа, 2002 г.
4. Глинка Н.Л. Общая химия. – М.: Интеграл-Пресс, 2001 г.
5. Глинка Н.Л. Задачи и упражнения по общей химии. ‑ М.: Интеграл-Пресс, 2005 г.
6. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2002 г.
7. Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 2000 г.
8. Хомченко И.Г. Общая химия. – М.: Новая волна. ОНИКС, 2001г
9. Хомченко Г.П., Цитович И.К. Неорганическая химия. – М.: Высшая школа, 1987 г
УДК 546 (0758)
Учебно-методическое пособие для самостоятельного разбора задач и контрольных работ по химии для студентов инженерных специальностей Уральского ГАУ по направлению подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств.
Составители: старший преподаватель кафедры химии, почвоведения и агроэкологии Суслов Е.А., старший преподаватель кафедры химии, почвоведения и агроэкологии Саетова Н.С., Екатеринбург, УрГАУ, 2018г., с. 66
Подписано в печать формат 60 х 84 1/16
Объем 4,5 п.л. Тираж экз. заказ №
Уральский государственный аграрный университет
620019, Екатеринбург, ул. К. Либкнехта, 42.
и контрольных работ по химии
для студентов инженерных специальностей Уральского ГАУ
Направление подготовки
15.03.02 Технологические машины и оборудование
Направленность (профиль) программы
Машины и аппараты пищевых производств
Составители: Ст. преподаватель Суслов Е.А.
Ст. преподаватель Саетова Н.С.
Екатеринбург, 2018
УДК 546 (0758)
Учебно-методическое пособие для самостоятельного разбора задач и контрольных работ по химии для студентов инженерных специальностей Уральского ГАУ по направление подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств.
Составители: Старший преподаватель кафедры химии, почвоведения и агроэкологии УрГАУ Суслов Е.А., Старший преподаватель кафедры химии, почвоведения и агроэкологии УрГАУ Саетова Н.С. Екатеринбург, УрГАУ, 2018г., с. 66
Утверждено методической комиссией Инженерного факультета
«_08_»_апреля_ 2018г. Учебно-методическое пособие составлено в соответствии с программой по химии и предназначено для самостоятельного разбора задач и контрольных работ по химии по направлению подготовки 15.03.02 Технологические машины и оборудование Профиль: Машины и аппараты пищевых производств
Уральский государственный аграрный университет, 2018г.
ПРЕДИСЛОВИЕ
Данные учебное пособие разработано в соответствии с программой курса химии и в соответствии с Государственным образовательным стандартом для дисциплины «Химия» по профилю: Машины и аппараты пищевых производств. Пособие направлено на самостоятельное получение навыков решения простых задач по дисциплине «Химия» и является вспомогательным материалом для усвоения теоретического отдельных тем, а также для подготовки к зачету или экзамену. Данные учебное пособие содержит примеры решения типовых задач и блоки заданий для самостоятельного решения или контрольных работ. Пособие может быть использовано для самостоятельного усвоения, домашних заданий и формирования контрольных работ. Вариант задания определяется по последним двум цифрам шифра (номер студенческого билета или зачетной книжки) и приведен в таблице на страницах 4-5. Например, для студента с номером студенческого билета 2018-28 (или 028-12) вариант будет 28 и задачи, соответствующие номеру этого варианта:
| № блока | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 28 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
СОДЕРЖАНИЕ
Классы неорганических соединений. 6
Блок №1. Взаимодействие классов. 10
Блок №2 Цепочки превращений. 12
Расчет молярной массы и массовой доли. 12
Блок №3 Расчеты молярных масс. 16
Химическая термодинамика. 16
Блок №4 Химическая термодинамика. 20
Химическая кинетика. 22
Блок №5. 25
Растворы.. 28
Блок №6. 32
Электролитическая диссоциация. 33
Блок №7. Электролитическая диссоциация. 36
Окислительно-восстановительные реакции. 38
Блок № 8 Окислительно-восстановительные реакции. 42
Гальванический элемент. 44
Блок №9. Гальванический элемент. 48
Коррозия металлов. 49
Блок №10. 52
Электролиз. 53
Блок №11. Процессы при электролизе. 54
Законы электролиза Фарадея. 55
Блок №12. Задачи по законам Фарадея. 56
Приложения. 58
Приложение 1. Периодическая таблица химических элементов. 58
Приложение 2. Названия важнейших кислот и их солей. 59
Приложение 3. Таблица растворимости кислот, солей и оснований в воде. 60
Приложение 4. Стандартные энтальпии (ΔH0298), энтропии (S0298) и энергии Гиббса (ΔG0298) образования некоторых веществ при 298 К. 61
Приложение 5. Стандартные электродные потенциалы. 63
Приложение 6. Элекрохимический ряд напряжений металлов. 65
НОМЕРА ЗАДАНИЙ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
| № варианта | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 01 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 201 | 221 |
| 02 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 202 | 222 |
| 03 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 203 | 223 |
| 04 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 204 | 224 |
| 05 | 5 | 25 | 45 | 65 | 85 | 105 | 125 | 145 | 165 | 185 | 205 | 225 |
| 06 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 206 | 226 |
| 07 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 207 | 227 |
| 08 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 208 | 228 |
| 09 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 209 | 229 |
| 10 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 210 | 230 |
| 11 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 211 | 231 |
| 12 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
| 13 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 213 | 233 |
| 14 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 234 |
| 15 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 215 | 235 |
| 16 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 216 | 236 |
| 17 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 217 | 237 |
| 18 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 218 | 238 |
| 19 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 219 | 239 |
| 20 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 | 220 | 240 |
| 21 | 19 | 39 | 59 | 79 | 99 | 119 | 139 | 159 | 179 | 199 | 219 | 239 |
| 22 | 18 | 38 | 58 | 78 | 98 | 118 | 138 | 158 | 178 | 198 | 218 | 238 |
| 23 | 17 | 37 | 57 | 77 | 97 | 117 | 137 | 157 | 177 | 197 | 217 | 237 |
| 24 | 16 | 36 | 56 | 76 | 96 | 116 | 136 | 156 | 176 | 196 | 216 | 236 |
| 25 | 15 | 35 | 55 | 75 | 95 | 115 | 135 | 155 | 175 | 195 | 215 | 235 |
| 26 | 14 | 34 | 54 | 74 | 94 | 114 | 134 | 154 | 174 | 194 | 214 | 234 |
| 27 | 13 | 33 | 53 | 73 | 93 | 113 | 133 | 153 | 173 | 193 | 213 | 233 |
| 28 | 12 | 32 | 52 | 72 | 92 | 112 | 132 | 152 | 172 | 192 | 212 | 232 |
| 29 | 11 | 31 | 51 | 71 | 91 | 111 | 131 | 151 | 171 | 191 | 211 | 231 |
| 30 | 10 | 30 | 50 | 70 | 90 | 110 | 130 | 150 | 170 | 190 | 210 | 230 |
| 31 | 9 | 29 | 49 | 69 | 89 | 109 | 129 | 149 | 169 | 189 | 209 | 229 |
| 32 | 8 | 28 | 48 | 68 | 88 | 108 | 128 | 148 | 168 | 188 | 208 | 228 |
| 33 | 7 | 27 | 47 | 67 | 87 | 107 | 127 | 147 | 167 | 187 | 207 | 227 |
| 34 | 6 | 26 | 46 | 66 | 86 | 106 | 126 | 146 | 166 | 186 | 206 | 226 |
| 35 | 5 | 25 | 45 | 65 | 85 | 105 | 125 | 145 | 165 | 185 | 205 | 225 |
| 36 | 4 | 24 | 44 | 64 | 84 | 104 | 124 | 144 | 164 | 184 | 204 | 224 |
| 37 | 3 | 23 | 43 | 63 | 83 | 103 | 123 | 143 | 163 | 183 | 203 | 223 |
| 38 | 2 | 22 | 42 | 62 | 82 | 102 | 122 | 142 | 162 | 182 | 201 | 222 |
| 39 | 1 | 21 | 41 | 61 | 81 | 101 | 121 | 141 | 161 | 181 | 202 | 221 |
| 40 | 5 | 25 | 45 | 70 | 90 | 105 | 125 | 150 | 175 | 185 | 203 | 222 |
| 41 | 6 | 26 | 46 | 71 | 89 | 106 | 126 | 151 | 176 | 186 | 204 | 223 |
| 42 | 7 | 27 | 47 | 72 | 88 | 107 | 127 | 152 | 177 | 187 | 205 | 224 |
| 43 | 8 | 28 | 48 | 73 | 87 | 108 | 128 | 153 | 178 | 188 | 206 | 225 |
| 44 | 9 | 29 | 49 | 74 | 86 | 109 | 129 | 154 | 179 | 189 | 207 | 226 |
| 45 | 10 | 30 | 50 | 75 | 85 | 110 | 130 | 155 | 180 | 190 | 208 | 227 |
| 46 | 15 | 35 | 41 | 65 | 95 | 111 | 135 | 141 | 161 | 195 | 209 | 228 |
| 47 | 16 | 36 | 42 | 66 | 94 | 112 | 136 | 142 | 162 | 196 | 210 | 229 |
| 48 | 17 | 37 | 43 | 67 | 93 | 113 | 137 | 143 | 163 | 197 | 211 | 230 |
| 49 | 18 | 38 | 44 | 68 | 92 | 114 | 138 | 144 | 164 | 198 | 212 | 231 |
| 50 | 19 | 39 | 45 | 69 | 91 | 115 | 139 | 145 | 165 | 199 | 213 | 232 |
| 51 | 20 | 40 | 50 | 70 | 85 | 101 | 140 | 155 | 170 | 200 | 214 | 233 |
| 52 | 1 | 21 | 51 | 61 | 84 | 102 | 121 | 156 | 171 | 181 | 215 | 234 |
| 53 | 2 | 22 | 52 | 62 | 83 | 103 | 122 | 157 | 172 | 182 | 216 | 235 |
| 54 | 3 | 23 | 53 | 63 | 82 | 104 | 123 | 158 | 173 | 183 | 217 | 236 |
| 55 | 4 | 24 | 54 | 64 | 81 | 105 | 124 | 159 | 174 | 184 | 218 | 237 |
| 56 | 5 | 25 | 55 | 65 | 100 | 115 | 125 | 160 | 175 | 185 | 219 | 238 |
| 57 | 10 | 26 | 50 | 75 | 99 | 116 | 130 | 145 | 165 | 190 | 220 | 239 |
| 58 | 11 | 30 | 49 | 76 | 98 | 117 | 131 | 146 | 166 | 191 | 219 | 240 |
| 59 | 12 | 31 | 48 | 77 | 97 | 118 | 132 | 147 | 167 | 192 | 218 | 239 |
| 60 | 13 | 32 | 47 | 78 | 96 | 119 | 133 | 148 | 168 | 193 | 217 | 238 |
| 61 | 14 | 33 | 46 | 79 | 95 | 120 | 134 | 149 | 169 | 194 | 216 | 237 |
| 62 | 15 | 34 | 45 | 80 | 85 | 110 | 135 | 150 | 170 | 195 | 215 | 236 |
| 63 | 20 | 35 | 55 | 70 | 86 | 109 | 14 | 145 | 177 | 185 | 214 | 235 |
| 64 | 19 | 40 | 54 | 69 | 87 | 108 | 139 | 144 | 174 | 184 | 213 | 234 |
| 65 | 18 | 39 | 53 | 68 | 88 | 107 | 138 | 143 | 173 | 183 | 212 | 233 |
| 66 | 17 | 38 | 52 | 67 | 89 | 106 | 137 | 142 | 172 | 182 | 211 | 232 |
| 67 | 16 | 37 | 51 | 66 | 90 | 105 | 136 | 141 | 171 | 181 | 210 | 231 |
| 68 | 15 | 36 | 50 | 65 | 81 | 120 | 135 | 150 | 170 | 195 | 209 | 230 |
| 69 | 10 | 35 | 60 | 75 | 82 | 119 | 125 | 149 | 180 | 194 | 208 | 229 |
| 70 | 9 | 25 | 59 | 74 | 83 | 118 | 124 | 148 | 179 | 193 | 207 | 228 |
| 71 | 8 | 24 | 58 | 73 | 84 | 117 | 123 | 147 | 178 | 192 | 206 | 227 |
| 72 | 7 | 23 | 57 | 72 | 85 | 116 | 122 | 146 | 177 | 191 | 205 | 226 |
| 73 | 6 | 22 | 56 | 71 | 95 | 115 | 121 | 145 | 176 | 200 | 204 | 225 |
| 74 | 5 | 21 | 55 | 70 | 96 | 105 | 130 | 155 | 175 | 199 | 203 | 224 |
| 75 | 15 | 35 | 42 | 80 | 97 | 104 | 129 | 154 | 165 | 198 | 201 | 223 |
| 76 | 14 | 34 | 44 | 79 | 98 | 103 | 128 | 144 | 164 | 197 | 202 | 222 |
| 77 | 13 | 33 | 46 | 78 | 99 | 102 | 127 | 143 | 163 | 196 | 203 | 221 |
| 78 | 12 | 32 | 48 | 77 | 100 | 101 | 126 | 142 | 162 | 195 | 215 | 222 |
| 79 | 11 | 31 | 50 | 76 | 90 | 115 | 125 | 141 | 161 | 190 | 205 | 223 |
| 80 | 10 | 30 | 52 | 75 | 91 | 114 | 135 | 150 | 170 | 189 | 214 | 224 |
| 81 | 5 | 29 | 54 | 65 | 92 | 113 | 134 | 160 | 169 | 188 | 219 | 225 |
| 82 | 4 | 28 | 56 | 64 | 93 | 112 | 133 | 159 | 168 | 187 | 217 | 226 |
| 83 | 3 | 27 | 58 | 63 | 94 | 111 | 132 | 158 | 167 | 186 | 204 | 227 |
| 84 | 2 | 26 | 60 | 62 | 95 | 102 | 131 | 157 | 166 | 185 | 216 | 228 |
| 85 | 1 | 25 | 59 | 61 | 82 | 104 | 122 | 156 | 165 | 182 | 214 | 229 |
Дата: 2018-12-28, просмотров: 369.