Аминокислоты – органические соединения, в состав молекул которых входят карбоксильная группа – СООН и аминогруппа – NH2, например:
 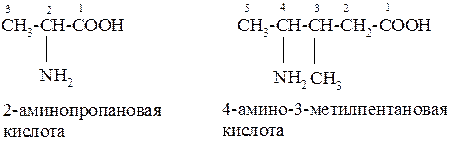
|
Получение
Аминокислоты получают действием аммиака на галогензамещенные карбоновые кислоты, например:
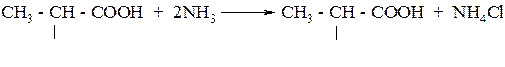
Аминокислоты образуются при гидролизе природных соединений - белков.
Важнейшие аминокислоты
| № п/п | Наименование аминокислот | Формула |
| 1 | Глицин, аминоуксусная кислота | H2N – CH2 - COOH |
| 2 | a-Аланин, a-аминопропионовая кислота |  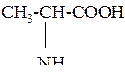
|
| 3 | Валин, g- аминоизовалериановая кислота |   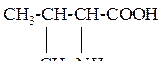
|
| 4 | Лейцин, a-амино-g-метилвалериановая кислота |   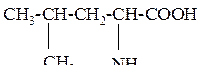
|
| № п/п | Наименование аминокислот | Формула |
| 5 | Изолейцин, a-амино-b-метилвалериановая кислота |   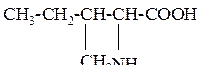
|
| 6 | Фенилаланин, a-амино-b- фенилпропионовая кислота |  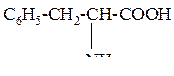
|
| 7 | Аспарагиновая кислота, аминоянтарная кислота |  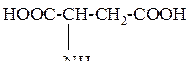
|
| 8 | Глутаминовая кислота, a-амино - глутаровая кислота |  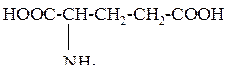
|
| 9 | Лизин, a, e - диаминокапроновая кислота |  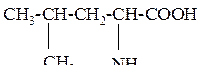
|
| 10 | Серин, a-амино-b-гидроксипропионовая кислота |  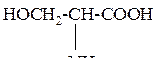
|
| 11 | Треонин, a-амино-b-гидроксимасляная кислота |  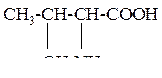
|
| 12 | Цистеин, a-амино-b-тиопропионовая кислота |   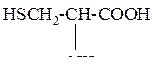 
|
| 13 | Метионин, a-амино-g-метилтиомасляная кислота |  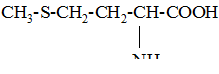
|
Химические свойства
Химические свойства аминокислот обусловлены одновременным присутствием в молекулах двух функциональных групп. Карбоксильная группа, входящая в состав аминокислот, обладает кислотными свойствами (может отщеплять ион водорода), аминогруппа – основными свойствами (может присоединять ион водорода). За счёт этого аминокислоты обладают амфотерностью:
1. Реагируют с щелочами и кислотами, образуют соли, например:
H2N – CH2 – COOH + KOH ® H2N – CH2 – COOK + H2O
H2N – CH2 – COOH + HCl ® [H3N – CH2 – COOH]Cl
2. Со спиртами аминокислоты образуют сложные эфиры, например:
H2N – CH2 – COOH + C2H5OH 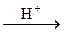 H2N – CH2 – CO – O – C2H5 + H2O
H2N – CH2 – CO – O – C2H5 + H2O
3. При нагревании аминокислоты разлагаются с образованием углекислого газа и амина:
H2N – CH2 – COOH ® H2N – CH3 + CO2
4. Аминокислоты могут взаимодействовать с галогенопроизводными углеводородов:
H2N – CH2 – COOH 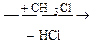 СH3NH – CH2 – COOH
СH3NH – CH2 – COOH 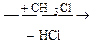
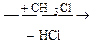 (CH3)2N – CH2 – COOH
(CH3)2N – CH2 – COOH
5. Аминокислоты вступают в реакции, в которых участвуют карбоксильная и аминогруппа различных молекул, например:
H2N – CH2 – COOH + H2N – CH2 – COOH ®
® H2N – CH2 – CO – NH – CH2 – COOH + H2O
Образующееся соединение называется пептидом (– СО – NH – пептидная связь).
Белки – природные соединения (полимерные вещества), представляющие собой продукты поликонденсации некоторых 2-аминокислот. Структуру цепи такого белкового полимера можно представить следующим образом:
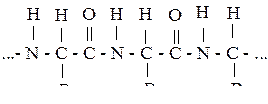
где: R1, R2, R3 – боковые радикалы одинаковых или различных 2 - аминокислот.
Число остатков аминокислот, входящих в пептидную цепь, бывает очень большим, поэтому молекулярные массы белков достигают несколько миллионов. Белки образованы из более 20 аминокислот.
Важнейшее свойство белков – их способность к гидролизу. Гидролиз протекает под действием кислот или биологически активных веществ (ферментов). В результате гидролиза образуется смесь 2- аминокислот.
Примеры решения типовых задач
Пример № 1. Определите строение сложного эфира аминокислоты, если известно, что он содержит 15,73 % азота по массе.
Решение:
Сложные эфиры a- аминокислот описываются общей формулой:


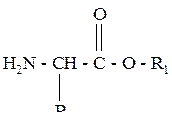

где: R – водород или углеводородный радикал;
R1 – углеводородный радикал.
В одном моле этого вещества содержится один моль азота (М = 14 г), что составляет 15,73 % от общей (молярной) массы, следовательно, молярная масса эфира равна: М(H2N – CH(R) – COOR1) = 14/0,1573 = 89 г/моль. На долю двух радикалов приходится M(R + R1) = 89 – M(H2N + CH + COO) = 16 г/моль.
Это возможно лишь в случае, если R = H; R1 = CH3. Таким образом, искомый эфир аминоуксусной кислоты: H 2 N – CH 2 – COO – CH 3 .
Пример № 2. Напишите уравнения реакций образования трипептидов:
а) из аминоуксусной кислоты;
б) из аминоуксусной кислоты, аланина и цистеина.
Решение: Пептиды образуются при конденсации молекул аминокислот, при этом взаимодействует группа - NH 2 одной молекулы и группа –СООН другой.
1. При конденсации трёх молекул аминоуксусной кислоты протекает следующая реакция:
H2N – CH2 – COOH + H2N – CH2 – COOH + H2N – CH2 – COOH ®
® H2N – CH2 – CO – NH – CH2 – CO – NH – CH2 – COOH + 3H2O
2. Конденсация трёх аминокислот может произойти в различной последовательности, например в такой:


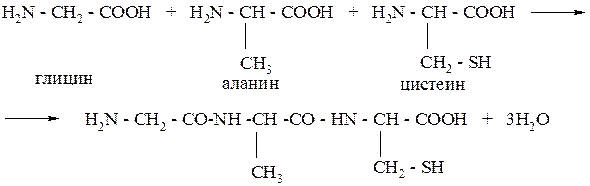
Пример № 3. С помощью каких реакций можно осуществить следующие превращения: сахароза → глюкоза → глюконовая кислота?
Решение:
Сахароза гидролизуется при нагревании в подкисленном растворе:
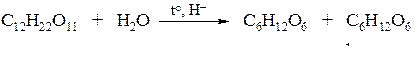
Глюкоза окисляется свежеосаждённым гидроксидом меди (II) с образованием глюконовой кислоты (С6Н12О7):
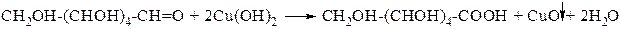
Пример № 4. Полученное из глюкозы соединение С3Н6О3 в реакции с натрием образует соединение состава C3H4Na2O3, с карбонатом кальция −С6Н10СаО6, с этанолом в присутствии серной кислоты − С5Н10О3. Назовите это соединение и напишите уравнения реакций.
Решение: При молочнокислом брожении из глюкозы получается молочная(2-гидроксипропановая) кислота: С6Н12О6 → 2СН3-СН(ОН)-СООН.
В реакции молочной кислоты с натрием участвуют и гидроксильная и карбоксильная группы:
СН3-СН(ОН)-СООН + 2Na → CH3-CH(ONa)-COONa + H2
С карбонатом кальция и с этанолом молочная кислота реагирует как обычная карбоновая кислота:
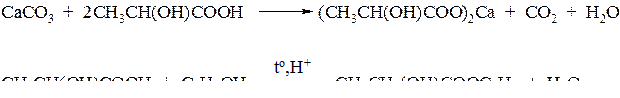
Пример № 5. Массовая доля крахмала в картофеле составляет 20 %. Рассчитайте массу глюкозы, которая может быть получена из картофеля массой 405 кг. Выход продукта равен 70 %.
Решение: Составляем уравнение реакции гидролиза крахмала, в результате которой образуется глюкоза:
(С6Н10О5) + хН2О → хС6Н12О6
Рассчитаем массу крахмала в картофеле:
m(крахмала) = ω(крахмала)∙ m(картофеля)/100 = 20 ∙ 405/100 = 81 кг
Определяем количество вещества крахмала:
n(крахмала)=m(крахмала)/M(крахмала)= 81/162x = 1/2x кмоль
Из уравнения реакции гидролиза крахмала следует
n(крахмала)/ n(глюкозы) = 1/x,
откуда получаем
n(глюкозы) = x∙n (крахмала); n(глюкозы) = x/2x = 0,5 кмоль
Вычисляем массу глюкозы, которую можно получить при количественном выходе:
m(глюкозы) = n(глюкозы)М(глюкозы); m(глюкозы) = 0,5∙180 кг = 90 кг.
Учитывая массовую долю выхода продукта, рассчитаем массу реально полученной глюкозы:
mр(глюкозы) = 90∙ 70/100 = 63 кг
Упражнения и задачи для самостоятельной работы
316. Напишите структурные формулы следующих аминокислот:
| а) 5-амино-2,3диметилгексановой; | |
| б) 2,7 - диамино - 3,4,5 - триметилгептановой. | |
317. Напишите структурные формулы изомерных аминокислот, соответствующих составу C3H7O2N. Назовите их.
318. Напишите формулы структурных изомеров аминокислот C4H9O2N и укажите изомеры:
| а) с первичной аминогруппой; | б) со вторичной аминогруппой. |
319. Напишите уравнения реакций, которые подверждают амфотерность валина (2-амино-3-метилбутановой кислоты). Какие свойства (основные или
кислотные) будут преобладать у аспаргиновой кислоты (2-аминобутандиовой кислоты)?
320. Предложите способ получения этилового эфира аминоуксусной кислоты, исходя из ацетилена и неорганических веществ?
321. Предложите способ получения аланина из пропанола-1 и неорганических веществ.
322. За счёт чего происходит образование дипептидов? Напишите уравнение реакций между a-аминоуксусной и a-аминопропионовой кислотами.
323. Что происходит при нагревании следующих аминокислот:
| а) a- и b-аминопропионовых; | б) a-, b-, g-аминомасляных; |
| в) a- и b- аминоизомасляных. | |
324. Сколько трипептидов может быть получено из трёх аминокислот: цистена; аланина; лизина? Приведите структуры двух возможных трипептидов.
325. В результате мягкого гидролиза некоего трипептида образовались (кроме индивидуальных аминокислот) два дипептида: аланин-валин и
валин-изолейцин. Какова структура исходноготрипептида?
326. Сколько тетрапептидов могут образовать четыре разных аминокислоты? Сколько продуктов получится при неполном гидролизе любого из этих пептидов?
327. Определите формулу сложного эфира аминоуксусной кислоты, массовая доля кислорода в котором равна 31,07 %.
328. Напишите уравнения реакций между валином (2 – амино – 3 – метилбутановой кислотой) и следующими веществами:
| а) гидроксидом натрия; | б) бромоводородной кислотой; |
| в) метанолом (в присутствии каталитических количеств сильной кислоты). | |
329. Напишите уравнения реакций, доказывающих амфотерный характер аланина (2-аминопропионовой кислоты). Почему не изменяется цвет индикатора лакмуса в водном растворе аланина?
330. Напишите уравнения реакций, которые надо провести для осуществления следующих превращений:
CH3COOH ® А ® NH2 – CH2COOH ® Б ® [CH3NH3]Cl
Назовите вещества А и Б.
331. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
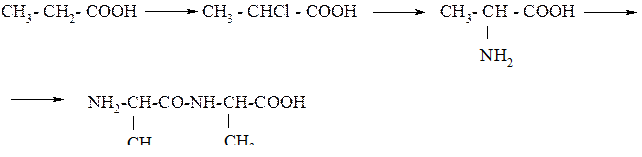
332.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:


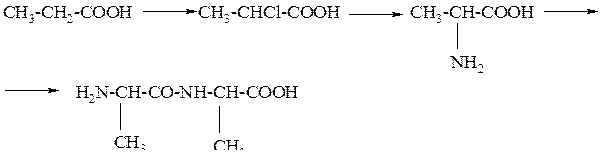
При каких условиях протекают эти реакции.
333.Напишите структурные формулы следующих пептидов:
| а) глицил-аланил-лейцина; | б) валил-аланил-глицина; |
| в) глицил-фенилаланил-валина. | |
334. Назовите вещество, которое образуется, если продукт реакции взаимодействия аланина с хлорангидридом бромуксусной кислоты подвергнуть действию избытка аммиака. Напишите уравнения реакций.
335. Аминоуксусная кислота получена из уксусной кислоты массой 24 г (массовая доля выхода 70 %). Вычислите объем раствора гидроксида натрия (массовая доля NaOH 15 %, плотность 1,16 г/мл), который потребуется для нейтрализации полученной аминоуксусной кислоты.
336. Вычислите минимальный объем аммиака, который надо пропустить через раствор хлоруксусной кислоты массой 250 г (с массовой долей 25 %) для полного превращения её в аминоуксусную кислоту.
337. Вычислить массу 25 %-ного раствора аминоуксусной кислоты, которую можно получить из 15 г уксусной кислоты двухстадийным синтезом с выходом продукта на каждой стадии 80 %.
338. Напишите уравнения реакций, с помощью которых можно из карбида кальция и неорганических веществ в несколько последовательных стадий получить аминоуксусную кислоту. Вычислите массу полученной кислоты, если был использован технический карбид массой 80 г (массовая доля СаС2 80 %).
339. Из уксусной кислоты массой 54 г получена хлоруксусная кислота, массовая доля выхода продукта составила 75 %. Через раствор хлоруксусной кислоты пропущен аммиак объемом 13,5 л. Вычислите, сколько аминоуксусной кислоты было получено.
340. Смесь массой 30 г, состоящая из метиламина, аминоуксусной кислоты и этилацетата может прореагировать с хлороводородом объёмом 7,4 л (н.у.). Та же смесь массой 40 г может прореагировать с 300 мл 1,4М раствора гидроксида калия. Вычислите массовые доли веществ в исходной смеси.
341. При нагревании аминокислоты массой 8,24 г выделился газ объёмом 1792 мл. Сколько мл 6 % раствора соляной кислоты (плотностью 1,03 г/мл) было израсходовано на его нейтрализацию?
342. Из уксусной кислоты массой 30 г с выходом 60% получили аминоуксусную кислоту. Какой объем раствора гидроксида калия с массовой долей 0,12 и плотностью 1,1 г/мл необходим для реакции с полученной аминоуксусной кислотой?
343. Вычислите массу 15 % - го раствора аминоуксусной кислоты, которую можно получить из 15 г уксусной кислоты двухстадийным синтезом с выходом продукта на каждой стадии, равным 75 %.
344. К 150 г 5% - го раствора аминоуксусной кислоты добавили 100 г 5 % - раствора гидроксида калия. Определите массовые доли веществ в полученном растворе.
345. Какой объем аммиака потребуется для превращения бромуксусной кислоты массой 27,8 г в глицерин, если потеря аммиака составляет 5 %.
346. Массовая доля кислорода в одноосновной аминокислоте равна
42,67 %. Установите молекулярную формулу кислоты.
347. Установите молекулярную формулу третичного амина, если известно, что при его сгорании выделилось 0,896 л (н.у.) углекислого газа, 0,99 г воды и 0,112 л (н.у.) азота.
348. Из уксусной кислоты массой 108 г получена хлоруксусная кислота, массовая доля выхода продукта составила 75 %. Через раствор хлоруксусной кислоты пропущен аммиак объемом 27 л. Вычислите, сколько аминоуксусной кислоты было получено.
349. При взаимодействии α-аминопропановой кислоты массой 44,5 г с гидроксидом натрия образовалась соль массой 50 г. Рассчитайте массовую долю выхода соли.
350. Определите молекулярную формулу аминокислоты, массовые доли углерода, кислорода и азота в которой составляют 32; 6,66; 42,67 и 18,67 %.
Напишите структурную формулу этой аминокислоты и назовите ее.
УГЛЕВОДЫ
Углеводы – один из основных классов органических соединений, встречающихся в природе. Их общая формула Cn ( H 2 O ) m (n,m ³ 3).
Углеводы подразделяют на три большие группы.
I) Моносахариды, или простые сахара (виноградный сахар, плодовый сахар).
Это такие углеводы, которые не могут гидролизоваться с образованием более простых углеводов. Простейший моносахарид – глицериновый альдегид – С3Н6О3
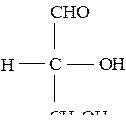
Остальные моносахариды по числу атомов углерода подразделяются:
1) на тетрозы (С4Н8О4);
2) на пентозы (С5Н10О5);
3) на гексозы (С6Н12О6).
К важнейшим гексозам относятся глюкоза, фруктоза, галактоза, манноза:

II) Олигосахариды – продукты конденсации небольшого числа моносахаридов. К важнейшим олигосахаридам состава С12Н22О11 относятся:
1) сахароза – С12Н22О11(состоит из остатков D-глюкозы и D-фруктозы);
2) мальтоза – (состоит из 2 остатков D-глюкозы);
3) лактоза – (состоит из остатков D-галактозы и D-глюкозы).
III) Полисахариды образованы большим числом молекул моносахаридов. В частности, крахмал, целлюлоза состоят из остатков D-глюкозы.
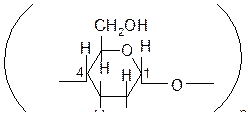
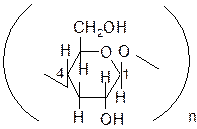
крахмал целлюлоза
Глюкоза
Глюкоза– по своей распространённости намного превосходит остальные моносахариды. В свободном виде встречается во фруктах, растениях, мёде, в крови и моче, в связанном виде – во многих гликозидах, дисахаридах и полисахаридах. Глюкоза – это белые кристаллы, сладкие на вкус, хорошо растворимые в воде.
В линейной форме молекулы глюкозы содержат одну альдегидную группу и пять гидроксильных групп. В кристаллическом состоянии молекулы глюкозы находятся в одной из двух циклических форм (a-глюкоза или b-глюкоза), которые образуются из линейной формы за счёт взаимодействия гидроксильной группы при 5-м атоме углерода с карбонильной группой.
Буква a в названии циклических форм моносахаридов означает, что группа -ОН при первом углеродном атоме и группа –СН2ОН при шестом углеродном атоме находятся по разные стороны от плоскости кольца.
В b-сахаридах эти группы находятся по одну сторону от плоскости кольца:
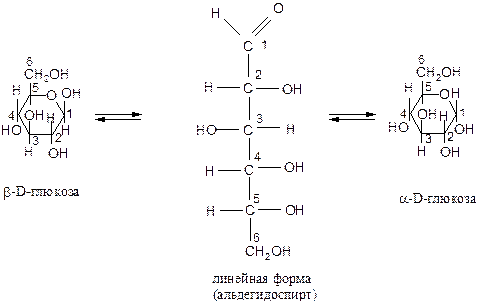
Данное равновесие существует в водном растворе.
Процесс образования циклических форм глюкозы из линейной можно представить следующим образом. Атом водорода группы –ОН при 5-м атоме углерода перемещается к атому кислорода альдегидной группы −СН=О, а между атомами С(1) и С(5) устанавливается связь через атом кислорода с образованием шестичленного цикла:
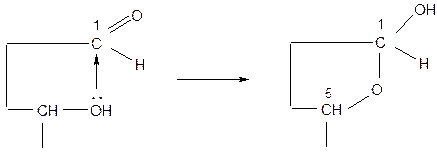
Шестичленный цикл называется пиранозным.
Если во взаимодействие с альдегидной группой вступает группа –ОН при 4-м атоме углерода, то образуется пятичленный цикл, который называется фуранозный (фруктоза).
Группа –ОН при первом углеродном атоме в циклических формах называется гликозидным гидроксилом. Эта группа резко отличается по свойствам от остальных четырёх гидроксильных групп.
Химические свойства
В молекуле глюкозы присутствуют гидроксильные группы, а в линейной форме присутствует альдегидная группа. По этим группам происходят химические взаимодействия.
I. Реакции по альдегидной группе:
1) Глюкоза вступает в реакцию с аммиачным раствором оксида серебра
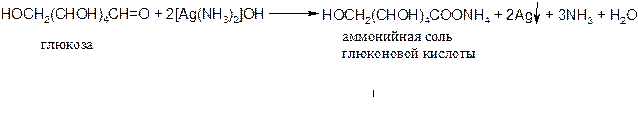
2) Глюкоза при нагревании окисляется гидроксидом меди (II) в глюконовую кислоту

3). При восстановлении альдегидной группы глюкоза образует шестичленный спирт – сорбит
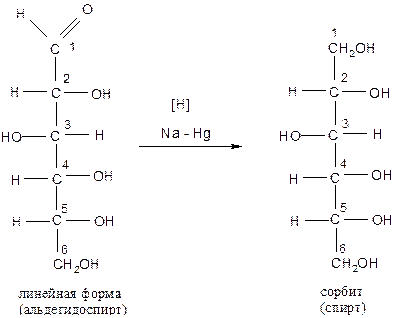
II. Реакции по гидроксильным группам
4) С гидроксидом меди (II) без нагревания глюкоза реагирует как многоатомный спирт и при этом образуется комплекс с характерным синим окрашиванием:
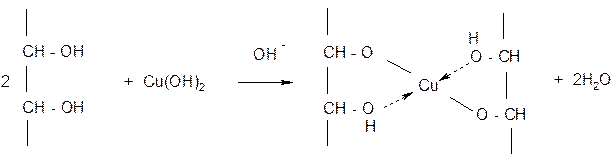
5) При действии метилового спирта в присутствии катализатора (HCl) гликозидный гидроксил замещается на группу ОСН3 и образует монометиловый эфир глюкозы:
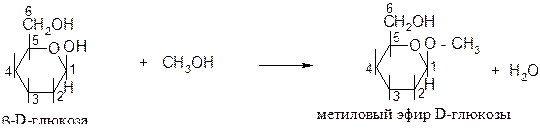
6) Молекулы глюкозы способны к расщеплению под действием различных микроорганизмов. Эта реакция называется брожением.
а) спиртовое брожение:
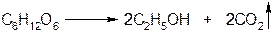
б) молочнокислое брожение:
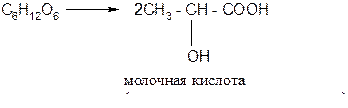
в) маслянокислое брожение:
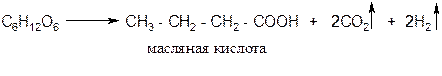
Биологическая роль глюкозы
Глюкоза образуется в природе в процессе фотосинтеза, протекающего под действием солнечного света в листьях растений:

В живых организмах происходит окисление глюкозы под действием кислорода воздуха по обратной реакции:
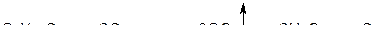
При этом выделяется энергия, которая используется живым организмом.
Фруктоза
Фруктоза может существовать в линейной и циклической формах:
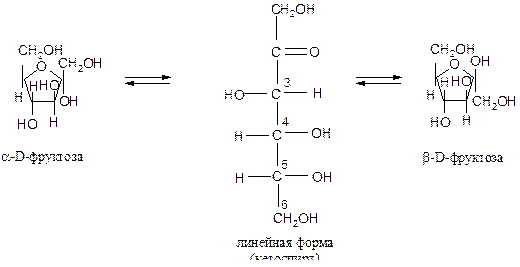
В линейной форме она представляет собой кетоспирт с пятью гидроксильными группами, а в циклической форме – кетофуранозу (пятичленный цикл с атомом кислорода).
Фруктоза вступает во все реакции многоатомных спиртов, но в отличие от глюкозы не реагирует с аммиачным раствором Ag2O.
ОЛИГОСАХАРИДЫ
Дисахариды
Важнейшими дисахаридами являются изомеры (сахароза, мальтоза, лактоза); их общая формула – С12Н22О11.
Сахароза – состоит из двух циклов: шестичленного (остатка a-глюкозы в пиранозной форме) и пятичленного (остатка b-фруктозы), которые соединяются между собой за счёт гликозидного гидроксила глюкозы
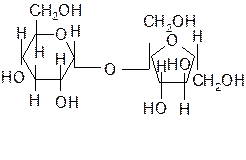
Мальтоза – состоит из двух остатков a-глюкозы, соединённых через 1-й и 4-й атомы углерода
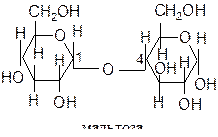
Химические свойства
1) Гидролиз дисахаридов в кислой среде или под действием ферментов приводит к разрыву связи между двумя циклами. В результате гидролиза образуются моносахариды:
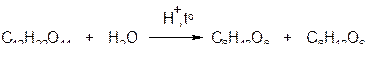
2. Реакции окисления
По отношению к окислителям дисахариды делятся на два типа:
а) восстанавливающие дисахариды (мальтоза и лактоза)
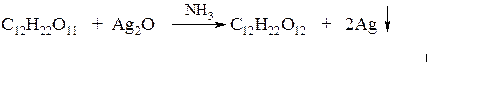
Восстановительные свойства мальтозы и лактозы обусловлены тем, что их циклические формы содержат гликозидный гидроксил. Эти дисахариды могут переходить из циклической формы в линейную, содержащую альдегидную группу. Альдегидная группа реагирует с Ag2O и Ca(OH)2;
б) невосстанавливающие дисахариды (сахароза).
В молекуле сахарозы нет гликозидного гидроксила, поэтому её циклическая форма не может раскрыться и перейти в альдегидную форму.
ПОЛИСАХАРИДЫ
Полисахариды можно представить как продукт поликонденсации моносахаридов. Их общая формула (С6Н10О5)п.
Крахмал – природный полимер, образованный остатками a-глюкозы.
Существует в двух формах – амилозы и амилопектина. Амилоза растворима в воде, это линейный полимер
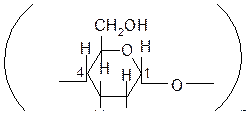
Линейная полимерная цепь в молекуле амилозы свёрнута в спираль. Внутри спирали находится канал размером 0,5 нм, который может захватывать некоторые молекулы, например молекулу йода. При этом образуется комплексное соединение, которое имеет характерное синее окрашивание.
Химические свойства
При нагревании в кислой среде крахмал гидролизуется. При этом образуется ряд промежуточных продуктов. Конечный продукт гидролиза –
α-глюкоза
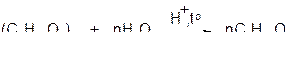
Эта реакция имеет важное промышленное значение, так как из глюкозы получают этиловый спирт и молочную кислоту.
Крахмал образуется в растениях при фотосинтезе и откладывается в корнях и семенах. Крахмал представляет собой белый порошок, нерастворимый в холодной воде. В горячей воде крахмал образует коллоидный раствор.
Крахмал является ценным питательным продуктом. Он входит в состав хлеба, картофеля, круп и наряду с сахарозой является важнейшим источником углеводов в человеческом организме.
Целлюлоза (клетчатка)
Целлюлоза – основное вещество растительных клеток. Древесина на 50 % состоит из целлюлозы, а хлопок и лён – практически чистая целлюлоза. Целлюлоза представляет собой твёрдое волокнистое вещество, нерастворимое в воде, но растворимое в аммиачном растворе гидроксида меди (II).
В отличие от молекул крахмала, молекулы целлюлозы состоят только из линейных цепей, содержащих остатки b-глюкозы, которые связаны через 1-й и 4-й углеродные атомы.
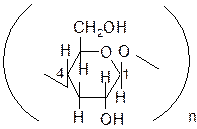
Химические свойства
1) Гидролиз целлюлозы происходит при нагревании в кислой среде. Конечный продукт гидролиза – b-глюкоза.
2) Для целлюлозы характерны реакции образования сложных эфиров.
Каждое структурное звено молекулы целлюлозы содержит по три гидроксильные группы. Гидроксильные группы могут реагировать с азотной и уксусной кислотами; в результате реакций образуются эфиры:
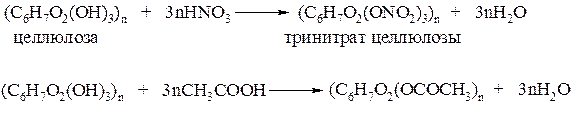
Тринитрат целлюлозы (пироксилин) – взрывчатое вещество; на его основе готовят бездымный порох. Из триацетата целлюлозы изготовляют лаки, киноплёнку и ацетатное волокно.
Примеры решения типовых задач
Пример № 1. С помощью каких реакций можно осуществить следующие превращения:
сахароза ® глюкоза ® глюконовая кислота?
Решение:
Сахароза гидролизуется при нагревании в подкисленном растворе:
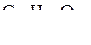 + Н2О
+ Н2О 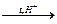
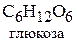 +
+ 
Глюкоза окисляется свежеосаждённым гидроксидом меди (II) с образованием глюконовой кислоты:
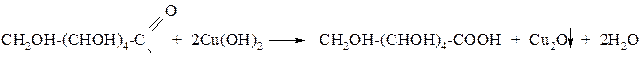
Пример № 2.Рассчитайте объём оксида углерода (IV), который выделится при спиртовом брожении глюкозы массой 720 г (н.у.).
Решение: 1. Определяем количество вещества глюкозы, подвергнувшейся брожению:
n(глюкозы) =  n(глюкозы) =
n(глюкозы) = 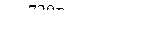
2. Составляем уравнение реакции спиртового брожения глюкозы:
С6Н12О6 ® 2С2Н5ОН + 2СО2
3. Из уравнения реакции следует, что:
n(СО2) = 2n(глюкозы); n(СО2) = 2 × 4 = 8 моль
4. Рассчитываем объём выделившегося газа, приведённый к нормальным условиям:
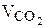 = n(СО2) Vмоль;
= n(СО2) Vмоль; 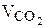 = 8 × 22,4 л/моль = 179,2 л .
= 8 × 22,4 л/моль = 179,2 л .
Пример № 3. Массовая доля крахмала в картофеле равна 20 %. Рассчитайте массу глюкозы, которую можно получить из картофеля массой 500 кг. Выход продукта равна 60 %.
Решение.
1. Вычисляем массу крахмала, содержащегося в картофеле:
m(крахмала)= 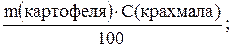
m(крахмала)= 
2. Молярную массу крахмала (С6Н10О5)х можно представить в следующем виде:
M(крахмала) = х × (6 × 12 + 10 ×1 + 5 × 16) кг/кмоль = 162х кг/кмоль
3. Вычислим количество вещества крахмала в картофеле:
n(крахмала) =  n(крахмала) =
n(крахмала) = 
4. Составляем уравнение реакции гидролиза крахмала до глюкозы:
(С6Н10О5)х + хН2О ® хС6Н12О6
Из уравнения следует, что:
n(глюкозы) = х ×n(крахмала);
n(глюкозы) = х × 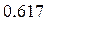 = 0,617 кмоль
= 0,617 кмоль
5. Рассчитываем массу глюкозы, которую можно было бы получить при количественном выходе:
m(глюкозы) = n(глюкозы)×M(глюкозы);
m(глюкозы) = 0,617 кмоль× 180 кг/кмоль = 111 кг
6. Зная массовую долю выхода продукта, вычисляем массу реально полученной глюкозы:
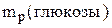 =
= 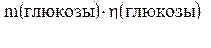
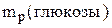 =
= 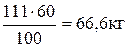
Ответ: 66,6 кг
Упражнения и задачи для самостоятельной работы
351. Приведите уравнения реакции, с помощью которых можно различить глюкозу и сахарозу.
352. Напишите уравнение реакции молочнокислого брожения глюкозы.
353. На основе электронных представлений о химических связях поясните процесс образования циклических форм глюкозы (пиранозных и функциональных) из альдегидной.
354. Приведите структурную формулу мальтозы, представляющей собой дисахарид, образованный двумя остатками a-глюкозы, связанными между собой 1,4-гликозидной связью.
355. Напишите уравнения реакции в соответствии со схемой:
целлюлоза ® глюкоза ® пентаацетат глюкозы
356. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
СО2 ® крахмал ® глюкоза ® этанол ® бромэтан
357. Составьте уравнения реакции с участием глюкозы:
а) окисление аммиачным раствором оксида серебра;
б) этерификация с уксусной кислотой.
358. Напишите уравнения следующих реакций с участием целлюлозы:
| а) гидролиза; | б) этерификации с избытком уксусной кислоты; |
| в) этерификации с избытком азотной кислоты. | |
Почему целлюлоза не вступает в реакцию "серебряного зеркала"?
359. Напишите структурные формулы:
| 1) альдегидной и циклических форм глюкозы; | 2) нескольких фрагментов цепи крахмала; |
| 3) нескольких ферментов цепи целлюлозы. | |
360. Напишите уравнения реакций:
| а) фотосинтеза крахмала; | в) молочнокислого брожения глюкозы; |
| б) спиртового брожения глюкозы | г) восстановления глюкозы до сорбита; |
| д) образования сахаридов меди. | |
361. В чём сходство и различие в строении крахмала и целлюлозы? Почему из крахмала нельзя получить волокна? Напишите структурную формулу амилозы, состоящей из остатков a-глюкозы.
362. Чем объяснить высокую прочность целлюлозы и её нерастворимость в воде? Напишите уравнения реакций, характеризующие свойства целлюлозы.
363. Напишите уравнения реакций, подтверждающие биологическое значение крахмала и сущность его превращения в организме человека.
364. В чём отличие в строении восстанавливающих и не восстанавливающих дисахаридов?
365. Какие невосстанавливающие дисахариды не вступают в реакцию «серебряного зеркала» даже после полного гидролиза.
366. При брожении глюкозы получен этанол массой 110,4 г, выход которого составил 85 %. Вычислите массу глюкозы, которая подверглась гидролизу.
367. Рассчитайте массу целлюлозы, которая потребуется для получения тринитроцеллюлозы массой 891 г с выходом 75 %.
368. Рассчитайте массу кукурузных зерен, которых надо взять для получения спирта массой 145 кг (массовая доля этанола 96 %), если выход спирта составляет 75 %. Массовая доля крахмала в кукурузных зернах составляет
70 %.
369. Из крахмала массой 16,2 г получена глюкоза, выход который составляет 75 %. К глюкозе добавлен избыток аммиачного раствора оксида серебра. Рассчитайте массу серебра, образовавшегося при этом.
370. Определите массу крахмала, которые надо подвергнуть гидролизу, чтобы из полученной глюкозы при молочнокислом брожении образовалось молочная кислота массой 216 г. Массовая доля выхода продукта гидролиза крахмала равна 85 %, продукта брожения глюкозы – 70 %.
371. Рассчитайте массу триацетата целлюлозы, который можно получить из древесных отходов массой 2,5 т (массовая доля выхода равна 80 %). Массовая доля целлюлозы в древесине равна 50 %.
372. Массовая доля целлюлозы в древесине равна 50 %. Определите массу спирта, который может быть получен при брожении глюкозы, образовавшейся при гидролизе древесных опилок массой 810 кг. Учтите, что спирт выделяется из реакционной смеси в виде раствора с массовой долей 15 %. Выход этанола из-за производственных потерь составляет 70 %.
373. На смесь глицерина, фенола и глюкозы массой 36,6 г подействовали гидроксидом меди (II), при этом образовался осадок синего цвета массой 38 г. При взаимодействии этой смеси с оксидом серебра получился осадок серебра массой 21,6 г. Определите массовую долю смеси.
374. Глюкоза массой 320 г была подвергнута спиртовому брожению с выходом продукта 75 %. Образовавшийся спирт количественно окислили в кислоту. Определите объём раствора гидроксида натрия с массовой долей 0,20 и плотностью 1,225 г/мл, необходимого для нейтрализации полученной кислоты.
375. Массовая доля целлюлозы в древесине равна 50 %. Какая масса раствора спирта, содержащего 10 % воды, может быть получена при гидролизе 100 кг древесных опилок и брожения полученной глюкозы, если выход этанола в процессе брожения равен 75 %.
376. Массовая доля крахмала в картофеле равна 18 %. Определите массу крахмала, который можно получить из 60 кг картофеля, если выход продукта реакции равен 70 %.
377. Сколько литров воздуха (при нормальных условиях) потребуется для того, чтобы получить массу СО2, достаточного для образования в процессе фотосинтеза глюкозы массой 9 г, если молекулы СО2 составляют 0,03 % всех молекул воздуха?
378. При действии азотной кислоты на целлюлозу получено производное, в котором массовая доля азота равна 11,1 %. Какое производное целлюлозы получено? Составьте уравнение реакции его получения.
379. Вычислите объем раствора азотной кислоты, (массовая доля HNO3
80 %, плотность 1,46 г/мл), который надо взять для получения тринитроцеллюлозы массой 297 г.
380. Массовая доля крахмала в кукурузных зёрнах равна 70 %. Определите массу кукурузных зёрен, которую нужно взять для получения 100 кг этанола с массовой долей спирта 96 %, если выход спирта из крахмала равен 75 %.
381. Из 200 кг древесных опилок, массовая доля целлюлозы в которых равна 60 %, было получено 72 кг глюкозы в результате гидролиза. Каков ее выход от теоретически возможного?
382. Какую массу целлюлозы за сутки подвергли гидролизу, если при этом на гидролизном заводе из древесных опилок получили 150 т 96 % -ного гидролизного этилового спирта?
383. Сколько целлюлозы и азотной кислоты (в кг) нужно для производства 8 т тринитроцеллюлозы, если выход ее составляет 88 % от теоретически возможного?
384. Каков выход этилового спирта в процентах от теоретически возможного, если из 5 т картофеля, содержащего 0,2 % крахмала, было получено 450 л 95 %-ного этилового спирта с плотностью 0,8 кг/л?
385. Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) крахмал → мальтоза → глюкоза → этиловый спирт → уксусноэтиловый эфир → ацетат натрия;
б) углекислый газ → крахмал → глюкоза → этиловый спирт → уксусный альдегид → уксусная кислота → триацетилцеллюлоза.
Литература
1. Кухарева Т.С., Мишина В.Ю., Ванюгина Т.В., Мосюров С.Е. Задачник по органической химии. Учебное пособие в 2 ч.− М.: МГПУ, 2011.
2. Буянов В.Н., Манаков И.В., Тарщиц Д.Л. Органическая химия. Задания для подготовки к контрольным работам. Учебное пособие.– М.: РХТУ им.
Д.И.Менделеева, 2009.
3. Карпов С.С., Нуриев Н., Теренин В.П., Зайцева Г.С. Задачи по общему курсу органической химии с решениями для бакалавров. Учебное пособие.–
М.: БИНОМ, 2015.
4.Иванов В.Г., Гева О.Н., Гаверова Ю.Г. Сборник задач и упражнений по органической химии. Учебное пособие. – М.: Академия, 2013.
5. Резников В.А. Сборник задач и упражнений по органической химии. Учебно-методическое пособие.– М.: Лань, 2014.
6. Вшивков А.А., Пестов А.В. Органическая химия. Задачи и упражнения.− Екатеринбург: Изд − во Уральского университета, 2015.
Дата: 2018-12-21, просмотров: 922.